Введение
Аденомы гипофиза (АГ) – это доброкачественные новообразования, на долю которых приходится до 15% внутричерепных опухолей [1–3]. Предполагаемая распространенность АГ более 10 мм в диаметре значительно ниже, примерно 0,2% [4, 5]. Наиболее распространенным типом АГ являются пролактиномы (46,2–66,2%), за которыми следуют гормонально-неактивные аденомы (14,7–37%) [6–8]. До 95% опухолей возникают спорадически, хотя существует несколько наследственных заболеваний, которые повышают риск образования АГ. К таким состояниям относятся множественная эндокринная неоплазия 1-го типа, Карни-комплекс, синдром Маккьюна–Олбрайта–Брайцева, мутации AIP и синдромы, связанные с сукцинатдегидрогеназой [9].
Тактика лечения АГ зависит от гормонального статуса, размера опухоли и неврологической симптоматики. «Золотым» стандартом лечения большинства АГ служит транссфеноидальная эндоскопическая хирургия. Наблюдение оправданно при гормонально-неактивных аденомах, не вызывающих неврологической симптоматики и не увеличивающихся в динамике [10, 11].
Большинство макроаденом гипофиза на сегодняшний день подлежит хирургическому лечению, в связи с чем информация о естественном течении этих опухолей скудна. В этой статье мы сообщаем о случае спонтанного уменьшения АГ у 31-летнего мужчины.
Описание клинического случая
Пациент В. 1990 г.р. с сентября 2022 г. стал отмечать головную боль, в связи с чем обратился к неврологу. Направлен на МРТ головного мозга, при которой выявлена эндосупраселлярная опухоль.
При обращении в сентябре 2022 г. пациент предъявлял жалобы на периодическую давящую, непульсирующую головную боль.
Индекс Карновского – 90. Сопутствующие заболевания: поверхностный гастрит. Семейный анамнез не отягощен.
МРТ головного мозга с контрастным усилением: эндосупраселлярно визуализируется образование с признаками замедленного накопления контрастного препарата размером 20 16,5×24 мм с признаками распространения за пределы турецкого седла, разрушением дна турецкого седла. Опухоль прилежит к хиазме зрительных нервов. Стебель гипофиза смещен вправо (рис. 1).
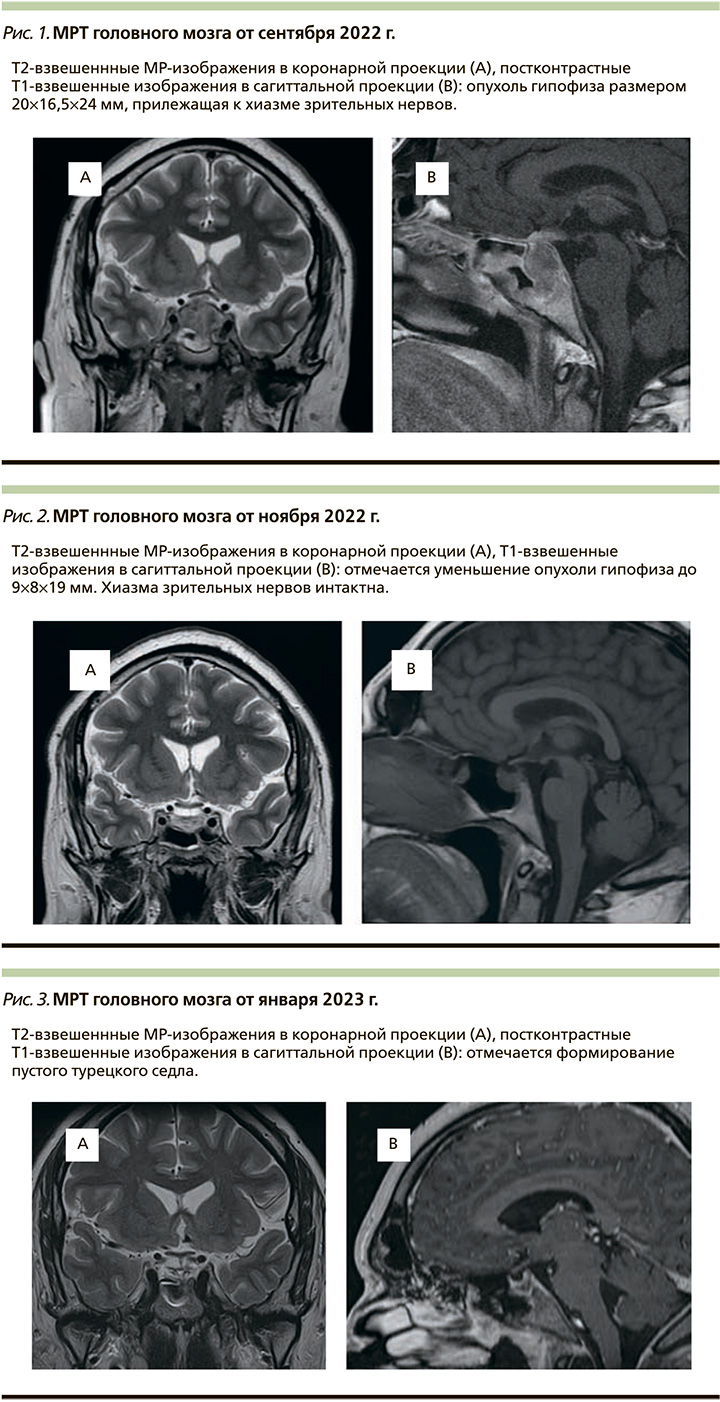
При осмотре офтальмологом не выявлено нарушений полей и остроты зрения.
В гормональном статусе гипопитуитарных нарушений не выявлено. Несахарного диабета не отмечалось.
Диагноз: гормонально-неактивная эндосупраселлярная небольшая опухоль гипофиза.
С учетом отсутствия зрительных, глазодвигательных и эндокринных расстройств пациенту предложено динамическое наблюдение.
При контрольной МРТ головного мозга с контрастным усилением от ноября 2022 г. выявлено уменьшение размера опухоли до 9×8×19 мм. Также отмечается отдаление опухоли от хиазмы зрительных нервов по сравнению с первичной МРТ от сентября 2022 г. (рис. 2).
С учетом положительной динамику в виде уменьшения размера опухоли продолжено динамическое наблюдение.
При МРТ-контроле от января 2023 г. выявлена практически полная резорбция опухоли (6×7 мм) с признаками пустого турецкого седла (рис. 3).
За весь период наблюдения у пациента не наблюдалось зрительных, глазодвигательных и гормональных нарушений. Стоит отметить, что пациент перенес коронавирусную инфекцию в период наблюдения, однако уже после начала уменьшения опухоли. Также за время наблюдения у пациента не отмечалось приступов резкой головной боли, что могло бы свидетельствовать о перенесенной апоплексии гипофиза.
Обсуждение
При микроаденомах гипофиза рост опухоли наблюдается крайне редко и вероятность ее роста, по-видимому, почти перевешивается вероятностью уменьшения размера опухоли [12–4]. Более того, при серии аутопсий более 99% всех обнаруженных АГ являются микроаденомами [15]. Эти два факта свидетельствуют о том, что прогрессирование от микроаденомы к макроаденоме – редкое событие [16, 17].
На сегодняшний день опубликовано несколько сообщений о регрессии гормонально-неактивной АГ (ГНАГ).
В 2018 г. Е. Anderson et al. сообщили о 71-летней женщине, проходившей лечение по поводу рака молочной железы и ГНАГ [18, 19]. Опухоль гипофиза протекала бессимптомно.
В то же время пациентка получала химиотерапию палбоциклибом в связи с опухолью молочной железы. Через год ГНАГ регрессировала с 13 до 8 мм, и авторы предположили, что ингибиторы CDK 4/6, к которым относится палбоциклиб, могут играть важную роль в лечении АГ.
В 2011 г. А. Bahar et al. сообщили о случае ГНАГ размером 18–15 мм, которая регрессировала через 3 месяца [20] Они предполагают, что вирусная инфекция в тот период могла сыграть свою роль.
D.G. Eichberg et al. (2018) представили обзор литературы, включивший в общей сложности 13 спонтанно регрессирующих ГНАГ [21]. В 12 из 13 случаев регрессия была связана с апоплексией гипофиза, у одного (А. Bahar et al.) – с вирусной инфекцией.
В мета-анализе О.М. Dekkers et al. спонтанная регрессия ГНАГ наблюдалась у 11% пациентов (34 из 304) [12]. Авторы предполагают, что по крайней мере в некоторых случаях это вызвано путем клинически незаметной ишемии опухоли. Это подтверждается наблюдением того, что в течение 5-летнего наблюдения за случайно обнаруженными макроаденомами симптоматическая апоплексия гипофиза развилась примерно в 10% случаев [22]. Кроме того, при дифференциальной диагностике следует учитывать лимфоцитарный гипофизит [23].
По данным D.G. Eichberg et al., вероятность кровоизлияния при АГ в 5,4 раза выше, чем при любой другой опухоли головного мозга [21, 24] Механизм, лежащий в основе апоплексии, до конца не изучен. Сам гипофиз обладает богатым сосудистым снабжением и питается крупными сосудами, такими как верхняя и нижняя гипофизарные артерии [25]. Предложено несколько теорий относительно патофизиологии апоплексии гипофиза. Частичным результатом может быть либо первичное кровоизлияние, либо геморрагический инфаркт опухоли. S. Epstein et al. предположили, что быстрый рост опухоли может опережать артериальное кровоснабжение, приводя к ишемии [26]. Во время апоплексического удара, по-видимому, это чаще встречается при макроаденомах, даже микроаденомы могут кровоточить, как было описано в одном из случаев А. Yoshino et al. [27].
В качестве альтернативы R.L. Rovit et al. утверждают, что растущая опухоль может сдавливать ножку гипофиза относительно диафрагмы турецкого седла, тем самым нарушая кровоток в ножке, имеющей хрупкую сосудистую сеть, что приводит к ишемии и геморрагическому инфаркту [28]. Рентгенологические или интраоперационные признаки кровоизлияния или инфаркта АГ выявляются в 0,6–25,7% случаев, хотя только у 0,6–9,1% этих пациентов наблюдаются острые неврологические и эндокринологические симптомы апоплексии гипофиза [24, 29, 30].
Заключение
Спонтанный регресс АГ считается редким, но потенциально возможным исходом. Одной из наиболее частых причин такого течения заболевания является апоплексия АГ. В связи с этим при планировании хирургического лечения АГ необходимо тщательно изучить всю предоперационную визуализацию, чтобы подтвердить, что опухоль не регрессировала самопроизвольно. В случае самостоятельного рассасывания АГ пациентам следует проводить динамический МР-контроль хиазмально-селлярной области для исключения рецидива опухоли.
Cогласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации.
Вклад авторов. Концепция и дизайн исследования – Н.И. Михайлов. Сбор и обработка материала – Н.И. Михайлов, О.Н. Кирсанова, С.А. Кисарьев. Написание текста – Н.И. Михайлов. Редактирование – А.М. Зайцев.



