Введение
Взаимодействие нервной и иммунной систем необходимо для обеспечения физиологической иммунорегуляции. Нервная система не вмешивается в специфическую составляющую иммунного ответа, но способна модулировать его интенсивность, кинетику и направленность. Биологически активные вещества, выделяющиеся при развитии иммунного ответа, могут влиять на тонус вегетативной и центральной нервной системы – ЦНС [1, 2, 5]. В связи с этим актуален поиск препаратов, обладающих как нейромодулирующей активностью, так и иммуномодулирующими свойствами, или поиск иммунотропных свойств у уже известных нейротропных препаратов [3].
На сегодняшний день известно много нейроактивных препаратов. Среди нейропротекторных средств особый интерес вызывает препарат Кортексин, который представляет собой лиофилизат из коры головного мозга крупного рогатого скота, содержащий низкомолекулярные активные нейропептиды. Кортексин обладает многофункциональным действием на головной мозг, оказывая нейропротективное, нейромодуляционное и нейротрофическое влияние. Препарат оптимизирует энергетический метаболизм клеток мозга, улучшает внутриклеточный синтез белка. Другим нейроактивным препаратом, схожим по влиянию на нервную систему, служит пирацетам (Ноотропил). Он оказывает полифункциональное влияние на ЦНС: улучшает процессы метаболизма нейронов, изменение скорости распространения возбуждения, улучшение микроциркуляции.
Целью исследования стали сравнительная оценка и анализ иммуномоделирующего действия Кортексина и пирацетама на фагоцитарные показатели, гуморальное и Т-клеточное звенья иммунной системы. Для этого было необходимо изучить влияние препаратов Кортексин и пирацетам на гуморальный и клеточный иммунные ответы, а также на фагоцитарную активность полиморфноядерных (нейтрофильных) гранулоцитов при курсовом (10-дневном) введении.
Материал и методы
Исследование выполнено на 310 мышах-самцах линии Balb/c массой 18–24 г, разделенных на группы по 10 особей в каждой, содержавшихся в стандартных условиях вивария. Все эксперименты проведены в соответствии с Приказом МЗ и СР РФ № 708н «Об утверждении правил лабораторной практики», от 23.08.2010, ГОСТ Р-53434-2009 «Принципы надлежащей лабораторной практики». Для проведения экспериментов были сформированы контрольные и опытные группы животных, находившихся в идентичных условиях содержания. Исследуемые препараты вводили в следующих дозировках: Кортексин растворяли в дистиллированной воде, вводили внутрибрюшинно по 1 мл раствора в концентрации 25 мкг/мл из расчета 1 мг/кг ежедневно в течение 10 дней; пирацетам – 25 мкл раствора в концентрации 200 мг/мл доводили дистиллированной водой до объема 1 мл и вводили внутрибрюшинно из расчета 200 мг/кг ежедневно в течение 10 дней.
Лабораторные животные были разделены на группы следующим образом: контрольная (интактная) группа 1.
Животные этой группы получали дистиллированную воду в объеме 1 мл внутрибрюшинно соответственно массе и не подвергались иммунизации антигеном – эритроцитами барана (ЭБ). Контрольная группа 2. Животные этой группы получали 1 мл дистиллированной воды внутрибрюшинно соответственно массе и подвергались иммунизации антигеном ЭБ. Опытная группа 3.
Указанная группа мышей получала раствор пирацетама. Для этого 25 мкл раствора концентрации 200 мг/мл доводили дистиллированной водой до объема 1 мл, вводили внутрибрюшинно из расчета 200 мг/кг ежедневно в течение 10 дней и иммунизировали антигеном ЭБ. Опытная группа 4. Указанная группа мышей получала раствор препарата Кортексин, который растворяли в дистиллированной воде и вводили внутрибрюшинно 1 мл раствора в концентрации 25 мкг/мл из расчета 1 мг/кг ежедневно в течение 10 дней и иммунизировали антигеном ЭБ. Значимость различий между группами оценивалась с использованием непараметрического критерия Манна–Уитни.
Оценку влияния исследуемых препаратов на гуморальный иммунный ответ изучали путем определения титра антител при иммунизации животных ЭБ в реакции пассивной гемагглютинации (РПГА). Иммунизацию мышей проводили однократно внутрибрюшинно в дозе 5×107 ЭБ в объеме 250 мкл физиологического раствора через час после введения препаратов Кортексин или пирацетам. Кровь для получения сыворотки брали через 7 дней (на 8-е сутки) после иммунизации животных ЭБ. Титр антител выражали в среднегеометрических показателях.
Влияние на Т-клеточный иммунный ответ изучали на модели реакции гиперчувствительности замедленного типа (РГЗТ). При постановке РГЗТ для сенсибилизации мышам однократно подкожно в межлопаточную область вводили 2×108 ЭБ в объеме 100 мкл физиологического раствора через час после введения препаратов Кортексин и пирацетам. Разрешающую дозу антигена 1×108 ЭБ в объеме 20 мкл физиологического раствора вводили на 5-й день после сенсибилизации под апоневротическую пластинку одной из задних конечностей («опытная» лапа). В контрлатеральную лапу в качестве контроля вводили физиологический раствор в эквивалентном объеме («контрольная» лапа). Учет интенсивности воспалительной реакции осуществлен через 24 часа после введения разрешающей дозы антигена путем подсчета индекса воспаления РГЗТ.
Для оценки влияния исследуемых препаратов на фагоцитарную активность нейтрофилов периферической крови использовали мышей через 24 часа после введения последней исследуемой дозы исследуемого препарата. Для этого животных выводили из эксперимента и забирали венозную кровь, после этого 50 мкл гепаринизированной крови смешивали с 50 мкл 1%-ной суспензии латекса в 96-луночном круглодонном планшете и инкубировали 2 часа при t +37°С, периодически встряхивая пробы. Далее делали гематологические мазки, фиксировали в фиксаторе Мая–Грюнвальда 2–3 минуты и окрашивали в краске Рома-новского 30–40 минут. Затем просмат-ривали под микроскопом с иммерсией (15×100). На основании полученных данных рассчитывали следующие показатели: ФП – фагоцитарный показатель, процент клеток, вступивших в фагоцитоз (процент активных нейтрофилов); ФЧ – фагоцитарное число, среднее число поглощенных частиц латекса активными нейтрофилами [4].
Результаты и обсуждение
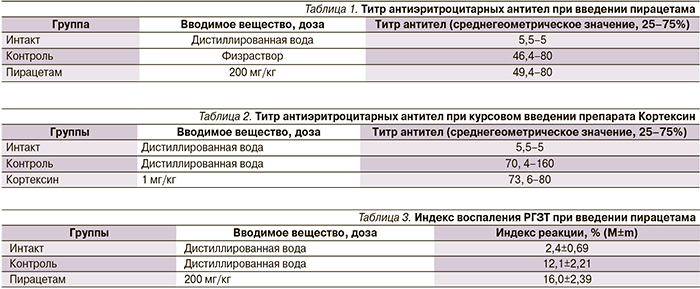
Результаты исследований показали, что пирацетам в исследуемых дозах не стимулирует выработку антиэритроцитарных антител. Так, введение вещества в дозе 200 мг/кг приводило к выработке антиэритроцитарных антител до среднегеометрического титра 1:49, тогда как в группе контроля титр составил 1:46 (табл. 1).
Изучение влияния курсового введения препарата Кортексин на гуморальный иммунитет показало, что через 7 суток после проведения внутрибрюшинной антигенной стимуляции мышей ЭБ титр гемагглютининов у животных, получавших в течение 10 дней Кортексин в дозе 1 мг/кг, составил 1:73. Иммунизация мышей контрольной группы сопровождалась увеличением титра антиэритроцитарных антител до уровня 1:70 (табл. 2). Полученные данные свидетельствуют об отсутствии влияния препарата в исследуемых дозах на гуморальный иммунитет.
Оценка результатов влияния препарата пирацетам на клеточный иммунный ответ показала незначительное стимулирующее влияние на уровень Т-клеточного иммунного ответа в дозе 200 мг/кг. Так, индекс воспаления в РГЗТ при введении в дозе 200 мг/кг составил 16,0% (в группе контроля – 12,1%) (табл. 3).

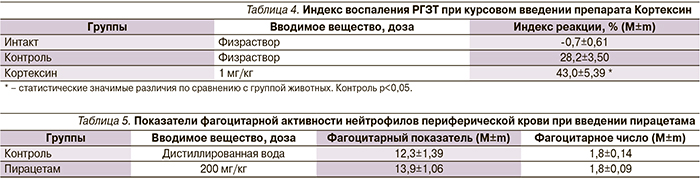
Введение разрешающей дозы антигена животным опытных групп после введения препарата Кортексин в дозе 1 мг/кг способствовало формированию РГЗТ высокого уровня: индекс воспаления составил 43,0%, что позволяет сделать вывод о стимулирующем влиянии препарата на клеточный иммунный ответ (табл. 4).
Изучение влияния введения пирацетама на показатели фагоцитарной активности нейтрофилов периферической крови показало, что препарат в исследуемых дозах не влияет на механизмы врожденного иммунного ответа. Так, введение вещества не приводило к увеличению числа активных нейтрофилов и не оказывало стимулирующего влияния на количество поглощенных ими частиц латекса (табл. 5).
Курсовое введение препарата Кортексин оказывало стимулирующий эффект на фагоцитарную активность полиморфноядерных лейкоцитов, наблюдали увеличение числа активно фагоцитирующих клеток и усиление процессов фагоцитоза каждым фагоцитом (табл. 6).
Заключение
Проведенные исследования позволяют сделать следующее заключение: препарат Кортексин обладает иммунотропным действием. Отмечено стимулирующее влияние этого препарата на Т-зависимый иммунный ответ и врожденный иммунный ответ. Слабое стимулирующее влияние на клеточный иммунитет было выявлено у препарата пирацетам.



