Введение
Атопический дерматит (АтД) представляет собой хроническое зудящее заболевание кожи с рецидивирующим течением, являющееся частью атопического синдрома [1]. За последнее десятилетие помимо роста заболеваемости АтД существенно изменился профиль больных, проявляющийся увеличением тяжелых форм дерматоза и торпидностью к проводимой стандартной терапии [2]. Кроме того, АтД, являясь начальным проявлением атопического синдрома, приводит к последовательному развитию таких IgE-зависимых заболеваний, как пищевая аллергия, аллергический ринит, аллергический конъюнктивит, БА. Несмотря на то что в основе этих заболеваний лежит поражение различных органов-мишеней, они имеют общие ключевые механизмы аллергического воспаления – являются коморбидными патологиями [3]. Наличие у пациента нескольких заболеваний со схожими патофизиологическими механизмами закономерно утяжеляет их течение, приводит к риску полипрагмазии и более частому развитию побочных эффектов от проводимой терапии [4]. Помимо высокой фармакологической нагрузки пациенты с АтД испытывают тяжелый психологический стресс, обусловленный хроническим зудом, нарушающим сон, активность, социализацию и психоэмоциональное здоровье ребенка [5, 6].
Следовательно, ведение высококоморбидного пациента, особенно педиатрического, требует поиска новых патогенетических подходов к терапии.
В патогенезе АтД можно выявить 3 ключевых момента: дисфункцию эпидермального барьера, приводящую к транскутанной сенсибилизации и трансэпидермальной потере воды; нарушение микробиома кожи, заключающееся в обеднении флоры и превалировании золотистого стафилококка, обладающего суперантигеном-повышающим общую сенсибилизацию, и иммунную дисрегуляцию. Иммунологический дисбаланс заключается в превалировании лимфоцитов Th 2-го типа (Th2), избыточной продукции интерлейкинов (ИЛ) ИЛ-4, -5, -13 и активации эозинофилов, базофилов и тучных клеток. Ключевую роль в развитии аллергического воспаления играет ось ИЛ-4/ИЛL-13/ ИЛ-4Rα, которая, способствуя дифференцировке Т-хелперных клеток Th2, опосредует проаллергический адаптивный иммунный ответ (рис. 1).
Также известно, что ИЛ-4 и -13 являются основными пруритогенами, обусловливающими непосредственное развитие хронического и острого зуда, а также сенсибилизирующими чувствительные нейроны к другим пруритогенам [8]. Они также активирует эффекторные пути в тканях-мишенях, включая легкие, кожу и кишечник, что приводит к возникновению специфических симптомов [9]. Следовательно, исходя из современных представлений о патогенезе, основной целью терапии является воздействие на ось ИЛ-4/ ИЛ-13/ИЛ-4Rα, прерывание аллергического воспаления. ослабление или устранение клинических проявлений болезни и профилактика осложнений.
Федеральные клинические рекомендации предусматривают комплексный подход к терапии АтД, заключающийся в сочетании наружных, системных и физиотерапевтических методов (табл. 1).

Используется персонифицированный подход, предусматривающий подбор терапии пациенту на основании возраста, степени тяжести кожного процесса, сопутствующей патологии и лекарственной переносимости (рис. 2) [10].
Значительным достижением в терапии тяжелых резистентных форм АтД, стало применение моноклональных антител (МАТ), блокирующих отдельные провоспалительные цитокины или иммунокомпетентные клетки, тем самым предотвращая развитие цитокинового каскада. В медицинской практике применяется три типа моноклональных антител [11]. Все их названия заканчиваются на «-mab» (англ.: мonoclonal antibodies), а для более легкого отличия источника их получения используются дополнительные буквы в окончаниях наименований лекарственных препаратов (табл. 2).


В отличие от традиционных моноклональные препараты воздействуют прицельно (таргетно) на определенную мишень – специфические антигены: обусловливают лучший эффект и меньшее число побочных эффектов. Считается, что терапию генно-инженерными биологическими препаратами (ГИБП) следует инициировать в случае отсутствия клинического эффекта и наступления ремиссии на фоне стандартной терапии через 3–6 месяцев применения.
Дупилумаб является первым ГИБП, примененным в терапии АтД средней и тяжелой степеней тяжести. В 2017 г. FDA (Food and Drug Administration) одобрило дупилумаб для лечeния взрослых пациeнтов с АтД, а в 2018 г. препарат начал применяться в качестве поддерживающей терапии среднетяжелой и тяжелой БА у подростков с 12 лет [12]. Позже дупилумаб стали применять в терапии АтД у детей с 12-летнего возраста в отсутствие эффекта от топической терапии [13]. В Российской Федерации дупилумаб впервые введен на рынок в 2019 г. для лeчeния тяжeлой БА, а с 2020 г. стал применяться при среднетяжeлом и тяжeлом АтД у детей [14].
Дупилумаб является гуманизированным моноклональным антителом класса IgG4, нацеленным на a-цепь рецептора ИЛ-4 (ИЛ-4Rα), общую для обоих комплексов ИЛ-4R: типа 1 (ИЛ-4Rα/γc; специфично для ИЛ-4) и типа 2 (Ил-4; 4Rα/ИЛ-13Rα1, ИЛ-4 и ИЛ-13 специфичны) [15].
Дупилумаб блокирует передачу сигналов ИЛ-4Rα, что приводит к нарушению передачи сигнала по пути JAK/ STAT и подавлению развития Th2воспаления при различных аллергических заболеваниях (рис. 3) [16]. Также в ряде исследований доказано, что дупилумаб тормозит выработку IgЕ в В-лимфоцитах.

Согласно инструкции по применению, дупилумаб показан к применению при АтД средней и тяжелой степеней тяжести у пациeнтов старше 6 лет при неэффективности стандартной терапии и непрерывно рецидивирующем течении, БА средней и тяжелой степеней тяжести у пациeнтов старше 12 лет и при хроническом полипозном риносинусите [18]. Наличие сочетаний двух и болeе аллергических заболеваний делает применение дупилумаба еще болeе оправданным, т.к. позволяет одной биологической молекулой воздействовать на единый патогенез и значительно уменьшать лекарственную и токсическую нагрузку на пациeнта [19]. В Российской Федерации дупилумаб относится к жизненно необходимым и важнейшим лекарственным препаратам, а также предоставляется безвозмездно для льготных категорий граждан [20].
Эффективность и безопасность дупилумаба мы изучили в группе детей в возрасте старше 6 лет, имеющих установленный диагноз АтД средней и тяжелой степеней тяжести, которые не имели адекватного ответа на ранее проводимую стандартную терапию. Все пациенты из изученной когорты на основании шкалы степени тяжести АтД EASI (Eczema Area and Severity Index) имели тяжелые формы дерматоза, не поддающиеся терапии стандартными методами, сочетавшиеся с одним и более коморбидными аллергическими заболеваниями (рис. 4).

В первой группе пациентов кожный процесс имел островоспалительный распространенный характер с преобладанием умеренно выраженной отечной эритемы, папулезными и папуло-сквамозными высыпаниями, экскориациями и ксерозом. Во второй группе пациентов кожный процесс носил диффузный характер, сопровождался сливной папулезной сыпью, обширными участками лихенификации, множественными экскориациями, геморрагическими корками, частым вторичным инфицированием. В третьей группе пациентов кожный процесс зачастую принимал универсальный характер с крайней степенью выраженности всех симптомов. У большинства пациентов выявлялись специфические стигматы АтД в виде гиперпигментации и шелушения кожи век, дополнительной кожной складки под нижним веком (складка Денье– Моргана), поперечной складки на спинке носа, поражения красной каймы губ (атопический хейлит). Субъективно у всех пациентов отмечались хронический кожный зуд различной степени выраженности – от умеренной до максимальной (биопсирующий зуд), нарушение сна и повседневной активности.
Дупилумаб назначали в соответствии с инструкцией по применению детям в возрасте от 6 лет и старше в виде подкожных инъекций каждые 2 недели по 200 мг, если исходная масса тела была менее 60 кг, или 300 мг, если исходная масса тела была равна или превышала 60 кг (табл. 3).

После первой инъекции дупилумаба показатель EASI снизился на 6–9, а после второй – на 34–41% (рис. 5).
У всех пациентов отмечено уменьшение выраженности эритемы, инфильтрации и отека, эпителизация экскориаций и эрозий (рис. 6). Также все пациенты отметили уменьшение интенсивности кожного зуда и нормализацию сна.
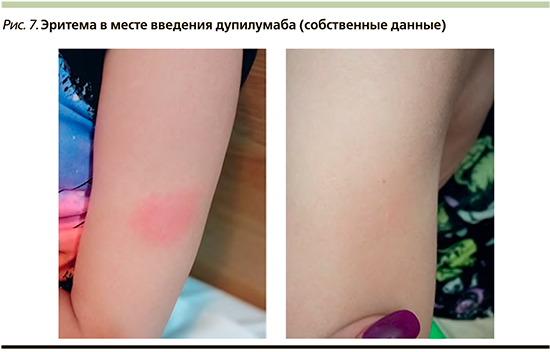
Помимо положительной динамики кожного процесса большинство пациентов отметили облегчение течения коморбидных заболеваний – уменьшение выраженности назальной обструкции, частоты приступов бронхиальной обструкции/кашля и снижение потребности в применении бронходилататоров. При оценке побочных эффектов только у одного ребенка отмечена эритема в месте введения, которая разрешилась самостоятельно в течение 72 часов (рис. 7).
Ни у одного из пациентов, получавших дупилумаб, не было зарегистрировано серьезных побочных эффектов.
Заключение
Дупилумаб является первым ГИБП, который эффективно воздействует на патогенез многих аллергических заболеваний, блокируя дифференцировку Th2-лимфоцитов, продукцию IgE В-клетками, альтернативную активацию макрофагов и другие признаки аллергических воспалительных заболеваний. С учетом воздействия дупилумаба на ключевые ИЛ-4, ИЛ-13 и подавления аллергического воспаления возникла возможность с помощью одной молекулы решить проблему лечения сразу нескольких аллергических заболеваний. В настоящее время применение дупилумаба одобрено FDA для лечения АтД, БА средней и тяжелой степеней. Также препарат показал многообещающие результаты в лечении хронического полипозного риносинусита и эозинофильного эзофагита. Применение дупилумаба позволяет модифицировать болезнь и снижать риск развития «атопического марша». Препарат сочетает высокую терапевтическую эффективность с низкой частотой побочных эффектов, что значительно расширяет возможности врача и улучшает прогноз заболевания у пациента.
Финансирование. Отсутствует.



