Введение
Примерно у 2–11% больных раком почки (РП) метастатическое поражение головного мозга выявляется или при установлении первичного диагноза опухолевого заболевания, или в процессе лечения [27, 33]. Больные с метастазами в головном мозге имеют плохой прогноз, медиана выживаемости в этой группе пациентов не превышает 4–7 месяцев [34]. Большинство из этих пациентов имеет плохой соматический статус вследствие диссеминированного опухолевого процесса [43]. В предыдущие годы лечение этих больных ограничивалось только симптоматической терапией [10, 44]. Однако в последнее время произошел прогресс в области лекарственного лечения злокачественных опухолей, в т.ч. РП, благодаря внедрению в клиническую практику ингибиторов VEGF и mTOR [22].
Системная терапия при лечении больных солидными опухолями с метастазами в головном мозге играет определенную роль, как правило, после локального лечения опухолевого поражения головного мозга, включающего хирургическое лечение и лучевую терапию. В отдельных случаях химиотерапия позволяет достигать объективных ответов в головном мозге, подтвержденных данными магнитно-резонансной томографии или компьютерной томографии, а также улучшает соматическое состояние пациентов в случае рецидива/прогрессирования болезни после локального лечения [1]. Как правило, пациенты с метастатическим поражением головного мозга исключаются из клинических исследований по лекарственному лечению опухолей.
Большинство больных РП с метастатическим поражением головного мозга умирают из-за прогрессирования болезни в экстракраниальных очагах (метастазы в других органах), и только небольшая часть больных умирают из-за прогрессирования опухолевого процесса непосредственно в головном мозге и связанных с этим осложнений [43]. Системная терапия играет более значимую роль в лечении пацентов с метастатическим поражением головного мозга. При этом больные диссеминированным РП имеют прогностические параметры, влияющие на выживаемость при проведении лечения. В соответствии с этими параметрами пациенты делятся на различные группы в зависимости от прогноза выживаемости: благоприятный, неблагоприятный и промежуточный [4, 37]. Одним из важнейших параметров является функциональное состояние пациентов, улучшение которого во время проведения лекарственной терапии позволяет увеличивать продолжительность жизни больных и повышать качество жизни. У больных диссеминированным РП не выявлено биомаркеров с доказанным прогностическим значением в отношении лекарственной терапии.
Современная лекарственная терапия диссеминированного РП включает цитокины (интерлейкин-2 и интерферон-альфа) у больных с благоприятным прогнозом (единичные метастазы только в легких), тирозинкиназные ингибиторы рецептора VEGF (сунитиниб, сорафениб, пазопаниб, акситиниб), антитела к VEGF (бевацизумаб), а также ингибиторы mTOR (темсиролимус, эверолимус) [9, 13, 17, 19, 26, 31, 39]. Ранее были опубликованы отдельные клинические наблюдения о регрессе метастазов в головном мозге на фоне иммунотерапии и таргетной терапии [12, 31, 41, 42].
У большинства противоопухолевых лекарственных препаратов ограничена способность проникать через гематоэнцефалический барьер в связи с их низкой липофильностью и/или высокой молекулярной массой. В табл. 1 представлены данные о молекулярной массе и липофильности лекарственных препаратов, применяемых в лечении диссеминированного РП.
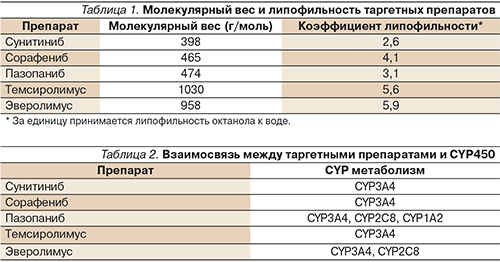
Необходимо также учитывать роль транспортной эффлюкс-системы (Р-гликопротеин и др.), способной уменьшать концентрацию препаратов в центральной нервной системе [15, 21, 29]. У 10% больных с метастазами в головном мозге судорожные приступы являются первым клиническим проявлением опухолевого поражения головного мозга [4]. Большинство пациентов с метастатическим поражением головного мозга нуждаются в противоэпилептической терапии. Многие противоэпилептические препараты способны ингибировать или индуцировать систему цитохрома Р450 (CYP450). Это также опосредованно (через CYР450) влияет на концентрацию противоопухолевых лекарственных препаратов в центральной нервной системе [23, 36]. Взаимосвязь между CYP450 и таргетными препаратами представлена в табл. 2.
Таргетные препараты
Сунитиниб обладает как антипролиферативным, так и антиангиогенным эффектами и зарегистрирован в качестве первой линии лечения метастатического светлоклеточного РП.
К сожалению, нет данных о концетрации сунитиниба в спинномозговой жидкости у людей. Ранее были опубликованы отдельные клинические наблюдения о регрессе метастазов в головном мозге на фоне лечения сунитинибом. Исследования на животных показали, что концентрация сунитиниба в спинномозговой жидкости составляет 31% от его концентрации в плазме крови, что указывает на высокую проницаемость гематоэнцефалического барьера для сунитиниба, тогда как у других ингибиторов тирозинкиназ концентрация в спинномозговой жидкости колеблется от 1 до 10%.
Сунитиниб изучался в ряде исследований больных диссеминированным почечноклеточным раком с метастазами в головном мозге [5, 11, 14, 25, 40, 46]. В исследование расширенного доступа сунитиниба был включен 321 пациент с метастазами в головном мозге. У 92% больных был светлоклеточный РП, у 98% – метастазы в других органах. Предшествующее лечение включало нефрэктомию (88%) и системную терапию антиангиогенными препаратами (12%) и/или цитокинами (74%). Схема лечения была следующей: сунитиниб – 50 мг/сут внутрь 1–28-й дни, интервал между курсами – 2 недели. У ¼ больных доза сунитиниба была снижена в процессе лечения. Сунитиниб как антиангио-генный препарат может повышать риск геморрагических осложнений интракраниально.
Однако в группе больных РП с метастазами в головном мозге на фоне лечения сунитинибом был отмечен только один случай кровоизлияния в головном мозге (1–2-й степеней) [11]. Эффективность лечения была оценена у 213 (66%) больных. Одним (0,5%) пациентом был достигнут полный регресс в головном мозге, 25 (12%) больными – частичный регресс и у 111 (52%) больных отмечена стабилизация болезни продолжительностью 3 месяца и более. Медиана выживаемости без прогрессирования и медиана общей выживаемости составили 5,6 и 9,2 месяца соответственно, что превосходит результаты предшествовавших исследований, в которых изучалась эффективность иммунотерапии (интерферон-альфа, интерлейкин-2), где медиана выживаемости больных РП с метастазами в головном мозге не превышала 4–6 месяцев. В то же время было показано, что у больных диссеминированным РП без метастазов в головном мозге, получавших лечение сунитинибом, медиана выживаемости без прогрессирования составила 10,9 месяца, а медиана общей выживаемости – 18,4, что намного выше, чем у больных с метастатическим поражением головного мозга [11].
В другом исследовании сунитиниб назначался больным в качестве второй линии таргетной терапии после прогрессирования болезни на фоне лечения сорафенибом или бевацизумабом. Всего в исследование был включен 71 пациент с диссеминированным РП. При ретроспективном анализе было отмечено, что метастазы в головном мозге были у 6 (8%) пациентов, получавших лечение сунитинибом [6]. Частичный регресс в головном мозге был достигнут в 1 (16,7%) случае, в 5 (83,3%) была отмечена стабилизация болезни или прогрессирование. Медиана времени до прогрессирования составила 3,6 месяца, медиана общей выживаемости больных РП с метастазами в головном мозге составила 12,5 месяца.

Результаты этого небольшого исследования позволяют с оптимизмом смотреть на возможность дальнейшего лечения в ситуациях, когда отмечается прогрессирование болезни в виде метастатического поражения головного мозга на фоне предшествующей терапии таргетными препаратами.
Анализ данных различных исследований с целью оценки значения сунитиниба в снижении риска появления метастазов в головном мозге показывает одинаковую частоту метастатического поражения головного мозга у больных РП, получавших лечение сунитинибом, по сравнению с группой исторического контроля [14]. Однако в этой области нет проспективных исследований.
Сорафениб – это другой мультитаргетный тирозинкиназный ингибитор, обладающий как антипролиферативным, так и антиангиогенным действиями. Сорафениб был первым тирозинкиназным ингибитором, внедренным в клиническую практику лечения больных диссеминированным РП. Он показал свою эффективность после как иммунотерапии, так и терапии другими тирозинкиназными ингибиторами [8]. Нет точных данных о концентрации сорафениба в спинномозговой жидкости у людей [18]. В одно из исследований по сорафенибу были включены 70 больных диссеминированным РП с метастазами в головном мозге.
У 99% были метастазы в других органах. Предшествовавшее лечение включало нефрэктомию (79%), лучевую терапию (81%) и системную терапию (49%) антиангиогенными препаратами (бевацизумаб, талидомид) и/или цитокинами. Не было отмечено случаев интракраниальных геморрагических осложнений. Эффективность сорафениба была оценена у 50 (71%) больных. Двумя (4%) пациентами был достигнут частичный регресс в головном мозге. У большинства (68%) пациентов была отмечена стабилизация болезни продолжительностью 8 недель и более [38].
В другом исследовании, где группа больных диссеминированным РП, получавших лечение сорафенибом (70 пациентов), сравнивалась с группой пациентов, получавших плацебо (69 пациентов), было показано снижение частоты метастатического поражения головного мозга у больных в группе с сорафенибом [24]. Так, в группе сорафениба метастатическое поражение головного мозга в течение первых двух лет от начала лечения было выявлено у 2 (2,8%) пациентов, а в группе с плацебо – у 8 (11,6%).
При анализе литературных данных по другим лекарственным препаратам, зарегистрированным для лечения больных диссеминированным РП, не было выявлено данных больших клинических исследований по изучению лекарственной эффективности при метастатическом поражении головного мозга. Описаны отдельные клинические случаи по применению бевацизумаба, темсиролимуса у пациентов с метастазами в головном мозге [2, 3, 7, 16, 20, 28, 32 43]. В табл. 3 представлены суммарные данные по эффективности лекарственных препаратов в лечении больных РП с метастатическим поражением головного мозга.
Результаты собственных исследований
В нейрохирургическом (онкологическом) отделении РОНЦ им. Н.Н. Блохина РАМН лечение таргетными препаратами было проведено 22 больным диссеминированным РП с метастазами в головном мозге. Десяти больным проведено лечение сунитинибом, 8 – сорафенибом и 4 больных проходили терапию пазопанибом. Нефрэктомия ранее была выполнена 8 пациентам из 10 в группе сунитиниба, всем больным в группе сорафениба и 3 больным из 4, получавшим лечение пазопанибом.
В группе сунитиниба 4 пациента ранее получали цитокины и 3 больных ранее получали лечение таргетными препаратами. В группе сорафениба 5 пациентов получали ранее цитокины и 1 больной – лечение препаратом сунитиниб. Двое пациентов, получивших лечение пазопанибом, ранее получали лечение цитокинами.
Эффект оценен в отношении 22 больных, получивших лечение ингибиторами тирозинкиназ (сунитиниб, сорафениб, пазопаниб). Достигнуто 6 (27,3%) частичных регрессов в головном мозге (во всех случаях таргетная терапия сочеталась со стереотаксической радиохирургией на область очагов в головном мозге) и 12 (54,5%) стабилизаций в головном мозге (в 4 случаях таргетная терапия сочеталась со стереотаксической радиохирургией на область очагов в головном мозге). Эффект лечения метастазов в других органах оценен в отношении 20 больных из 22. Достигнуто 4 частичных регресса (20%), 10 стабилизаций (50%) длительностью 3 меяца и более. У всех больных контроль роста опухоли в других органах сочетался с контролем опухолевого процесса в головном мозге. Частичные регрессы в головном мозге достигнуты только в группе больных, получавших стереотаксическую радиохирургию в сочетании с таргетной терапией. Медиана выживаемости без прогрессирования составила 6 месяцев, медиана общей выживаемости – 10,5 месяцев. Один год и более прожили 8 (36,3%) больных.
Таким образом, таргетная терапия позволяет в большинстве случаев добиваться контроля опухолевого процесса у больных диссеминированным РП с метастазами в головном мозге. При этом эффективность терапии выше при сочетании с локальными методами лечения метастазов в головном мозге (хирургия и стереотаксическая радиохирургия).
Заключение
Частота метастатического поражения головного мозга у больных РП постоянно растет и является одной из важных причин неудач в лечении этих пациентов. Хирургическое лечение и лучевая терапия, в т.ч. радиохирургическое лечение, должны рассматриваться как оптимальный метод лечения больных РП с метастазами в головном мозге. Системная лекарственная терапия играет в последние годы более значимую роль в лечении пациентов с прогрессированием опухолевого процесса в головном мозге. При этом отсутствуют точные фармакокинетические данные о лекарственных препаратах, зарегистрированных для лечения диссеминированного РП, в отношении их концентрации в центральной нервной системе при применении в терапевтических дозах. Исходя из данных литературного обзора и результатов собственных исследований, можно сделать следующее заключение: пока еще ни один из таргетных препаратов не продемонстрировал достоверного преимущества перед другими в лечении больных РП с метастазами в головном мозге. Все препараты показали способность достигать клинического и рентгенологически подтвержденного объективного эффекта, в большинстве случаев в виде стабилизаций. Наибольшие данные по эффективности лечения имеются по препаратам сунитиниб и сорафениб.
В случае прогрессирования опухолевого процесса в головном мозге лекарственное лечение должно обсуждаться в каждой ситуации индивидуально в соответствии со стандартными подходами к лечению больных диссемини-рованным РП.



