Введение
Онкология в настоящее время является одним из наиболее быстро развивающихся направлений клинической медицины. Успехи прослеживаются во всех отраслях этой весьма широкой специальности. Однако наибольший темп развития сейчас имеет противоопухолевая лекарственная терапия. Ежегодно в клиническую практику выходит несколько новых препаратов, что не наблюдается ни в одной другой медицинской специальности. Успехи фармакологии отражаются на клинической практике. Увеличивается продолжительность жизни пациентов даже на поздних стадиях онкологического процесса, в отдельных клинических ситуациях появилась возможность высокоэффективной медикаментозной терапии, позволяющей достигать ремиссии, длящейся десятилетиями.
Однако любая лекарственная терапия наряду с показаниями имеет противопоказания, которые во многих случаях предпочтительно рассматривать как лимитирующие факторы. Если противопоказание – категория четкая и вполне однозначная, то лимитирующий фактор – категория более лабильная, подразумевающую разную степень выраженности и возможность коррекции. Классическим примером таких факторов служат сопутствующие заболевания. Их выраженность нередко оказывает существенное влияние как на лечебную тактику, так и на прогноз.
Рассматривать сочетания опухолей и «общетерапевтических» нозологий, пусть даже самых распространенных, вряд ли целесообразно по причине огромного числа возможных вариантов, из которых далеко не все актуальны для реальной клинической практики. Следовательно, нужна систематизация. С точки зрения клинической фармакологии наибольший интерес представляют заболевания, влияющие на фармакокинетику или фармакодинамику лекарственных средств. Как правило, именно в связи с такими сопутствующими заболеваниями требуется коррекция медикаментозной терапии: количественная (пересчет дозы препарата), а нередко и качественная (отказ от базовых препаратов в пользу альтернативных, более эффективных и/или безопасных в конкретной клинической ситуации).
Одним из таких лимитирующих состояний в современной противоопухолевой терапии признана почечная недостаточность (ПН). Раньше наличие у пациента ПН любого генеза практически исключало проведение патогенетической противоопухолевой терапии вследствие ее высокой токсичности, в т.ч. и нефротоксичности. Закономерные попытки достичь приемлемого уровня безопасности посредством снижения дозы своей обратной стороной имели существенное снижение эффективности ввиду затрудненности, а иногда и полной невозможности достижения терапевтической концентрации препарата в месте его действия. Как следствие – наблюдалось снижение эффективности, иногда вполне умеренное, а чаще выраженное, ставящее под сомнение целесо-образность дальнейшего лечения из-за неприемлемого соотношения ожидаемых выгод и рисков [1, 2].
Совершенствование многочисленных фармакологических групп противоопухолевых лекарственных средств идет, в т.ч. и по пути улучшения профиля безопасности. Таким образом, появилась потенциальная возможность расширить показания для медикаментозной терапии за счет пациентов, имеющих сопутствующие заболевания, приведшие к стойкому снижению фильтрационной функции почек, что в настоящее время носит название «хроническая болезнь почек» (ХБП). Встречается она среди пациентов онкологического профиля относительно часто, однако данный вопрос в научной литературе освещен слабо.
В частности, по оценке Y. Nakamura et al., частота встречаемости клинически значимой ХБП у пациентов онкологического профиля составляет 25% [3]. D. Canter et al. предоставляют сходную цифру – 22% [4]. При опухолях молочной железы частота ХБП II–V стадий (скорость клубочковой фильтрации [СКФ] <90 мл/мин) превышает 50% [5]. Также имеется мнение, что ХБП вне зависимости от этиологии и выраженности выступает в качестве самостоятельного и независимого фактора риска развития злокачественного новообразования (ЗНО) [6]. Столь высокая частота встречаемости ХБП на фоне ЗНО сама по себе делает проблему актуальной и вынуждает обратить внимание на этих пациентов.
Несмотря на присутствующее в названии слово «болезнь», ХБП – это не нозология и не синдром (в отличие от более раннего понятия «хроническая почечная недостаточность»). Научное общество нефрологов России (2021) расценивает ХБП как «персистирующее в течение 3 и более месяцев поражение органа вследствие действия различных этиологических факторов, анатомической основой которого является процесс замещения нормальных анатомических структур фиброзом, приводящий к его дисфункции» [7]. Отсюда поднимается вопрос о нозологиях, наиболее часто выступающих в качестве причины ХБП у пациентов онкологического профиля.
Другой вопрос – о частоте выявления ХБП относительно онкологической нозологии (условно не имеющей причинно-следственной связи с нарушением почечной функции), в научной литературе представлен весьма однобоко. В частности, в публикациях указывается на высокую (более 50%) частоту выявления дефицита фильтрационной функции у пациентов с ЗНО почек [8].
Таким образом, информация о частоте встречаемости, причинах и выраженности ХБП у пациентов, нуждающихся в лекарственной противоопухолевой терапии, в научной литературе представлена фрагментарно. Однако эти сведения имеют существенное значение как для практической онкологии, так и для продолжения научных исследований, т.к. они позволят выделить из всего многообразия таких больных категории пациентов, требующих особо тщательного изучения.
Также интерес представляет распределение ХБП по стадиям у пациентов с ЗНО разной локализации и гистологической структуры. В литературных источниках такого распределения найти не удалось. Однако исследователи нередко под ХБП подразумевают лишь клинически значимые стадии (III–V), налагающие ограничения на выбор медикаментозной терапии и дозировки лекарственных средств, чему и посвящена существенная доля публикаций по данному вопросу [9–14].
Методы
Проведен ретроспективный анализ медицинской документации 1500 пациентов, наблюдающихся в отделениях противоопухолевой химиотерапии ГБУЗ «Городская клиническая больница им. Д.Д. Плетнева» (ГБУЗ ГКБ им. Д.Д. Плетнева, онкологический стационар и центр оказания онкологической помощи которой в 2023 г. передан в подчинение Московскому клиническому научному центру им. А.С. Логинова) в 2021 гг. ХБП II–V стадий наблюдалась у 495 участников исследования. В исследование были включены все пациенты, имевшие верифицированный диагноз ЗНО вне зависимости от локализации, стадии и гистологической структуры, а также сопутствовавших заболеваний, обратившиеся за онкологической помощью в ГБУЗ ГКБ им. Д.Д. Плетнева. Критериев исключения не было.
Пациенты разделялись на группы, согласно онкологическому диагнозу, факту проведения патогенетической противоопухолевой терапии, выраженности дефицита фильтрационной функции почек, предполагаемой причине ПН.
Фильтрационная функция почек оценивалась у всех пациентов на этапе первичного приема посредством определения СКФ по номограммам CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration Formula) или формуле Кокрофта–Голта.
Результаты
Среди пациентов с ЗНО различной локализации и стадии, обратившихся в 2021 г. за специализированной онкологической помощью в Онкологический диспансер, снижение фильтрационной функции почек наблюдалось у 495 больных, что составило 33% от общего числа пациентов онкологического профиля (рис. 1). У 1005 (67% пациентов онкологических отделений ГБУЗ ГКБ им. Д.Д. Плетнева, проходивших лечение в 2021 г.) больных не отмечалось клинически значимого поражения почек или имелись стойкие изменения, соответствовавшие критериям ХБП I стадии. Терминальная ПН (ХБП V стадии) отмечена у 18 пациентов, что составило 1,8% от общего числа обратившихся в 2021 г. Таким образом, больных ЗНО на фоне консервативно курабельной ХБП оказалось 477 человек (31,2% от общей выборки).
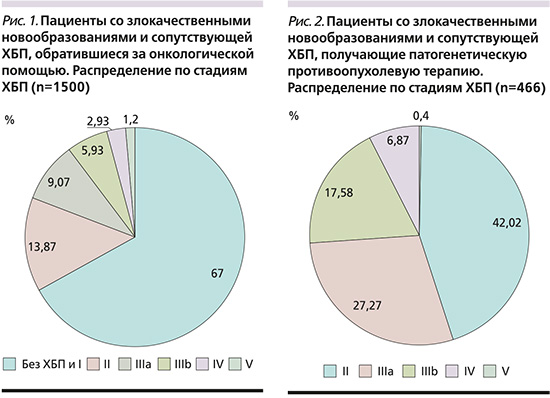
Не все пациенты, проходящие лечение у онколога, получают патогенетическую противоопухолевую терапию. Некоторые из них по разным причинам могут получать лишь симптоматическое лечение. Среди пациентов с сопутствовавшей ХБП (495 человек) таковых оказалось 29 человек – 6% от общего числа пациентов со снижением фильтрационной функции почек (ХБП II–V стадий).
Из 466 пациентов с дефицитом фильтрации, получавших противоопухолевую терапию, II стадию ХБП имели 208 (44,64%) человек, IIIa-стадию – 135 (28,97%), IIIb-стадию – 87 (18,67%), IV стадию – 34 (7,3%), V стадию (терминальную) – 2 (0,43%) пациента (рис. 2).
Определенный интерес представляет аналогичное распределение пациентов с ХБП, которым по каким-либо причинам отказано в проведении патогенетической противоопухолевой терапии. Объем выборки был существенно меньше – всего 29 человек (рис. 3). Из них более половины (16/55,17%) имели V стадию ХБП (терминальную), треть (10/34,48%) – IV стадию. Менее выраженный дефицит фильтрации (СКФ>30 мл/мин) отмечался лишь у единичных больных, которым патогенетическая противоопухолевая терапия оказалась невозможной (суммарно 3/10,35%).
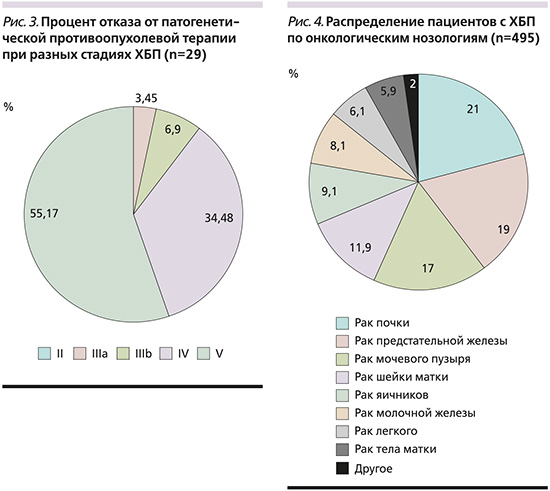
Среди онкологических нозологий наиболее часто ПН наблюдалась у пациентов с ЗНО почки (105/21,21%), предстательной железы (93/18,79%), мочевого пузыря (84/16,97%), шейки матки (59/11,92%), яичников (45/9,09%), молочной железы (41/8,28%), легкого (31/6,26%), тела матки (27/5,45%). Суммарно на пациентов, имевших опухоли вышеуказанных локализаций, пришлось 98% больных онкологического профиля с сопутствовавшей ПН (рис. 4).
Для выработки тактики онкологической помощи принципиальное значение имеет ответ на ключевой вопрос об обратимости снижения почечной функции. Вполне очевидно, что у подавляющего большинства тяжелых больных онкологического профиля ПН носит смешанный характер. Тем не менее главный компонент выделить можно. Именно он и будет определять обратимость, следовательно, и дальнейшую тактику.
Причин для ХБП у пациентов изучаемого профиля много. Однако, следуя путем постепенного упрощения и формализации, можно прийти к 4 основным причинам, из которых 2 потенциально обратимы, а 2 – малообратимы. Бесспорно, обратимой можно считать ПН вследствие хронического нарушения уродинамики. Пациентов с преобладанием этого механизма оказалось 75 (16,09%) человек из 466, получавших противоопухолевую терапию. ХБП, связанная преимущественно с лекарственной терапией, в т.ч. и противоопухолевой, выявлена у 107 (22,96%) больных. Это также вполне обратимое состояние.Малообратимая фоновая почечная патология (нефрангиосклероз, хронический пиелонефрит и т.д.), не имеющая явной патогенетической связи с опухолевым процессом, определяющее значение имела у 252 (54,08%) пациентов (рис. 5). ХБП вследствие тяжелой опухолевой интоксикации на фоне генерализации процесса отмечена у 32 (6,87%) больных.
Обсуждение
Среди пациентов, обратившихся за онкологической помощью, пациентов с сопутствовавшей ХБП оказалось на удивление много – суммарно треть (33%) от общего их числа. Такое их число само по себе делает изучаемую проблему актуальной и достойной внимания.
Оставшиеся 2/3 (67%) больных не имели клинически значимого снижения фильтрационной функции почек. Однако это не означает, что у всех из них почки полностью интактны. Мы намеренно объединили пациентов с условно здоровыми почками и имеющих ХБП I стадии: у них клубочковая фильтрация относительно сохранна, что позволяет не вносить коррекцию в стандартную противоопухолевую терапию.
Однако, несмотря на все ограничения, ту или иную противоопухолевую терапию получили 94% от общего числа пациентов с сопутствовавшей ХБП. Этот процент запредельно большой, вызывающий сомнения, что побуждает к дальнейшему анализу.
Распределение пациентов по стадиям ХБП большого удивления не вызывало. Почти 3/4 (73,61%) пациентов, получавших противоопухолевую терапию, имели в целом невыраженную ХБП – II и IIIa-стадий. СКФ при этом составляла >45 мл/мин, что подразумевает полностью компенсированную ПН, отсутствие ее клинических проявлений. Ограничения в медикаментозной терапии состоят в необходимости коррекции доз. Полностью противопоказанных противоопухолевых средств при таком дефиците фильтрации нет. С другой стороны, большинство (89,65%) пациентов с ПН, которым была назначена лишь симптоматическая терапия, закономерно страдали терминальной или субтерминальной стадией ХБП.
Каждый пятый (21,21%) пациент с ХБП имел опухоль почки, что на первый взгляд кажется логичным. Однако если контралатеральная почка интактна, то ПН быть не должно даже при полном отсутствии функции пораженного органа. По всей видимости, здесь имеет место опухолевая токсичность на фоне распространенного процесса (в отсутствие такового медикаментозной терапии опухоли почки обычно не требуется, следовательно, эти пациенты выпадают из поля зрения химиотерапевта).
Обращает на себя внимание обилие онкологических нозологий, для которых характерно нарушение уродинамики. Это ЗНО предстательной железы, мочевого пузыря, матки и яичников. На их долю приходится 62,31% от общего числа пациентов с ПН. Из этого следует существенный вклад уродинамического, постренального компонентов в структуру ПН у пациентов онкологического профиля.
Самым дискутабельным, без сомнения, является распределение по причинам ПН. Очевидный, лежащий на поверхности его недостаток – отсутствие разделения между ХБП и острым почечным повреждением (ОПП). De jure грань между ними лежит на 3 месяцах непрерывного персистирования симптомов почечного повреждения. Однако de facto онкологу-химиотерапевту безразлично, повышен у пациента уровень креатинина на протяжении 1 месяца или полугода. На выбор препарата и его дозировку в любом случае налагаются серьезные ограничения и от длительности ПН они зависят слабо.
Другой сомнительный момент – невозможность оценки фильтрационной функции почек посредством формул и номограмм при ОПП. В основе этого запрета лежит основное требование всех без исключения методик определения СКФ – концентрация креатинина должна быть равновесной, т.е. стабильной, неизменной на протяжении продолжительного времени. В условиях роста уровня креатинина результат получается завышенным.
И это завышение тем грубее, чем быстрее происходит рост уровня креатинина. Считается, что при нулевой фильтрации уровень креатинина удваивается за сутки. Соответственно, при падении уровня креатинина при разрешении ПН происходит обратное явление – СКФ занижается.
Однако здесь обсуждаются исключительно пациенты амбулаторного профиля, у которых быстрый рост уровня креатинина, тем более на фоне снижения диуреза, маловероятен, в противном случае потребуется госпитализация. Кроме того, химиотерапия пациентам с подобной отрицательной динамикой противопоказана. Потому, если и имеется рост уровня креатинина, то медленный, а завышение СКФ вряд ли значимо.
На наш взгляд, основная ценность распределения ХБП по причинам, ее вызвавшим, пусть весьма приближенно, состоит в оценке числа пациентов, для которых актуальна проблема противоопухолевой химиотерапии на фоне хронического дефицита фильтрации. Пациенты с нарушениями уродинамики, с постренальным ОПП в целом малоинтересны. После дренирования мочевых путей фильтрационная функция почек у них восстанавливается полностью или в значительной мере и почти все они становятся пригодными к противоопухолевой терапии на общих основаниях. С медикаментозно-индуцированной ОПП ситуация в целом схожая.
Больные, у которых в основе патогенеза ПН лежит опухолевая токсичность, наоборот, имеют столь распространенный процесс и настолько тяжелы по своему общесоматическому статусу, что в большинстве своем могут переносить только симптоматическую терапию. Вполне очевидно, что такая ПН необратима.
Таким образом, внимания требуют примерно половина (54,08%) пациентов, у которых имеется фоновая нозология, приведшая к снижению фильтрационной функции почек. Среди больных онкоурологического профиля – это хронически рецидивирующий пиелонефрит. При опухолях другой локализации чаще наблюдается нефрангиосклероз на фоне длительного течения гипертонической болезни и/или ишемической болезни сердца.
Тогда все становится на свои места. Пациенты с опухолями (разумеется, потенциально курабельные) и истинной ХБП составляют 16,8% (252 пациента из 1500 человек общей выборки), примерно каждый шестой. Как бы то ни было, это очень высокий показатель. В своей массе они имеют незначительно повышенный уровень креатинина (ХБП II–III стадий) вследствие нефроангиосклероза или хронического пиелонефрита.
Это не является поводом для отказа от противоопухолевой терапии, но вынуждает из соображений безопасности назначать редуцированные схемы и/или снижать дозы классических комбинаций лекарственных препаратов. Такой подход может приводить к падению эффективности лечения. Определение четкого алгоритма обследования и лечения пациентов с ХБП требует дальнейших исследований, результаты которых найдут отражение в последующих публикациях.
Выводы
ХБП у пациентов, обратившихся за онкологической помощью, встречается часто (33% от их общего числа), преимущественно в начальных стадиях (II и IIIa, суммарно 73,61%) и главным образом у больных онкоурологического и онкогинекологического профилей (суммарно 77,98%).
Наиболее частые причины дефицита фильтрационной функции – сопутствующие хронические заболевания почек (нефрангиосклероз, хронический пиелонефрит) и побочные действия медикаментозной терапии (суммарно 77,04%).
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы Трофимцевой Т.Н. на соискание ученой степени канд. мед. наук: «Противоопухолевая лекарственная терапия рака почки и мочевого пузыря в условиях хронической болезни почек II–IV стадий».



