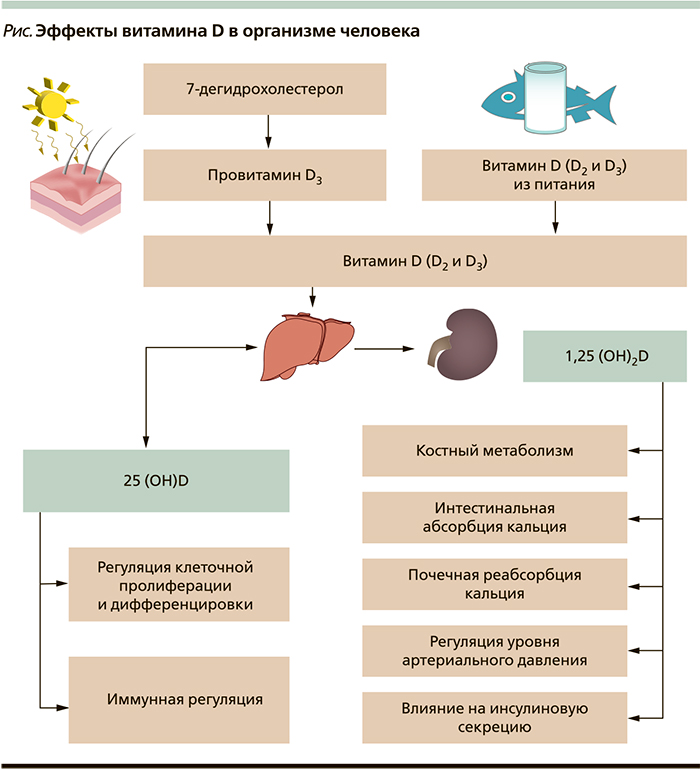
Витамин D поступает в организм человека двумя путями – с продуктами питания или через синтез в коже под влиянием ультрафиолетового (УФ) излучения. Во время пребывания на солнце 7-дигидрохолестерин в коже превращается в провитамин D3. Под воздействием тепла последний преобразуется в витамин D3. Витамин D2 поступает в организм с пищей. Витамин D3 также может поступать в организм человека с питанием, если им обогащены пищевые продукты, или в виде биологически активных добавок (БАД). Витамины D3 (холекальциферол) и D2 (эргокальциферол) отличаются только по строению боковой цепи. Различия не влияют на обмен веществ, обе формы витамина D функционируют как гормоны. Витамин D не становится биологически активным, пока не претерпит два ферментативных преобразования в виде гидроксилирования. Первое происходит в печени при посредничестве фермента 25-гидроксилазы (цитохром Р450 2R1 [CYP2R1]), в результате чего образуется 25-гидроксивитамин D – 25(OH)D. Он метаболизируется в различных тканях и клетках организма, участвуя в регуляции клеточной пролиферации и дифференцировки, способствует синтезу интерлейкинов и цитокинов, а также кателицидина D – противомикробного полипептида в макрофагах [1, 2] (см. рисунок).
Вторая реакция происходит в почках с помощью фермента 1α-гидроксилазы (CYP27B1), преобразующего 25(OH)D в биологически активный гормон кальцитриол – 1,25-дигидроксивитамин D, или 1,25(OH)2D, который взаимодействует с рецептором витамина D (VDR) в клетках организма [1]. Являясь важным компонентом минерального обмена, 1,25(OH)2D обеспечивает баланс костного метаболизма. При взаимодействии 1,25(OH)2D с VDR в тонкой кишке и остеобластах происходит регуляция метаболизма кальция и фосфора. Витамин D через его взаимодействия с VDR повышает эффективность всасывания кальция в кишечнике на 30–40 % и поглощения фосфора примерно до 80 % [3]. Без достаточного количества кальция и фосфора уменьшается минерализация коллагеновой матрицы кости, что приводит к развитию рахита у детей и остеомаляции у взрослых. Таким образом, последствиями недостатка 1,25(OH)2D являются задержка роста, деформация скелета у детей и остеопороз у взрослых [4, 5].
Наличие VDR было обнаружено в эндокринных органах (гипофиз, поджелудочная железа, паращитовидные и половые железы) и плаценте, тканях сердечно-сосудистой системы (эндотелиальные клетки, клетки гладкой мускулатуры сосудов и кардиомиоциты) [2, 6]. Широкая представленность VDR в тканях различных систем организма свидетельствует о важной роли витамина D в развитии многих заболеваний и патологических состояний.
Гиповитаминоз D может наблюдаться как у младенцев, так и у детей старшего возраста, подростков и взрослых. Многочисленные исследования свидетельствуют: поддержание достаточного уровня сывороточного 25-гидроксивитамина D необходимо не только для нормальной минерализации костей, но и для обеспечения адекватной иммунной функции организма, профилактики респираторных заболеваний [7], а также используется в комплексной терапии ожирения, метаболического синдрома, инсулинорезистентности [8–10], аллергических [11, 12], некоторых онкологических [13–15], сердечно-сосудистых [6] и аутоиммунных заболеваний [16].
Большинство экспертов, изучающих влияние витамина D на обменные процессы, сходятся во мнении, будто при дефиците 25(OH)D его уровень в сыворотке крови падает ниже 20 нг/мл, а при недостаточности находится в пределах 21–29 нг/мл. Целевая сывороточная концентрация витамина D у детей и взрослых должна быть выше 30 нг/мл, что обеспечивает реализацию всех его положительных эффектов на организм человека [5, 17]. На основании литературных данных избыточным считается уровень витамина D в крови выше 150–200 нг/мл. Интоксикация проявляется развитием гиперкальциемии, гиперкальциурии и часто гиперфосфатемии [18, 19].
В настоящее время признано, что 30–50 % жителей Европы и США имеют недостаточность витамина D [1]. Недавние популяционные исследования свидетельствуют о том, что распространенность гиповитаминоза D среди детского населения составляет 29–100 % [20]. Так, например, 61 % детей, проживающих в США, имеют 25(OH)D на уровне 15–29 нг/мл, 9 % – ниже чем 15 нг/мл [21]. Согласно результатам большого эпидемиологического исследования, высокая распространенность дефицита и недостаточности витамина D была выявлена даже в такой стране, как Бразилия, несмотря на наличие достаточной солнечной инсоляции. Дефицит витамина D был выявлен у 14 % детей до 10-летнего возраста и у 24 % подростков [22]. В Объединенных Арабских Эмиратах при обследовании 183 детей установлена более высокая частота дефицита витамина D в возрасте от 8 до 14 лет по сравнению с возрастом 2–7 лет. Таким образом, дети пубертатного возраста подвержены наибольшему риску дефицита витамина D. Это усугубляется тем, что потребность данной возрастной группы в витамине D часто не учитывается [23].
Основными факторами риска недостаточности витамина D среди детского населения являются сезон (зима), недостаточное время пребывания на открытом воздухе, интенсивность пигментации кожи, ускоренные темпы полового созревания и наличие сопутствующих заболеваний, ожирение, неиспользование обогащенных витамином D продуктов, женский пол [24].
Сезон года оказывает важное влияние на статус витамина D. Его уровень наиболее низок в зимний период, т.к. витамин D вырабатывается под воздействием солнечных лучей, а зимой солнечная инсоляция значительно снижается [25]. Девушки подвергаются большему риску низкого статуса витамина D в связи с частым использованием солнцезащитного крема или из-за ношения закрывающей одежды [26]. Подростки, как правило, тратят больше времени на приготовление школьных домашних заданий и, таким образом, меньше времени проводят на открытом воздухе [27]. Необходимость защищать младенцев грудного возраста от воздействия прямых солнечных лучей во избежание солнечного ожога является еще одним фактором риска витамин D – дефицитного состояния [28].
Концентрация витамина D у плода и новорожденного во многом зависит от статуса витамина D у его матери [29–31].
Поэтому поддержание достаточного уровня витамина D во время беременности способствует формированию здоровой костной системы у детей. По данным проспективного исследования, проведенного в Великобритании с участием 198 детей, сниженные концентрации 25(OH)D в крови матерей в конце беременности коррелировали со снижением минерализации костной ткани у детей в возрасте 9 лет [32]. Грудное молоко не способно обеспечить ребенку суточную потребность в витамине D [33]. В материнском молоке его содержание составляет от < 25 до 78 МЕ/л. Уровень витамина D в крови ребенка связано с его статусом у матери [34].

Большое количество пигмента меланина в эпидермальном слое уменьшает способность кожи вырабатывать витамин D под воздействием солнечного света [35].
Витамин D жирорастворим и для усвоения требует наличия пищевых жиров в кишечнике. Лица с пониженной способностью к поглощению жиров могут страдать от недостатка витамин D.
Индекс массы тела ≥ 30 кг/м2 прямо коррелирует со сниженным уровнем сывороточного 25(OH)D [35]. Наличие ожирения не влияет на способность кожи синтезировать витамин D, но большее количество подкожного жира поглощает больше витамина и замедляет его поступление в кровоток. Кроме того, повышение уровня лептина, вызванное избытком жировой ткани в организме, может ингибировать почечный синтез активной формы витамина D.
Таким образом, пациентами групп риска по недостаточности витамина D являются [35]:
- живущие в северных широтах;
- имеющие сниженный кожный синтез витамина D:
- темнокожие;
- использующие солнцезащитный крем;
- долго находящиеся в закрытых помещениях;
- носящие одежду, закрывающую все тело;
- страдающие ожирением;
- использующие альтернативные диеты или изменяющие структуру питания (молочные или с исключением продуктов животного происхождения);
- принимающие оральные контрацептивы и некоторые лекарственные препараты, взаимодействующие с витамином D.
Причины дефицита и недостаточности витамина D у детей и подростков [39]:
- снижение потребления или синтеза витамина D3:
- рождение от матери с дефицитным статусом витамина D;
- недоношенность;
- длительное исключительно грудное вскармливание;
- темный цвет кожи;
- уменьшение солнечной инсоляции;
- низкое потребление продуктов, содержащих витамин D;
- нарушения функции кишечника или кишечного всасывания:
- целиакия;
- экзокринная недостаточность поджелудочной железы (например, муковисцидоз);
- билиарная обструкция (например, желчная атрезия);
- снижение синтеза или повышенная деградация 25(OH)D или 1,25(OH)2D:
- хронические заболевания печени или почек;
- прием лекарств (рифампицин, изониазид, противосудорожные препараты).
Осознание влияния солнечного света и витамина D на состояние костной системы возникло с приходом индустриализации в Северную Европу. Недостаточная инсоляция приводила к выраженной задержке роста и развитию костных деформаций у детей. Эти изменения были определены как рахит – это заболевание, характеризующееся нарушением минерализации костной ткани, в результате чего возникает размягчение костей и деформация скелета [4]. В конце XIX – начале XX в. немецкие врачи отметили, что употребление 1–3 чайных ложек рыбьего жира в день может купировать клинические проявления рахита.
Среди причин рахита – широкое использование солнцезащитных кремов и длительное нахождение детей в помещениях. Рахит также распространен среди иммигрантов из Азии, Африки и Ближнего Востока, возможно, из-за генетических особенностей метаболизма витамина D и большей потребности в пребывании на солнце. Данная патология проявляется деформацией ног, расширением зон роста пластины запястья, лодыжек и реберно-хрящевых переходов, деформациями грудной клетки. Необходимо обращать внимание на симптомы, которые могут быть первыми признаками рахита: боли в ногах, задержка способности вставать на ножки или позднее хождение, отставание в росте. Начальным проявлением рахита может стать гипокальциемия. Для подтверждения диагноза выполняется рентгенография длинных трубчатых костей в областях коленных суставов и запястий, которая выявляет нарушение минерализации костей, широкие пластины роста и стертость краев метафизов [38–40].
К биохимическим маркерам рахита относятся гипофосфатемия и повышенный уровень щелочной фосфатазы. В некоторых тропических странах, где солнечная экспозиция достаточна, дефицит кальция является более важной, чем дефицит витамина D, причиной рахита [41, 42].
В 1919 г. Huldschinsky и соавт. сообщили, что для лечения рахита необходимо подвергнуть детей дополнительному воздействию УФ-излучения [43]. Это было подтверждено Hess и Unger в 1921 г., которые наблюдали положительный лечебный эффект воздействия солнечного света на детей, страдающих от рахита [44].
В 1930-х гг. был выделен экстракт дрожжей, подвергнутых УФ-облучению, обогащенный витамином D2, способный вызывать коррекцию симптомов рахита. Поскольку данное производство не было затратным, в США и Европе витамин D2 стали широко использовать для обогащения пищевых продуктов, включая молоко и хлеб. В дальнейшем начали извлекать 7-дегидрохолестерин из ланолина овечьей шерсти и воздействовать на него УФ для получения витамина D3. Затем витамином D3 стали фортифицировать многие продукты питания и пищевые добавки [1]. В начале 1950-х гг. была отмечена вспышка гиперкальциемии, в связи с чем в большинстве европейских стран запретили обогащение молока и молочных продуктов витамином D.
В США проводится обогащение витамином D3 молока и апельсинового сока, но большинство поливитаминных и фармацевтических препаратов содержит витамин D2 [5].
В отсутствие лечения дефицит витамина D приводит к необратимой задержке роста и карликовости, развитию сколиоза, плоскостопия, искривлению ног и деформации таза («плоскорахитический таз»), приводящему у женщин к акушерским осложнениям в момент родов, раннему кариесу, а также близорукости в школьном возрасте [45–47]. Низкий статус витамина D в организме отрицательно сказывается на состоянии костей у подростков. Неоптимальный рост костей в детстве является таким же важным фактором развития остеопороза, как и потеря костной массы. Если в детском и подростковом возрасте пик костной массы не достигает оптимального, остеопороз может развиваться не только вследствие повышенной интенсивности процесса резорбции, но и из-за снижения интенсивности процесса костеобразования, в частности при недостатке витамина D [48, 49].
В то время как рахит и остеомаляция являются общеизвестными типичными проявлениями дефицита витамина D, все большее количество исследований свидетельствует о роли дефицита и недостаточности витамина D в развитии сердечно-сосудистых заболеваний, включая артериальную гипертензию, сахарный диабет и рак. Гораздо меньше известно о влиянии витамина D на развитие хронических патологий у детей и подростков, но данные об этом начинают появляться. Показано, что дефицит витамина D повышает риск развития аутоиммунных заболеваний. Также установлено, что увеличение пребывания на солнце в детстве и раннем подростковом возрасте связано со снижением риска рассеянного склероза [50], тогда как у детей, проживавших первые 10 лет жизни в северных широтах, этот риск увеличивается [4].
По результатам обследования 129 детей и подростков с сахарным диабетом 1 типа, проведенного в Швейцарии, у 87 % из них уровень 25(ОН)D был ниже 75 нмоль/л, а у 60,5 % – ниже 50 нмоль/л [51]. Распространенность дефицита витамина D у детей и подростков с диабетом составила 43 % в австралийском исследовании [52], около 25 % – в итальянском [53] и 15–25 % в исследовании, проведенном на Восточном побережье США [54]. Добавки витамина D могут оказывать протективное действие в плане развития диабета. Доказательством послужили данные о почти 30 %-ном снижении риска сахарного диабета 1 типа у детей, получавших витамин D в раннем детстве [55].
Большое внимание в последние годы уделяется роли витамина D при психических заболеваниях, в частности при шизофрении и аффективных расстройствах [56]. В исследовании, проведенном с участием 197 студенток из ОАЭ, выявлено, что оптимизация уровня витамина D в крови способствует укреплению психического здоровья и профилактике депрессии [57]. Также в одном из исследований показано, что более высокие концентрации 25(OH)D3 ассоциировались с более низким уровнем депрессивных симптомов у детей со средним возрастом 13,8 года. Отмечена тенденция к ослаблению таких симптомов в возра-сте от 10,6 до 13,8 года. Уровень 25(OH)D2 не коррелировал с депрессивными симптомами [58].
Согласно современным данным, противоэпилептические препараты являются мощными индукторами энзимов печени и способствуют снижению минеральной плотности костей. Как показало одно из исследований с участием 78 пациентов с эпилепсией в возрасте 3–17 лет, дети, принимавшие противоэпилептические средства раннего и нового поколений, в равной степени были подвержены риску дефицита 25(OH)D [59]. Установлено также, что диета детей, страдающих эпилепсией, способствует гиповитаминозу D [60]. Поскольку многие дети не получают с питанием адекватное количество витамина D, это становится еще одним неблагоприятным фактором риска развития витамин D – дефицитного состояния [61]. Высокая распространенность недостаточности витамина D среди детей, страдающих эпилепсией, является дополнительным фактором риска получения костной травмы из-за припадков.
В педиатрической практике одной из основных причин заболеваемости и смертности во всем мире остаются инфекции [62]. В настоящее время существуют доказательства того, что 1,25(OH)2D регулирует иммунный ответ и обладает противовоспалительным действием. Несколько последних эпидемиологических исследований обнаружили связь между недостаточным содержанием витамина D в крови и заболеваемостью детей респираторными инфекциями. Muhe и соавт. (1997) проанализировали риск развития пневмонии у детей из Эфиопии, страдающих рахитом, и показали сильную положительную корреляцию между дефицитом витамина D и степенью выраженности нарушений дыхания при пневмонии [63]. Najada и соавт. (2004) обнаружили, что дети, госпитализированные с заболеваниями органов дыхания, имели более высокую частоту рахита [64]. Wayse и соавт. (2004) исследовали частоту острых инфекций нижних дыхательных путей у детей, поступивших в больницы Индии [65]. Их исследование показало наличие связи между субклиническим дефицитом витамина D и повышенным риском тяжелых инфекций этой локализации. Karatekin и соавт. (2007) из Турции обнаружили, что сывороточная концентрация 25(ОН)D у новорожденных с острыми инфекциями дыхательных путей была ниже, чем у здоровых детей контрольной группы. Риск развития этих инфекций значительно увеличивался при уровне 25(ОН)D менее 10 нг/мл [66].
Как известно, пик заболеваемости острыми респираторными вирусными инфекциями, особенно в педиатрической популяции, приходится на зимние месяцы, когда кожный синтез витамина D нарушен, но в одном из исследований лица с уровнем 25(OH)D ниже 10 нг/мл имели более высокий риск заболеть ими вне зависимости от сезона года [67]. В другом исследовании было показано, что уровень 25(OH)D у детей с бронхиолитом или пневмонией, поступивших в педиатрическое отделение интенсивной терапии, был ниже, чем у здоровых детей или детей с пневмонией, не нуждавшихся в терапии в условиях реанимации [68]. В рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном с декабря 2008 по март 2009 г. с целью оценки влияния добавки витамина D3 (1200 МЕ/сут) и плацебо на заболеваемость школьников гриппом А, выявлено, что из 167 детей, принимавших витамин D, заболели 18 (10,8 %) человек, а из 167 детей, получавших плацебо, – 31 (18,6 %) [69]. А в рандомизированном двойном слепом исследовании, проведенном с участием 744 монгольских школьников, дополнительный прием 300 МЕ витамина D в день в течение 7 недель (январь–март) снижал заболеваемость острыми респираторными инфекциями в течение зимних месяцев примерно на 50 % по сравнению с контрольной группой. За 7 недель наблюдения было отмечено значительное увеличение содержания 25(ОН)D по сравнению контрольной группой, хотя его уровни все еще соответствовали дефициту [70].
Низкий уровень 25(ОН)D в пуповинной крови имеет сильную обратную корреляцию с числом острых респираторных инфекций в первые 3 месяца жизни ребенка, а также с заболеваемостью респираторно-синцитиальной инфекцией в первый год жизни [71].
Рекомендации по потреблению витамина D в европейских странах варьируются в диапазоне от 0 до 600 МЕ для различных групп населения [72]. Например, в ЕС (Директива 2008/100/EC) суточная потребность человека в витамине D составляет 200 МЕ [73].
В России, согласно методическим рекомендациям «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» (2008), физиологическая потребность в витамине D для детей и взрослых составляет 400 МЕ/сут, для людей старше 60 лет – 600 МЕ/сут [74]. Значения рекомендуемой диетической дотации витамина D, приведенные в документе Dietary Reference Intakes, разработанном отделом по пищевым продуктам и питанию Института медицины Национальной академии США (2010), выше, чем в России (табл. 1) [35].
Потребность ребенка первого года жизни в витамине D составляет 400 МЕ/сут. Детям, находящимся на грудном вскармливании, необходимо осуществлять дотацию витамина D в дозе 400 МЕ/сут с 4–5-недельного возраста.
Если ребенок находится на искусственном вскармливании и получает в сутки более 1000 мл смеси, обогащенной витамином D с содержанием не менее 400 МЕ (дети второго полугодия жизни), дополнительно он не вводится.
Если ребенок получает менее 1000 мл смеси в сутки (дети первого полугодия жизни), витамин D добавляют в дозе 400 МЕ/сут [35].
Существует особая необходимость назначения витамина D детям из групп риска (например, страдающим ожирением). Витамин D может непосредственно регулировать секрецию инсулина путем связывания с VDR β-клеток поджелудочной железы [75]. Низкие уровни витамина D могут быть связаны с инсулинорезистентностью. Эпидемиологическое исследование с участием канадских детей и подростков (878 мальчиков и 867 девочек) показало положительную корреляцию между уровнем 25(OH)D и уровнями общего холестерина, аполипопротеина А1, аполипопротеина В и триглицеридов [76]. Проведенное в Корее исследование показало, что в сыворотке крови подростков в возрасте 12–13 лет уровни 25(OH)D были обратно пропорционально связаны с наличием инсулинорезистентности, концентрациями триглицеридов и липопротеинов низкой плотности [26]. По данным рандомизированного клинического исследования, у тучных подростков добавка витамина D3 по 4000 МЕ/сут в течение 6 месяцев значительно улучшила чувствительность к инсулину [77].
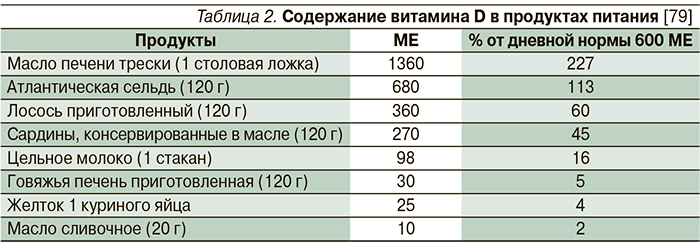
Сравнительно немногие природные продукты содержат витамин D. Одним из наиболее богатых его источников является жирная рыба (лосось, тунец, скумбрия) [35, 78]. Небольшое количество витамина D содержится в говяжьей печени, сыре и яичных желтках (табл. 2) [79]. Витамин D в этих продуктах представлен в форме метаболита 25(OH)D3 [80]. В разных количествах витамин D2 содержится в грибах [81, 82]. На рынке также существуют продукты питания, обогащенные витамином D (молоко, йогурты, детское питание). Продукты, обеспечивающие 20 % или более от дневной нормы витамина D, считаются источником питательных веществ с высоким его содержанием [78].
УФ-излучение с длиной волны 290–320 нм проникает через кожу и преобразует 7-дегидрохолестерин в провитамин D3, который в свою очередь становится витамином D3 [35]. Полная облачность уменьшает УФ-воздействие на 50 %, смог снижает его на 60 % [83]. УФ-излучение не проникает через стекло, поэтому воздействие солнечного света в помещении через окно не способствует образованию витамина D [84]. Солнцезащитные кремы с фактором защиты от солнца (SPF) ≥ 8 блокируют образование витамина D [85]. Предполагается, что пребывание на солнце около 5–30 минут с 10.00 до 15.00 два раза в неделю с открытым лицом, руками, ногами, спиной и без солнцезащитного крема обеспечивает достаточный синтез витамина D [3, 86]. При ограничении времени пребывания на солнце необходимо включать в рацион питания продукты, богатые витамином D, или принимать его в виде добавок. Несмотря на важность солнца для синтеза витамина D, целесообразно ограничить воздействие солнечного света и УФ-излучения соляриев на кожу без фотозащитных мер из-за их возможного канцерогенного действия [85, 87].
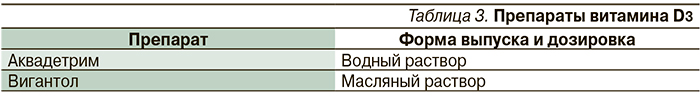
Существует две формы добавок витамина D в витаминизированных продуктах: D2 (эргокальциферол) и D3 (холекальциферол). Витамин D2 производится с помощью УФ-облучения эргостерина в дрожжевых грибах, витамин D3 – облучения 7-дегидрохолестерина ланолина. Витамины D2 и D3 традиционно считаются эквивалентными, поскольку большинство механизмов их действия идентичны и обе формы способны оказать терапевтический эффект [3]. С учетом важности участия витамина D в обменных процессах существует необходимость его курсового назначения детям не только до года, но и всех возрастных групп, а также взрослым. Витамин D можно рекомендовать в виде препаратов витамина D3 (табл. 3), а также в составе поливитаминных комплексов. Но необходимо помнить о возможности повышенного риска возникновения аллергических реакций при приеме поликомпонентных препаратов и невозможности их использования в течение длительного периода времени, что может стать препятствием для полноценного обеспечения организма витамином D.
В настоящее время для профилактики и лечения гиповитаминоза D предпочтителен водный раствор витамина D Аквадетрим.
Водные формы в отличие от масляных лучше всасываются и более предпочтительны для применения у недоношенных детей с незрелой пищеварительной системой, а также при наличии у ребенка сопутствующей патологии ЖКТ, характеризующейся сниженной способностью к усвоению жиров:
- синдрома нарушенного кишечного всасывания в тонкой кишке (пищевая аллергия, экссудативная энтеропатия, целиакия);
- синдрома холестаза;
- экзокринной недостаточности поджелудочной железы (относительной – реактивный панкреатит, синдром избыточного роста микробной флоры в тонкой кишке; абсолютной – муковисцидоз, синдром Швахмана–Даймонда);
- болезни Крона, язвенного колита и др. [36, 37].
Таким образом, недостаток витамина D является весьма распространенной проблемой у детей и подростков. Новые данные свидетельствуют о тесной связи между статусом витамина D, функционированием иммунной системы и развитием различных заболеваний. Повышенное внимание со стороны педиатров, детских неврологов, эндокринологов и других специалистов к витамину D у детей вполне оправданно, а рекомендации по увеличению времени активного отдыха на свежем воздухе и приема оптимального количества витамина D помогут улучшить здоровье как детского, так и взрослого населения [36].



