В настоящее время отмечен рост научного интереса к проблеме внутриматочных синехий, и связано это с увеличением количества пациенток, перенесших миомэктомию лапаротомным, лапароскопическим или вагинальным доступами, особенно числа операций, производимых со вскрытием полости матки [1–3]. Миома матки признана одной из самых распространенных доброкачественных опухолей женской половой системы и встречается с частотой до 75% [4, 5], при этом около 10% женщин, планирующих беременность, имеют диагностированную миому матки. Основные симптомы наличия миомы матки – кровотечение, невынашивание беременности, болевой синдром; при этом у пациенток с субмукозной локализацией узла (узлы 0–2 типов по классификации FIGO) эти симптомы встречаются в 2 раза чаще. Миомэктомия относится к самым популярным операциям, применяемым в гинекологии, ее частота достигает 50–70% [6]. По данным Donnez J. et al. [7], беременность наступает у 45% пациенток, перенесших миомэктомию.
Частота выявления внутриматочных синехий после операции миомэктомии широко варьирует в пределах от 5,8 до 50% [8]. После миомэктомий, выполненных лапаротомным доступом, внутриматочные синехии выявляются с частотой до 25,5%, после операций со вскрытием полости матки – в 2,5 раза чаще, чем без вскрытия [9–11]. Офисная гистероскопия является оптимальным методом диагностики и лечения внутриматочных синехий [12]. При этом, несмотря на тщательное разрушение внутриматочных синехий, высокой остается частота рецидивов – до 62,5% [13]. Способы профилактики возникновения внутриматочных синехий включают гормональную терапию, применение катетера Фоли, использование стволовых клеток и противоспаечных барьеров. Актуальным также является поиск новых стратегий, включающих применение ферментных препаратов, которые активно препятствуют разрастанию патологической соединительной ткани.
Бовгиалуронидаза азоксимер – это конъюгат фермента гиалуронидазы и высокомолекулярного носителя с иммуномодулирующими свойствами азоксимера бромида, который пролонгирует ферментативные свойства гиалуронидазы. Препарат регулирует синтез медиаторов воспаления (интерлейкин-1 и фактор некроза опухоли α), улучшает микроциркуляцию, уменьшает разрастание соединительной ткани [14], оказывает положительное влияние на результаты терапии воспалительных заболеваний органов малого таза [15]. Таким образом, внутриматочные синехии можно рассматривать как одну из причин репродуктивных неудач после миомэктомии; поэтому лечение и профилактика внутриматочных синехий являются актуальной задачей.
Учитывая актуальность репродуктивных проблем у пациенток с миомой матки, сотрудники ГБУЗ МО МОНИИАГ, наряду с ведущими специалистами отечественных и зарубежных клиник [1–3, 5, 6], много лет занимаются вопросами выполнения органосберегающих операций (в том числе у беременных с миомой матки), а также проблемами послеоперационной реабилитации после миомэктомии [16–18].
Цель исследования: изучить частоту внутриматочных синехий у пациенток после миомэктомии, оценить влияние противоспаечного фермента бовгиалуронидаза азоксимер на их формирование.
Материалы и методы
Для решения поставленных задач в исследование включено 160 женщин репродуктивного возраста с диагнозом «миома матки», которым проведено обследование и лечение на базе отделения оперативной гинекологии с онкогинекологией и дневным стационаром ГБУЗ МО МОНИИАГ. Исследование проводилось в 2 этапа: на первом этапе проведено ретроспективное исследование 80 пациенток после миомэктомии (40 пациенток – со вскрытием полости матки, 40 пациенток – без вскрытия полости матки). На втором этапе проведено открытое проспективное контролируемое исследование с участием 80 пациенток: 26 женщин после миомэктомии со вскрытием полости матки, которые получали в послеоперационном периоде бовгиалуронидазу азоксимер; 26 пациенток после операции миомэктомии со вскрытием полости матки, которые получали стандартную схему ведения послеоперационного периода; 28 пациенток после операции миомэктомии, произведенной без вскрытия полости матки (рисунок).
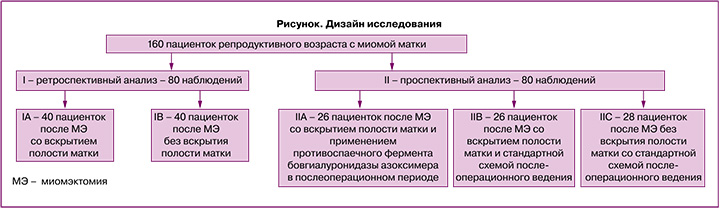
Критерии включения: репродуктивный возраст от 18 до 45 лет, установленный диагноз «миома матки» с показаниями к оперативному лечению, согласие пациентки на операцию и участие в научном исследовании. Критерии исключения: злокачественные новообразования любой этиологии, обострение воспалительных заболеваний любой локализации.
Нами проведена оценка клинико-анамнестических сведений (конституциональных особенностей, данных гинекологического осмотра, менструальной и репродуктивной функции, перенесенных гинекологических заболеваний и оперативных вмешательств, наличие экстрагенитальной патологии) у всех 160 пациенток с миомой матки. Повышенное внимание уделено репродуктивным исходам после миомэктомии (частота наступления беременности после операции в ретроспективной группе, наличие репродуктивных потерь, способ родоразрешения).
26 пациенткам ретроспективной группы, которые не реализовали репродуктивную функцию после операции, а также всем пациенткам проспективной группы (через 2 месяца после операции) проведена офисная гистероскопия для оценки состояния полости матки, диагностики возможной внутриматочной патологии (включая внутриматочные синехии) и, при необходимости, лечения. Для оценки степени тяжести внутриматочных синехий в баллах нами использована классификация AFS (1988 г.): внутриматочные синехии I стадии (1–4 балла) – наличие единичных, нежных синехий, занимающих менее трети полости матки; внутриматочные синехии II стадии (5–8 баллов) – нежные и плотные синехии, занимающие более трети полости матки; внутриматочные синехии III стадии (9–12 баллов) – плотные синехии, занимающие более половины полости матки. При выявлении единичных, нежных внутриматочных синехий пациенткам проводились адгезиолизис с помощью тубуса гистероскопа и гидродиссекция сращений; при плотных синехиях – с помощью гистероскопических инструментов. Проводилась также биопсия эндометрия с помощью щипцов. Далее нами проведен сравнительный анализ стандартной схемы послеоперационного лечения с дополнительным включением в схему терапии ферментного препарата бовгиалуронидаза азоксимер (для оценки влияния препарата на формирование внутриматочных синехий). Лиофилизат бовгиалуронидаза азоксимер применялся по схеме: 3000 МЕ внутримышечно 1 раз в 3 дня – 5 инъекций, начиная со вторых суток послеоперационного периода, затем 3000 МЕ в виде суппозиториев интравагинально по 1 суппозиторию 1 раз в 3 дня (всего 10 суппозиториев на курс).
Статистический анализ
Для математической обработки результатов исследования использовались параметрические методы (t-критерий Стьюдента) для нормального распределения показателей, непараметрические методы (U-критерий Манна–Уитни, Фишера, хи-квадрат, Уилкинсона) для оценки степени различия, в том числе групп с малой выборкой. Различия были приняты значимыми при р<0,05. Вычисления проведены с использованием стандартных статистических программ.
Рeзультaты и обсуждeниe
Средний возраст пациенток с диагнозом «миома матки», поступивших на оперативное лечение, составил 35,2 года в группе I и 36,7 года – в группе II. Минимальный возраст составил 20 лет, максимальный – 44 года.
Нормальный индекс массы тела отмечен у 34/80 (42,5%) пациенток из I группы и у 23/80 (28,75%) пациенток из II группы. Избыточную массу тела имели 33/80 (41,25%) пациентки из I группы и 35/80 (43,75%) – из II группы. Нарушение жирового обмена I степени выявлено у 12/80 (15%) пациенток в I группе и 20/80 (25%) – во II группе, нарушение жирового обмена II степени – у 1/80 (1,25%) и у 2/80 (2,5%) пациенток I и II групп соответственно.
При анализе наследственной предрасположенности выявлено наличие миомы матки у 48 (30%) родственниц первой линии (мать, сестра, тетя): в 27/80 (33,75%) наблюдениях у пациенток I группы и в 21/80 (26,25%) у пациенток II группы.
Средний возраст менархе в обследованных группах женщин составил 12 лет (минимальный – 10, максимальный – 16 лет).
При анализе сопутствующей гинекологической патологии выявлено сочетание миомы матки с эндометриозом матки у 30/80 (37,5%) пациенток I группы и у 21/80 (26,2%) – II группы.
В 16 (10%) случаях у женщин обеих групп в анамнезе имелись оперативные вмешательства на яичниках по поводу доброкачественных образований, 7 (4,4%) – по поводу миомы матки (выполнялась миомэктомия).
Анализ репродуктивных проблем до проведения операции миомэктомии у пациенток в обеих группах показал, что только 30/80 (37,5%) пациенток ретроспективной группы и 47/80 (58,7%) пациенток проспективной группы реализовали репродуктивную функцию. Самопроизвольные роды в анамнезе имели 57 (35,6%), кесарево сечение было у 20 (12,5%) женщин. Общее число репродуктивных потерь составило 40 (25%), при этом обнаружено, что в структуре репродуктивных потерь неразвивающаяся беременность в 2,75 раза чаще отмечалась у пациенток с субмукозной локализацией миомы матки – 11 (27,5%), чем с миомой иной локализации – 4 (10%). В обеих группах пациенток отмечена высокая частота встречаемости бесплодия – 60 (37,5%); при этом статистически значимо (p<0,05) установлена более высокая частота вторичного бесплодия у пациенток с субмукозной локализацией миомы – 18 (30%), чем при иной локализации узлов – 6 (10%).
Основные жалобы, предъявляемые пациентками с миомой матки: обильные длительные менструации – 94 (58,7%), при этом в 2 раза чаще (p<0,05) они отмечены у пациенток с 0–2 типом узлов: в IA подгруппе – 95%, во IIB – 53,8%. Межменструальные кровянистые выделения также в 3 раза чаще наблюдались у пациенток с субмукозной миомой матки. Несмотря на проводимую коррекцию препаратами железа, у 68 (42,5%) пациенток с миомой матки выявлена анемия различной степени тяжести; отмечено при этом, что значимо чаще анемия возникала при наличии узлов 0–2 типов (60%), чем узлов 3–7 типов (30%).
Болевой синдром отмечен у 71 (44,4%) пациентки, быстрый рост миоматозных узлов – у 59 (36,9%) пациенток, наличие нарушений функций смежных органов – у 18 (11,3%).
У 61 (38,1%) пациентки был диагностирован один миоматозный узел, у 99 (61,9%) пациенток выявлена множественная миома матки. При выполнении миомэктомии со вскрытием полости матки значимо чаще (р<0,05) миоматозные узлы имели тип 1–2 и гибридный тип расположения в 99 (61,9%) случаев. Так, энуклеация узлов 0–1 типов в 100% наблюдений приводила к вскрытию полости матки, узлов 2 типа – в 94,7%.
Анализ данных гистологического исследования: в 95 (59,4%) наблюдениях миома матки была представлена лейомиомой, в 49 наблюдениях (30,6%) – лейомиомой с отеком, в 16 (10%) наблюдениях – лейомиомой с некрозом.
Во время опроса женщин ретроспективной группы в отсроченном периоде (2–5 лет) после миомэктомии 72 (90%) отмечали положительную динамику, отсутствие жалоб, беспокоивших до проведения операции, нормализацию уровня гемоглобина. При этом в 8 (10%) случаях женщины этой группы сохраняли жалобы на болезненные менструации, что было связано с наличием сопутствующего эндометриоза матки.
При анализе репродуктивных исходов у женщин ретроспективной группы установлено: в 47 (58,7%) случаях беременность наступила самопроизвольно, в 7 (8,7%) случаях – с применением вспомогательных репродуктивных технологий. У 1 пациентки произошел самопроизвольный выкидыш. В дальнейшем 32 (59,3%) беременные родоразрешены с помощью кесарева сечения, 21 (38,9%) – через естественные родовые пути. Самопроизвольные роды произошли значимо чаще (p<0,05) у пациенток, которым была выполнена миомэктомия без вскрытия полости матки.
26 (32,5%) пациенткам ретроспективной группы, которые не реализовали репродуктивную функцию после миомэктомии, была выполнена офисная гистероскопия в отсроченном периоде. У 9/16 (56,3%) женщин IA подгруппы (при удалении узлов 0–2 типов) были выявлены внутриматочные синехии, из них у 2 (22,2%) пациенток синехии были представлены очень плотными фиброзными сращениями, которые занимали более 1/3 полости матки, что потребовало перехода на оперативную гистероскопию. У оставшихся 7 пациенток выявлены единичные сращения с поражением менее 1/3 полости матки. У 3 пациенток синехии были разрушены тубусом гистероскопа при осмотре и/или с помощью гидродиссекции, у 4 во время проведения офисной гистероскопии возникла необходимость в дополнительном использовании гистероскопических инструментов (ножниц, конхотома). В подгруппе IB (удаление узлов 3–7 типов без вскрытия полости матки) внутриматочные синехии обнаружены в 3/10 (30%) случаях; во всех наблюдениях синехии были единичными и разрушались тубусом гистероскопа при осмотре.
26 пациенток проспективной группы (подгруппа IIA) после проведения миомэктомии, выполненной со вскрытием полости матки, в послеоперационном периоде в комплексной терапии дополнительно получали ферментный препарат бовгиалуронидаза азоксимер. Через 2 месяца после миомэктомии при проведении офисной гистероскопии только у 1 (3,8%) больной данной подгруппы обнаружены внутриматочные синехии (этой пациентке ранее дважды выполнялось диагностическое выскабливание полости матки по поводу гиперплазии эндометрия и полипа эндометрия).
В подгруппе IIB (миомэктомия со вскрытием полости матки, стандартная послеоперационная терапия) внутриматочные синехии были выявлены у 6 (23,1%) пациенток. В подгруппе IIC (миомэктомия без вскрытия полости матки) внутриматочные синехии обнаружены у 4 (14,3%) пациенток.
Таким образом, препарат бовгиалуронидаза азоксимер продемонстрировал высокую эффективность в профилактике образования внутриматочных синехий в составе комплексной послеоперационной терапии после миомэктомии и помог достоверно снизить частоту образования синехий с 23,1 до 3,8% (p=0,03771).
У пациенток проспективной группы все синехии имели нежную, рыхлую структуру и были легко разрушены тубусом гистероскопа или с помощью гидродиссекции во время офисной гистероскопии, не потребовалось перехода на стандартную гистероскопию.
Результаты биопсии эндометрия соответствовали пролиферативной фазе менструального цикла. При наличии внутриматочных синехий I степени (нежные единичные сращения) биоптаты синехий были представлены тонкой соединительной тканью с участками эндометрия с кистозными расширениями отдельных желез, а при наличии синехий II степени биоптаты были представлены участками фиброзной ткани.
При анализе данных анамнеза пациенток обеих групп с внутриматочными синехиями выявлено, что, кроме миомэктомии, внутриматочные вмешательства различного характера были у 7/12 (58,3%) пациенток ретроспективной группы и у 8/11 (72,7%) пациенток проспективной группы. Также проведен анализ возможных факторов, повлиявших на образование внутриматочных синехий; вскрытие полости матки во время миомэктомии узлов 0–2 типа явилось достоверно значимым фактором риска образования внутриматочных синехий. Прочими «повреждающими» факторами были внутриматочные манипуляции: выскабливание полости матки по поводу неполного самопроизвольного выкидыша, неразвивающейся беременности, гиперплазии эндометрия, инструментального аборта. Кесарево сечение в меньшей степени явилось травмирующим фактором для эндометрия в данном аспекте.
Заключение
Внутриматочные синехии являются одной из причин бесплодия после миомэктомии, особенно после удаления узлов 0–2 типа. Офисная гистероскопия используется в качестве метода выбора диагностики и лечения внутриматочных синехий и другой внутриматочной патологии. Проведение офисной гистероскопии целесообразно в программе реабилитации пациенток после миомэктомии (в особенности при вскрытии полости матки на большом протяжении, оптимальный срок проведения офисной гистероскопии – через 2 месяца после оперативного лечения). Также офисная гистероскопия показана при сохраняющейся инфертильности в отсроченном периоде. Целесообразно дополнить программу реабилитации пациенток, оперированных по поводу субмукозной миомы матки, применением противоспаечных препаратов. Включение в схему терапии фермента бовгиалуронидаза азоксимер в послеоперационном периоде является эффективным; препарат оказывает выраженный противоспаечный эффект, в том числе применяется для профилактики формирования внутриматочных синехий.



