Атеротромбоз и его осложнения остаются ведущей причиной смертности в мире. В 2008 г. вследствие нестабильной стенокардии, острого инфаркта миокарда (ИМ), ишемической болезни мозга и нарушения периферического кровообращения умерли более 17,3 млн человек, из них 80 % – в странах с низким и средним уровнями дохода [1]. По расчетам Всемирной организации здравоохранения, к 2030 г. ежегодная смертность вследствие сердечно-сосудистых осложнений достигнет 23,6 млн случаев [1].
Ключевая роль в патогенезе атеротромбоза принадлежит тромбоцитам, поэтому основной фармакологической группой, применяемой для первичной и вторичной профилактики атеротромботических осложнений, являются антиагреганты. В настоящее время на фармацевтическом рынке имеются антиагреганты с различными механизмами действия: ингибиторы тромбоксана А2 (ацетилсалициловая кислота – АСК), антагонисты рецепторов P2Y12 АДФ (клопидогрел, прасугрел, тиклопидин, тикагрелор), ингибиторы фосфодиэстеразы (дипиридамол), ингибиторы гликопротеиновых рецепторов IIb/IIIa (абциксимаб, эптифибатид, тирофибан). Однако, несмотря на это, проблема первичной и вторичной профилактики тромботических осложнений остается не до конца решенной, что обусловлено недостаточной эффективностью и/или недостаточной безопасностью современных антиагрегантов. Все антиагреганты повышают риск кровотечений, причем чем выше эффективность препарата, тем выше этот риск [2]. Неэффективность монотерапии антиагрегантами часто вызывает необходимость применения комбинации двух и даже трех препаратов с разным механизмом действия, что в свою очередь еще в большей степени повышает риск развития кровотечений. Все это диктует необходимость разработки препаратов с новым механизмом действия. К таким препаратам относится ворапаксар (Зонтивити, Merck & Co), зарегистрированный в США в мае 2014 г. [3].
Механизм действия и фармакологические свойства
Ворапаксар (изучался под названием SCH 530348), синтетический аналог естественного вещества гимбацина, – первый представитель нового класса антиагрегантов – антагонистов активируемых протеазой рецепторов (PAR-1) тромбина. Стимуляция рецепторов PAR-1 приводит к продукции тромбоксана А2, высвобождению АДФ, серотонина и адреналина, активации/мобилизации P-селектина и лиганда CD40, что в итоге вызывает активацию тромбоцитов [5, 6]. Блокируя PAR-1, ворапаксар вызывает обратимое дозозависимое угнетение тромбин-индуцированной агрегации, при этом не влияя на способность тромбина катализировать образование фибрина и не ингибируя коллаген-индуцированную агрегацию тромбоцитов [7–9]. С теоретической точки зрения преимуществом антагонистов PAR-1 перед препаратами с другим механизмом действия является то, что угнетение активации тромбоцитов под их влиянием не должно приводить к нарушению протективных гемостатических функций и препятствовать восстановлению структуры сосудистой стенки [7, 8].
Ворапаксар имеет небелковую природу и активен при приеме внутрь. Он быстро всасывается в желудочно-кишечном тракте и обладает высокой биодоступностью. Метаболизм препарата происходит в печени с участием изофермента цитохрома P450 3A4, поэтому одновременный прием мощных индукторов или ингибиторов этого изофермента (например, рифампицина или кетоконазола) может оказать существенное влияние на антитромбоцитарный эффект ворапаксара [10]. Выводится ворапаксар преимущественно с калом и в небольшой степени (менее чем 5 %) – с мочой [9]. Его период полувыведения составляет 159–311 часов, в связи с чем антитромбоцитарный эффект продолжается в течение 4 недель после отмены [4, 11].
Клинические исследования
В исследованиях I фазы было показано, что при однократном введении в дозе 5–40 мг ворапаксар более чем на 90 % угнетает индуцированную тромбином агрегацию тромбоцитов, а его антиагрегантный эффект продолжается > 72 часов [12]. При этом препарат хорошо переносится лицами европейского и азиатского (японцы) происхождения [13], а его фармакодинамика и фармакокинетика существенно не различаются у пациентов разных этнических групп [14].
Эффективность и хорошая переносимость препарата были продемонстрированы и в двойном слепом плацебо-контролируемом рандомизированном исследовании II фазы TRA-PCI (Thrombin Receptor Antagonist Percutaneous Coronary Intervention, n = 1030). В этом исследовании ворапаксар изучали на пациентах, которым предстояло неургентное чрескожное коронарное вмешательство (ЧКВ) или коронарная ангиография с плановым ЧКВ [15]. Участники получали стандартные режимы антитромботической терапии, в т.ч. двойную терапию, преимущественно АСК и клопидогрелом (АСК принимали 96 % участников). Нагрузочные дозы активного препарата составили 10, 20 и 40 мг, поддерживающие дозы – 0,5; 1,0 и 2,5 мг/сут. Прием поддерживающих доз в группе пациентов, которые впоследствии перенесли ЧКВ (первичная когорта ЧКВ), продолжался в течение 60 дней. Первичной конечной точкой была частота клинически значимых кровотечений при оценке по шкале TIMI (Thrombolysis in Myocardial Infarction), вторичной – сочетание смерти, ИМ и инсульта.
Повышения риска кровотечения по сравнению с плацебо при применении вораксапара в целом и различных режимов его дозирования выявлено не было. Вторичная конечная точка в первичной когорте ЧКВ оказалась недостоверно ниже, чем в группе плацебо (плацебо – 9 %, 10 мг – 8 %, 20 мг – 5 %, 40 мг – 5 %; отношение шансов – 0,67, 95 % доверительный интервал [ДИ] – 0,33–1,34).
Результаты исследования TRA-PCI позволили предположить благоприятный профиль безопасности вораксапара, что явилось основанием проведения исследований III фазы – TRACER (Thrombin Receptor Antagonist for Clinical Event Reduction in Acute Coronary Syndrome) и TRA 2 P–TIMI 50 (Thrombin Receptor Antagonist in Secondary Prevention of Atherothrombotic Ischemic Events – Thrombolysis in Myocardial Infarction 50).
В исследовании TRA 2 P–TIMI 50 (n = 26 449) оценивалась эффективность и безопасность ворапаксара при применении в суточной дозе 2,5 мг в качестве средства вторичной профилактики для пациентов со стабильным атеросклерозом (ИМ в анамнезе, ишемическим инсультом или заболеванием периферических артерий) [16]. Комбинированная первичная конечная точка включила смерть от сердечно-сосудистых причин, ИМ, инсульт и рецидив ишемии, приводящий к необходимости ургентной коронарной реваскуляризации (УКР).
Промежуточный анализ эффективности и безопасности, проведенный через 2 года после начала исследования, выявил повышенный риск внутричерепных кровотечений у пациентов с инсультом в анамнезе, в связи с чем эти участники прекратили прием препарата. Однако исследование было разрешено продолжить пациентам с ИМ и заболеваниями периферических артерий в анамнезе (около 75 % всех участников).
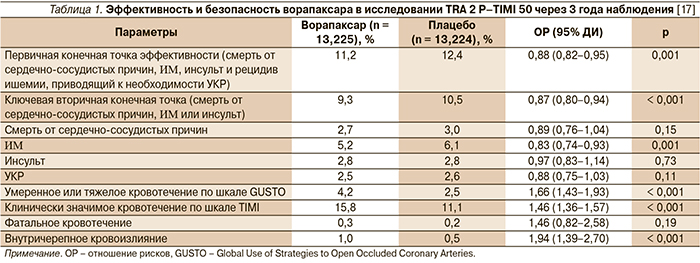
Через 3 года наблюдения риск первичной конечной точки был достоверно (на 13 %) ниже в группе ворапаксара (9,3 %) по сравнению с группой плацебо (10,5 %; р < 0,001) (табл. 1).
Сердечно-сосудистая смерть, ИМ, инсульт или ишемический приступ, приведший к госпитализации, наблюдались у 11,2 % пациентов, получавших ворапаксар, и у 12,4 % получавших плацебо (р = 0,001). Наиболее выраженное снижение числа сердечно-сосудистых событий (20 %) среди пациентов, получавших ворапаксар, было выявлено в подгруппе с ИМ в анамнезе (р < 0,001). Однако прием ворапаксара ассоциировался с повышенным риском умеренных и тяжелых кровотечений (4,2 против 2,5 %), включая внутричерепные (1,0 против 0,5 %; р = 0,001).
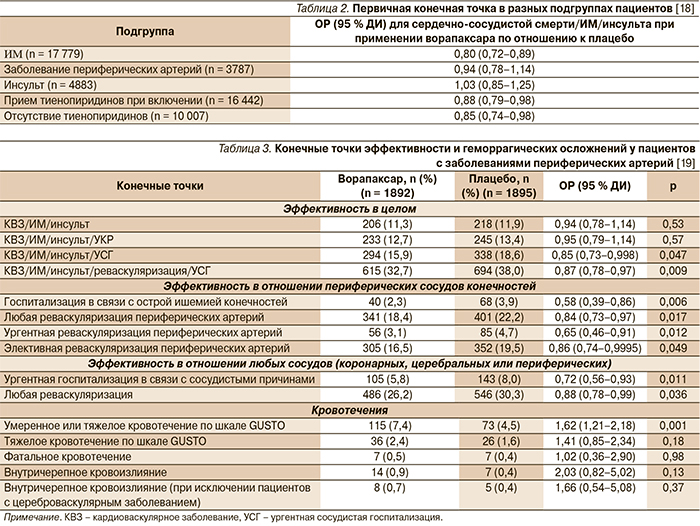
Результаты анализа отдельных подгрупп пациентов, участвовавших в исследовании TRA 2 P–TIMI 50, представлены в табл. 2.
Анализ подгруппы участников с заболеванием периферических артерий показал, что у этой категории пациентов варопаксар не снижал риска кардиоваскулярной смерти, ИМ или инсульта, но приводил к значительному снижению частоты острой ишемии нижних конечностей и реваскуляризации периферических артерий (табл. 3) [19].
В целом исследование TRA 2 P–TIMI 50 продемонстрировало, что добавление ворапаксара к стандартной антиагрегантной терапии пациентов с атеросклерозом достоверно снижает риск сердечно-сосудистых событий и смерти. Однако в нем также было показано, что у пациентов, перенесших инсульт, риск от применения данного препарата может превышать пользу.
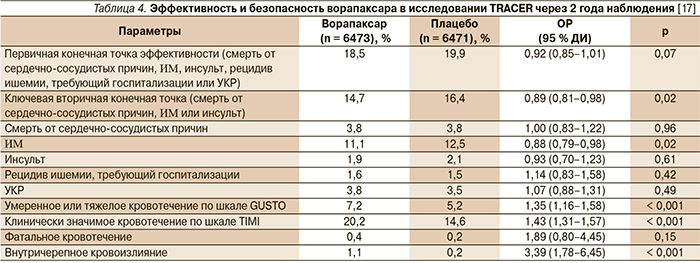
Повышенный риск кровотечений под влиянием ворапаксара явился основанием досрочного прекращения другого исследования III фазы – TRACER, участниками которого были 12 944 пациента с острым коронарным синдромом без повышения сегмента ST [20]. Согласно заключению исследования TRACER, добавление ворапаксара к стандартной терапии этой категории пациентов не приводит к существенному снижению первичной комбинированной конечной точки (смерть от сердечно-сосудистых причин, ИМ, инсульт, рецидив ишемии, требующий госпитализации или УКР), но существенно повышает риск кровотечений, включая внутричерепные кровоизлияния (1,1 против 0,2 % в группе плацебо; ОР = 3,39; 95 % ДИ – 1,78–6,45; p < 0,001). Результаты исследования TRACER представлены в табл. 4.
Объединенный анализ данных участников обоих исследований III фазы показал, что ворапаксар может принести дополнительную пользу больным, перенесшим ИМ, но потенциально опасен для пациентов с цереброваскулярными событиями в анамнезе [17].
Мнение экспертов
Исследование TRACER поставило под сомнение вопрос о регистрации ворапаксара, на разработку которого было затрачено 1,7 млрд долл. [21], однако на основании результатов исследования TRA 2 P–TIMI 50 в январе 2014 г. консультативная комиссия FDA (Food and Drug Administration) большинством голосов (десять против одного) рекомендовало одобрить препарат для профилактики тромботических осложнений в качестве дополнительного средства к стандартной терапии (за исключением пациентов, перенесших нарушения мозгового кровообращения). FDA одобрило 8 мая 2014 г. применение ворапаксара для снижения риска ИМ, инсульта, сердечно-сосудистой смерти и реваскуляризации у пациентов, перенесших ИМ, или с заболеваниями периферических артерий [22]. В инструкцию по применению препарата будет включено предостережение в черной рамке о риске кровотечений, в связи с чем противопоказанием к его применению является наличие в анамнезе инсульта, транзиторной ишемической атаки и внутричерепного кровоизлияния.
Поскольку факторами риска кровотечения являются пожилой возраст, низкая (менее 60 кг) масса тела, нарушение функции почек или печени и наличие кровотечений в анамнезе, рекомендуется избегать применения препарата этими больными [22]. Ворапаксар не следует комбинировать с антикоагулянтами и фибринолитиками, а также назначать пациентам, получающим хроническую терапию нестероидными противовоспалительными средствами и антидепрессантами групп селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата норадреналина [22].
Эксперты неоднозначно оценивают соотношение польза/риск препарата. Дискуссия на эту тему завязалась на 61-й ежегодной научной сессии Американского колледжа кардиологии [18]. По мнению одного из исследователей TRA 2 P–TIMI 50, D.A. Morrow, ворапаксар впервые продемонстрировал дополнительную пользу при добавлении к АСК пациентам со стабильной атеросклеротической болезнью, перенесшим ИМ [18]. В то же время доктор Steven Nissen из Кливлендской клиники (США) оценивает результаты исследования TRA 2 P–TIMI 50 как отрицательные.
Свое мнение он аргументирует тем, что в группе варопаксара было зарегистрировано лишь на 148 меньше нежелательных сердечно-сосудистых явлений, чем в группе плацебо, и при этом на 178 больше умеренных и тяжелых кровотечений, включая 49 внутричерепных [18]. Авторы последнего обзора результатов клинических исследований ворапаксара указывают, что препарат продемонстрировал определенную пользу для некоторых подгрупп пациентов и потенциальный вред для других, однако, насколько данные клинических исследований подтвердятся в клинической практике, остается неизвестным [17]. Они также рекомендуют проведение дальнейших исследований ворапаксара, а до получения их результатов советуют очень тщательно отбирать кандидатов для лечения данным препаратом.



