Распространенность аллергических заболеваний (АЗ) в настоящее время носит характер пандемии. Только в Европе около 150 млн человек имеют тот или иной вид аллергии, 30 % европейцев страдают от аллергического ринита и конъюнктивита, 20 % имеют бронхиальную астму (БА), 15 % – кожные АЗ [1]. Прогностические исследования свидетельствуют о дальнейшем росте распространенности и заболеваемости АЗ. В настоящее время имеется обширный выбор современных фармакологических препаратов, эффективно контролирующих симптомы различных АЗ. Однако поиск средств и методов иммуномодулирующего воздействия, которые позволят предотвращать усугубление заболевания, развитие обострений и осложнений, остается приоритетной задачей современной аллергологии и иммунологии. Ярким примером служит аллергенспецифическая иммунотерапия (АСИТ), давно и успешно применяемая в лечении таких АЗ, как аллергический риноконъюнктивит, атопическая БА, аллергические реакции на укусы насекомых. Вместе с тем не всем пациентам удается проводить этот вид лечения и не у всех пациентов достигается желаемый эффект. Поэтому неспецифическая иммунотерапия с помощью регуляторных естественных и рекомбинантных пептидов является востребованным направлением клинической и экспериментальной аллергологии.
В нашей стране представителем данного класса препаратов является полипептидный препарат Рузам®, обладающий противоаллергической и противовоспалительной активностью. Первые исследования в направлении поиска принципиально нового противоаллергического средства начались в 1978 г., когда Б.Л. Мазур и Е.Б. Галкина предложили способ быстрого культивирования термофильных штаммов микроорганизмов. Препарат Рузам был разработан на базе НИИ пульмонологии группой российских ученых во главе с академиком РАМН А.Г. Чучалиным и профессором Н.А. Колгановой. Он представляет собой фильтрат культуры термофильного штамма Staphylococcus aureus, получаемый по оригинальной технологии (патент № 2641293 а/с 873684 и 43320 38/28-14 1978 и 1987 гг.). Методом ионообменной хромотографии установлено, что по химической структуре Рузам – это липопротеин. Он не содержит микроорганизмов и является продуктом жизнедеятельности термофильного штамма S. aureus. Под влиянием Рузама уменьшаются реакция пассивной кожной анафилаксии и уровень реагиновых антител в крови, благодаря чему снижается выраженность аллергических реакций. Рузам способствует активации клеточного звена иммунитета и оказывает противовоспалительное действие. Доказано, что Рузам приводит к снижению уровня иммуноглобулина Е (IgE) [2, 3].
Более 10 лет препарат Рузам успешно применяется врачами-аллергологами нашей страны для лечения следующих АЗ:
- поллиноза;
- бронхиальной астмы;
- сезонного и круглогодичного ринита;
- атопического дерматита;
- рецидивирующей крапивницы и ангиоотеков;
- латексной и пищевой аллергии;
- инсектной аллергии;
- профилактики частых респираторных инфекций у пациентов с АЗ.
На сегодняшний день препарат зарегистрирован в виде раствора для подкожного введения (ЛС 000791 251110), хотя продолжаются активные исследования по применению назальной и ингаляционной форм препарата [4, 5].
Применение препарата Рузам® у больных БА
БА по-прежнему остается распространенным заболеванием, поражающим детей, подростков и взрослых. Несмотря на доступность современных фармакологических препаратов для лечения БА, большинство пациентов имеют недостаточный контроль заболевания и высокую частоту обострений [6]. Сложность достижения контроля за БА обусловлена большой гетерогенностью клинических форм и вариабельностью течения заболевания.
Фенотипическая гетерогенность БА
Гетерогенность БА проявляется в разной выраженности бронхиальной обструкции, разной частоте обострений, разном ответе на бронходилататоры и препараты для длительного контроля. Поэтому современная терапия БА требует глубокого анализа факторов, ответственных за прогрессирование заболевания и развитие обострений, а также разработку целевой терапии заболевания с учетом клинических и биологических фенотипов болезни.
Важность этого подхода нашла отражение в последнем пересмотре GINA (Global Initiative for Asthma 2014 –
Глобальная инициатива по бронхиальной астме) [6] с приведенными фенотипами БА, которые довольно легко могут быть идентифицированы в обычной клинической практике:
Аллергическая БА: наиболее легко распознаваемый фенотип, который часто начинается в детстве, связан с наличием АЗ (атопический дерматит, аллергический ринит, пищевая или лекарственная аллергия) в анамнезе или у родственников. Исследование индуцированной мокроты до лечения пациентов с этим фенотипом БА часто выявляет эозинофильное воспаление дыхательных путей. Пациенты с фенотипом аллергической БА обычно хорошо отвечают на терапию ингаляционными кортикостероидами (ИГКС).
Неаллергическая БА: некоторые взрослые имеют БА, не связанную с аллергией. Профиль воспаления дыхательных путей у больных данным фенотипом БА может быть нейтрофильным, эозинофильным или малогранулоцитарным. Эти пациенты часто не очень хорошо отвечают на ИГКС.
БА с поздним дебютом: у некоторых пациентов, особенно у женщин, БА впервые развивается уже во взрослом возрасте. Эти больные чаще не имеют аллергии и требуют более высоких доз ИГКС или относительно рефрактерны к ГКС-терапии.
БА с фиксированной обструкцией дыхательных путей: у некоторых пациентов с длительным анамнезом БА развивается фиксированная обструкция дыхательных путей, которая формируется, по-видимому, вследствие ремоделирования бронхиальной стенки.
БА у больных ожирением: некоторые пациенты с ожирением и БА имеют выраженные респираторные симптомы и незначительное эозинофильное воспаление.
Еще один важный фенотип с точки зрения исхода заболевания – БА с частыми обострениями. Частые обострения у больных БА связаны с более выраженным снижением функции легких, а тяжелые обострения, кроме того, – с риском смертельного исхода [7, 8].
В исследовании T.R. Bai и соавт. [7] оценивали функцию легких и частоту обострений у 93 взрослых больных среднетяжелой и тяжелой БА на протяжении 11 лет. Как показали результаты исследования, пациенты с частыми обострениями БА имели более низкую функцию легких и ускоренное снижение объема форсированного выдоха за 1-ю секунду (ОФВ1) в среднем за год (30,2 мл) по сравнению с пациентами с редкими обострениями БА (16,9 мл). Персистирующие неконтролируемые симптомы БА связаны с риском развития тяжелого обострения БА, а значимым предиктором тяжелого обострения является уже перенесенное в предыдущий год, потребовавшее применения пероральных ГКС или госпитализации, или обращения за неотложной помощью, а также низкий показатель ОФВ1/ФЖЕЛ (форсированная жизненная емкость легких), высокая бронхиальная гиперреактивность и эозинофилия крови и мокроты [8].
Респираторные вирусные инфекции – триггеры обострения БА
 Среди причин обострений БА первое место занимают респираторные вирусные инфекции. Около 85 % всех обострений БА у детей и более 50 % у взрослых провоцируются респираторными вирусами, причем исследования свидетельствуют: больные БА более тяжело переносят заболевания респираторными инфекциями по сравнению со здоровыми, что говорит о нарушении у них антивирусного иммунного ответа [9–11]. Синергичные взаимосвязи могут развиваться между аллергеном и вирусом у больных атопической БА, увеличивая риск развития обострений в несколько раз. В исследованиях с провокацией специфическим аллергеном было показано, что респираторные вирусы способны вызывать воспаление в дыхательных путях, которое приводит к повышенному иммунному ответу на аллергенный стимул, вызывая таким образом обострение БА [12, 13]. Существует определенная связь между аллергическим фенотипом и сниженным антивирусным иммунным ответом, продемонстрированная больными атопической БА [12]. Дендритные клетки больных аллергической БА продуцировали значительно меньше интерферона-α (ИФН-α) в ответ на экспозицию вируса гриппа по сравнению с здоровыми донорами. В ряде других исследований был выявлен нарушенный синтез ИФН-γ, ИФН-β и ИФН-λ, коррелировавший с выраженностью симптомов БА, снижением легочной функции и маркерами воспаления [10, 14–16]. Кроме этого у больных атопической БА выявлена нарушенная регуляция Тоll-подобных рецепторов (TLR3, TLR7, TLR8, TLR9), распознающих РНК респираторных вирусов и стимулирующих продукцию интерферонов [16].
Среди причин обострений БА первое место занимают респираторные вирусные инфекции. Около 85 % всех обострений БА у детей и более 50 % у взрослых провоцируются респираторными вирусами, причем исследования свидетельствуют: больные БА более тяжело переносят заболевания респираторными инфекциями по сравнению со здоровыми, что говорит о нарушении у них антивирусного иммунного ответа [9–11]. Синергичные взаимосвязи могут развиваться между аллергеном и вирусом у больных атопической БА, увеличивая риск развития обострений в несколько раз. В исследованиях с провокацией специфическим аллергеном было показано, что респираторные вирусы способны вызывать воспаление в дыхательных путях, которое приводит к повышенному иммунному ответу на аллергенный стимул, вызывая таким образом обострение БА [12, 13]. Существует определенная связь между аллергическим фенотипом и сниженным антивирусным иммунным ответом, продемонстрированная больными атопической БА [12]. Дендритные клетки больных аллергической БА продуцировали значительно меньше интерферона-α (ИФН-α) в ответ на экспозицию вируса гриппа по сравнению с здоровыми донорами. В ряде других исследований был выявлен нарушенный синтез ИФН-γ, ИФН-β и ИФН-λ, коррелировавший с выраженностью симптомов БА, снижением легочной функции и маркерами воспаления [10, 14–16]. Кроме этого у больных атопической БА выявлена нарушенная регуляция Тоll-подобных рецепторов (TLR3, TLR7, TLR8, TLR9), распознающих РНК респираторных вирусов и стимулирующих продукцию интерферонов [16].
Как видно из вышесказанного, существует по крайней мере четыре фенотипа БА, при которых может отмечаться сниженный эффект терапии основным классом противовоспалительных противоастматических препаратов – ИГКС. Помимо этого у некоторых пациентов с БА отмечается высокая частота респираторных вирусных инфекций и связанных с ними обострений БА. Поэтому для этих пациентов закономерно возникает необходимость дополнительного (к основной фармакотерапии) лечения, одним из вариантов которого может быть применение иммунорегуляторных пептидов, в частности препарата Рузам.
Клиническая эффективность Рузама при БА
Специфические антивирусные стратегии профилактики обострений БА существуют пока только против вируса гриппа и заключаются в проведении вакцинации. Однако проводятся исследования по поиску и изучению эффективности потенциальных антивирусных препаратов, в т.ч. интерферонов и их индукторов. Одним из таких методов лечения является иммунотерапия пептидами, к которой и относится препарат Рузам®.
Клинические исследования препарата Рузам® в лечении больных БА проводятся с начала 1990-х гг. Показано, что при подкожном введении Рузам уменьшает интенсивность и частоту приступов бронхиальной обструкции, снижает объем необходимой лекарственной терапии больных, страдающих БА [17]. Терапия Рузамом пациентов с латекс-индуцированной БА способствовала снижению интенсивности и тяжести приступов удушья; 31 % больных, сенсибилизированных к латексу, отметили стойкую ремиссию в течение года после лечения препаратом Рузам [18]. В обширном научном исследовании Н.А. Колгановой лечение Рузамом получили 302 пациента с БА. В результате проведенной терапии положительный эффект отмечен в 93 % случаев, из которых в 61 % результаты лечения оценены как отличные и хорошие. В группе сравнения (больные получали только базисную противоастматическую терапию) положительный эффект от лечения был в 84 % случаев (разница с Рузамом несущественная), однако при детальном анализе процент отличных и хороших результатов у этих пациентов был значимо ниже – у 48 % больных (разница достоверна) [19].
В другом исследовании проведена оценка противоаллергического и противовоспалительного действий препарата Рузам на 64 пациентов с персистирующей БА легкой и средней степеней тяжести.
После 10-недельного курса лечения достоверно снижались суммарный индекс симптомов БА и потребность в симптоматической терапии, уровень цитологических маркеров аллергического воспаления (эозинофилы в индуцированной мокроте), показатели IgE в сыворотке крови, уровень оксида азота в выдыхаемом воздухе [20]. В исследовании Г.Л. Осиповой проанализирована эффективность применения Рузама у 257 больных БА легкого и среднетяжелого течения. На фоне проводимого лечения пациентам удалось снизить объем лекарственной терапии в 2 раза; у них отмечена положительная динамика симптомов; у 65 % больных наблюдалось увеличение сроков ремиссии заболевания в среднем до 2–3 лет. У 60 % больных снизился уровень IgE в 1,5 раза и повысился уровень IgG [21].
Профилактика обострений БА с помощью препарата Рузам
Недавно опубликованные исследования, проведенные авторами данной статьи, продемонстрировали возможность профилактики обострений БА, связанных с острыми респираторными инфекциями (ОРИ), с помощью терапии препаратом Рузам, применяемого в виде подкожных инъекций [22] и ингаляционной формы (ингаляционная форма Рузама пока не зарегистрирована для клинического применения) [4].
В исследование Н.А. Новиковой и соавт. [22] были включены 32 пациента с атопической БА в возрасте от 18 до 65 лет, получавших базисную противоастматическую терапию ИГКС в виде монотерапии или в комбинации с длительно действующими β-агонистами (ДДБА). Перед началом исследования всем пациентам проведено иммунологическое обследование, исследование функции внешнего дыхания, определен уровень контроля БА (АСТ-тест), учтено число ингаляций β-агонистов короткого действия (КДБА), оценено число обострений БА и эпизодов ОРИ за предшествующий год. Лечение Рузамом начали с конца августа – начала сентября, первый курс состоял из 10 инъекций по 0,2 мл подкожно 1 раз в неделю на фоне неизменяемой базисной терапии. Второй курс Рузама проведен по той же схеме с начала февраля. Наблюдение за пациентами осуществлялось в течение года.
В результате проведенного лечения у пациентов уменьшилось число случаев ОРИ за год в 2,5 раза, при этом пациенты отметили более легкое течение ОРИ. Ни у одного из пациентов не было обострений БА в течение года ни на фоне переносимого ОРИ, ни в сезон цветения причинно-значимых аллергенов; объем базисной терапии в зимнее время и в сезон цветения не увеличился, а 6 пациентам объем базисной терапии в летнее время удалось снизить в 2 раза. Пациенты отметили улучшение самочувствия, средний балл АСТ-теста в конце августа увеличился с 21 до 24 через год, полный контроль БА был достигнут у 26 пациентов (против 6 в предыдущий год) без увеличения объема базисной терапии. Кроме этого было отмечено уменьшение числа рецидивов герпетической инфекции (Herpes labialis в среднем у всех пациентов с 14 до 2 эпизодов за год) [22].
 Клиническая эффективность лечения препаратом Рузам в данном исследовании была подтверждена результатами иммунологического обследования, которое проводилось перед первым курсом Рузама, по завершении курса, через месяц и через 2 месяца после первого курса. Были выявлены следующие изменения в иммунном статусе пациентов: существенно снизился уровень общего IgE и уровень IgG-содержащих циркулирующих иммунных комплексов спустя месяц после завершения курса. Количество Т-хелперов (CD4) достоверно повысилось спустя месяц после курса, а в последующем их концентрация возвращалась к исходной величине. Субпопуляция NK-клеток (CD3-CD16-CD56+), напротив, достоверно повысилась спустя месяц после курса лечения, однако в дальнейшем также возвратилась к исходным показателям. Процентное число наивных клеток Т-хелперов (CD4+CD45RA+) достоверно снизилось к моменту завершения курса лечения, оставаясь сниженным на протяжении последующего месяца. Иммунорегуляторный индекс III порядка – соотношение наивных и премированных Т-лимфоцитов (CD4+CD45RA+/CD4+CD45RO+) – достоверно снизился спустя 2 месяца после курса лечения.
Клиническая эффективность лечения препаратом Рузам в данном исследовании была подтверждена результатами иммунологического обследования, которое проводилось перед первым курсом Рузама, по завершении курса, через месяц и через 2 месяца после первого курса. Были выявлены следующие изменения в иммунном статусе пациентов: существенно снизился уровень общего IgE и уровень IgG-содержащих циркулирующих иммунных комплексов спустя месяц после завершения курса. Количество Т-хелперов (CD4) достоверно повысилось спустя месяц после курса, а в последующем их концентрация возвращалась к исходной величине. Субпопуляция NK-клеток (CD3-CD16-CD56+), напротив, достоверно повысилась спустя месяц после курса лечения, однако в дальнейшем также возвратилась к исходным показателям. Процентное число наивных клеток Т-хелперов (CD4+CD45RA+) достоверно снизилось к моменту завершения курса лечения, оставаясь сниженным на протяжении последующего месяца. Иммунорегуляторный индекс III порядка – соотношение наивных и премированных Т-лимфоцитов (CD4+CD45RA+/CD4+CD45RO+) – достоверно снизился спустя 2 месяца после курса лечения.
Все эти изменения свидетельствуют о повышении эффективности противоинфекционной защиты иммунной системы больных, получивших два курса терапии Рузамом, а также о противовоспалительном и антиаллергическом действиях Рузама. Вместе с тем отмеченные изменения в иммунограмме говорят о следующем: спустя 2 месяца после первого курса Рузама требуется повторный курс в прежней суммарной дозе для достижения стабильного клинического эффекта [22].
Примечательно, что все пациенты отметили хорошую переносимость Рузама. Из побочных эффектов зарегистрированы местные реакции в виде гиперемии без зуда и отека в месте инъекций у 8 пациентов, 6 пациентов отметили общее легкое недомогание в течение суток после инъекции без повышения температуры. Эти побочные эффекты не потребовали дополнительного лечения [22]. В других клинических исследованиях инъекционной формы Рузама также отмечена его хорошая переносимость: среди побочных эффектов были выделены субфебрилитет (9,5 %), заложенность носа (7,4 %), болезненность и гиперемия в месте введения (5,3 %). Данные явления проходили самостоятельно и не требовали дополнительного медикаментозного лечения [18, 20, 21, 23].
Целью исследования Н.М Ненашевой и Д.В. Тереховой [4] стало изучение эффективности и безопасности (сразу и через 6 месяцев после окончания курса лечения) ингаляционной формы препарата Рузам (в настоящее время не зарегистрирована для широкого клинического применения) у 63 взрослых больных персистирующей атопической БА легкого и среднетяжелого течения в открытом рандомизированном плацебо-контролируемом клиническом исследовании. Все больные получали базисную терапию ИГКС в виде моно- или комбинированной терапии с ДДБА в соответствии с рекомендациями GINA.
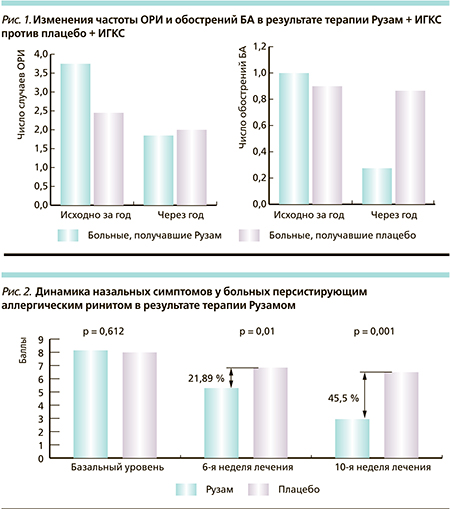
Для изучения влияния препарата Рузам на частоту ОРИ (вирусологическое исследование не проводилось) был оценен этот показатель за год до лечения и в течение года после. Как видно из рис. 1, у пациентов, получавших ингаляционную терапию Рузамом в комплексе с ИГКС, значимо снизилось число случаев ОРИ: до лечения – 3,9 (1,8) на одного пациента в год, в течение года после лечения – 1,96 (0,94); р = 0,00034). У тех же пациентов отмечено значимое повышение содержания ИФН-γ в индуцированной мокроте (до лечения – 55 [28,5÷84,5], после лечения – 268 [128÷385] пг/мл; р = 0,011). В группе больных, получавших плацебо, частота заболеваний ОРИ не изменилась: до лечения – 2,3 (1,7) в год, в течение года после лечения – 2,15 (1,19); р = 0,44) [4].
Как уже обсуждалось выше, ОРИ служат наиболее частой причиной обострений БА, поэтому снижение их частоты остается важным компонентом достижения стабильного контроля БА и предотвращения обострений. У пациентов, получавших Рузам + ИГКС, до лечения среднее число обострений БА в год на одного больного составляло 1,05 (0,35), через год после лечения – 0,29 (0,46); р = 0,000027: у 8 пациентов отмечены среднетяжелые обострения, у одного – тяжелое, потребовавшее стационарного лечения (рис. 1).
В группе плацебо + ИГКС частота обострений БА не изменилась – до лечения среднее их число на одного пациента составило 0,94 (0,48) в год, через год – 0,9 (0,46), р = 0,79: у 26 пациентов отмечены среднетяжелые обострения, у троих – тяжелые, потребовавшие стационарного лечения. Нами было установлено, что для пациентов, получавших терапию Рузамом, сокращается риск развития обострений БА в 23 раза (ОШ = 23, 95 % ДИ – 9,4–35,6) [4]. Комбинированная терапия Рузамом и ИГКС привела к значимому снижению числа эозинофилов и эозинофильного катионного протеина в индуцированной мокроте и, напротив, – к повышению уровня ИФН-γ, а также эффективно снизила уровень неинвазивных маркеров воспаления в дыхательных путях: оксида азота в выдыхаемом воздухе (NОex) и бронхиальной гиперреактивности [4].
Таким образом, применение препарата Рузам в комбинации с традиционной фармакотерапией больных БА приводит к уменьшению симптомов заболевания, потребности в бронхолитической терапии и к улучшению контроля БА. Важным наблюдением оказался пролонгированный эффект терапии Рузамом, проявленный уменьшением частоты ОРИ у пациентов и связанных с ними обострений БА, что, вероятно, обусловлено иммунорегуляторным и противовоспалительным эффектами Рузама.
Клиническая эффективность Рузама® при других АЗ
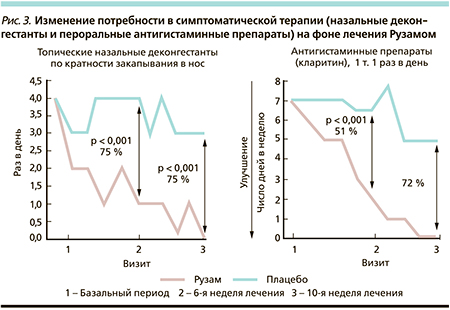
Самым распространенным АЗ остается аллергический ринит (АР), которым страдают от 12 до 24 % населения нашей страны [24]. Эффективность Рузама была изучена в сравнительном проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании противоаллергического действия препарата на клинические показатели и маркеры аллергического воспаления у 64 взрослых пациентов с персистирующим АР [25].
После включения в исследование и завершения 2-недельного вводного периода пациенты были рандомизированы в одну из двух параллельных групп: первая получала лечебный курс препаратом Рузам® по 0,2 мл подкожно в верхнюю треть плеча 1 раз в неделю; второй группе вводилось плацебо (0,9 % NaCI) в той же дозировке по аналогичной схеме. Общая продолжительность исследования составила 12 недель. Эффективность лечения оценивалась во время трех запланированных визитов: в начале рандомизации, на 6-й и 10-й неделях лечебного периода, и включала оценку клинических симптомов ринита (по дневникам самоконтроля), анализ потребности больного в дополнительной симптоматической терапии путем подсчета дней приема пероральных антигистаминных препаратов, измерения уровня NO в выдыхаемом воздухе (Logan Research), уровня эозинофилов в периферической крови, оценки клеточного состава мазков-отпечатков со слизистой оболочки носа и содержимого назального лаважа. Уровень IgE в сыворотке крови определен перед включением в исследование и по окончании лечебного периода (неделя 10). На рис. 2 и 3 представлена динамика симптомов АР и потребности в дополнительных препаратах (назальных деконгестантах и пероральных антигистаминных средствах) в результате терапии Рузамом. Как видно из рисунков, разница в положительной динамике симптомов ринита и потребности в дополнительных симптоматических препаратах при сравнении Рузама и плацебо была существенной и в пользу препарата Рузам. Исследователями и пациентами отмечено, что Рузам® оказывал влияние на все симптомы АР и лишь по показателям назальной обструкции не было отмечено достоверной разницы при сравнении с плацебо. Определение содержания IgE продемонстрировало исходно довольно высокий уровень у всех пациентов, включенных в исследование: 528,4 ME/ мл – в группе Рузама® и 552,1 – в группе плацебо (р = 0,38). Исследование IgE в конце лечебного периода выявило существенную разницу в показателях параллельных групп: уровень IgE в группе Рузама® снизился практически в 2 раза, в то время как в группе плацебо снижение уровня IgE практически отсутствовало, что еще раз свидетельствует об иммунорегуляторном влиянии Рузама на синтез IgE. Отмечено снижение числа эозинофилов и нейтрофилов в назальной лаважной жидкости и мазках-отпечатках со слизистой оболочки носа, полученных у пациентов, леченных Рузамом, при сравнении с больными, принимавшими плацебо.
Таким образом, в сравнительном плацебо-контролируемом исследовании показана клиническая эффективность препарата Рузам при персистирующем АР, проявленная в редукции всех симптомов заболевания и обусловленная его противовоспалительным, а также иммунорегуляторным действиями.
Заслуживают внимания исследования, касающиеся комбинированного применения Рузама с АСИТ [26]. Сочетание специфической и неспецифической иммунотерапии способствовало уменьшению порога чувствительности шоковых органов к аллергенам, снижало уровень IgE и эозинофильного катионного протеина в сыворотке крови.
Как известно, в реальной клинической практике при проведении АСИТ у пациентов с АР и поливалентной сенсибилизацией в 2 раза чаще, чем у пациентов с моновалентной сенсибилизацией, возникают местные и системные аллергические реакции на введение аллергена. Это влечет за собой снижение суммарной дозы аллергена за курс лечения и недостаточный эффект от АСИТ. В настоящее время Н.В. Новиковой, одним из авторов этой статьи, проводится исследование эффективности применения Рузама и АСИТ у такой группы больных (включены 42 взрослых пациента). Рузам применен в виде подкожных инъекций перед началом проведения АСИТ. АСИТ выполнена сублингвально или инъекционно (сразу после окончания курса Рузама) наиболее клинически значимым из всего спектра аллергеном, выявленным для данного пациента. Оценена переносимость и эффективность АСИТ. Эффект от лечения оценивали по опросникам выраженности симптомов и по количеству используемых лекарственных препаратов после первого года (курса) АСИТ. По предварительным данным, исследуемой группе пациентов удалось провести АСИТ без осложнений, была достигнута стандартная суммарная доза аллергена на курс лечения.
В результате у больных отмечено существенное уменьшение симптомов АР и двукратное снижение потребности в симптоматической терапии в сезон цветения. Причем было отмечено уменьшение проявлений АР при контакте со всеми другими клинически значимыми аллергенами, помимо тех, которым проводилась АСИТ.
В 2005 г. для клинических исследований была зарегистрирована новая форма препарата Рузам – капли назальные. Т.Н. Антонова провела сравнительную оценку эффективности препарата Рузам (капли назальные) с интраназальной специфической иммунотерапией аллергоидами и сочетанной терапии Рузамом (капли назальные) с интраназальной специфической иммунотерапией аллергоидами при лечении АР [5]. Исследование показало, что интраназальная терапия Рузамом по эффективности сопоставима с интраназальной специфической иммунотерапией аллергоидами. Во всех трех группах лечения произошла положительная динамика клинических симптомов, показателей гиперреактивности бронхов, интерлейкина-4, sIgA в назальном секрете, IgE в сыворотке крови [5].
Эти исследования и наблюдения позволяют говорить об эффективности и целесообразности применения курса терапии Рузамом в виде подкожных инъекций перед проведением курса АСИТ у пациентов с поливалентной клинически значимой сенсибилизацией. Предварительное лечение Рузамом будет способствовать снижению IgE, уменьшению выраженности ранней и поздней аллергической реакции, а стало быть, более безопасному и эффективному проведению АСИТ.
При оценке отдаленных результатов терапии Рузамом пациентов с БА, АР, атопическим дерматитом, крапивницей и ангиоотеками показано, что у подавляющего большинства больных течение АЗ протекало легче, отсутствовали повторные обострения, снижалась частота респираторных инфекций, при этом отмечено возрастание эффективности терапии после нескольких курсов лечения Рузамом [4, 17, 21–23].
Режим и схемы применения Рузама
Оптимальным режимом дозирования препарата служит 1 подкожная инъекция в неделю в дозе 0,2 мл для взрослых и детей старше 12 лет, на курс – 10 инъекций. Для детей 4–6 лет доза препарата снижается до 0,1 мл, а курс лечения может быть сокращен до 6–8 инъекций [27]. Нет опыта применения Рузама у детей младше 4 лет.
При сезонных проявлениях аллергии (поллинозах) курсы Рузама проводят предсезонно за 4–8 недель до периода поллинации с продолжением введения препарата в сезон цветения. При АЗ без сезонных обострений проводится не менее 2 курсов Рузама в год с интервалом 3–4 месяца. Минимальный интервал между инъекциями может составлять 5 дней, максимальный – 20 [27]. Терапию Рузамом возможно совмещать с фармакотерапией АЗ.
Начатая терапия Рузамом должна быть временно прекращена в следующих случаях:
- при возникновении ОРИ или обострении хронического заболевания до выздоровления или достижения периода ремиссии;
- во время обострения БА;
- при проведении вакцинации [27].
Заключение
Отечественный препарат Рузам®, являющийся иммунорегуляторным пептидом, обладает противовоспалительными и противоаллергическими свойствами, снижает уровень IgE в сыворотке крови больных различными АЗ и проявляет клиническую эффективность в комплексной терапии БА, АР, хронической крапивницы и ангиоотека, атопического дерматита. В результате лечения Рузамом снижается частота респираторных инфекций и связанных с ними обострений БА. Комбинированная неспецифическая иммунотерапия Руза-мом и АСИТ пациентов с поливалентной клинически значимой сенсибилизацией способствует более безопасному и эффективному проведению АСИТ.



