Введение
Препараты антиангиогенного действия получили широкое распространение в лекарственной терапии метастатического колоректального рака (мКРР). Из препаратов этой группы при данной нозологии в настоящее время применяются бевацизумаб – моноклональное антитело, связывающее VEGFA; рамуцирумаб – моноклональное антитело к экстрацеллюлярному домену VEGFR2; регорафениб – ингибитор тирозинкиназ VEGFR1-3, и афлиберцепт – рекомбинантный белок для нескольких ростовых факторов, связывающий VEGFА и В, а также PlGF. При этом молекула афлиберцепта обладает большей связующей способностью по сравнению с бевацизумабом в отношении VEGFA [1].
По результатам рандомизированного исследования VELOUR (2011) афлиберцепт зарегистрирован в комбинации с режимом FOLFIRI для терапии больных мКРР при прогрессировании болезни на фоне оксалиплатин-содержащей химиотерапии. Было показано, что добавление афлиберцепта к химиотерапии позволяет достоверно увеличить частоту объективного эффекта с 11,8 до 19,8%, время до прогрессирования заболевания – с 4,6 до 6,9 месяца и медиану общей выживаемости (ОВ) – с 12,0 до 13,5 месяца. [2]. При этом пациенты, получавшие бевацизумаб в первой линии лечения, также получали клиническое преимущество от назначения афлиберцепта в отношении продолжительности жизни.
К неблагоприятным прогностическим факторам в плане неэффективности терапии в исследовании VELOUR отнесены прогрессирование болезни в течение 6 месяцев с момента окончания адъювантной терапии, низкий функциональный статус пациента (ECOG 2), поражение метастазами ≥2 областей.
Данные реальной клинической практики не всегда согласуются с результатами регистрационных исследований. Это обусловлено тем, что данные тщательно отобранных когорт пациентов для рандомизированных исследований трудно экстраполировать на общую популяцию больных [3]. Так, в исследовани ASQoP (Италия) введение афлиберцепта прекращалось в связи с токсичностью значительно чаще, чем в исследовании VELOUR (27,5%), наблюдались кровотечения 1–2-й степеней (30,5%) [4]. В испанском исследовании была выше частота дисфонии и протеинурии, а также отмечена прямая взаимосвязь между развитием артериальной гипертензии (АГ) и уменьшением риска прогрессирования [5]. В другом европейском исследовании афлиберцепт продемонстрировал лучшую переносимость, частота регистрации объективного эффекта составила 33%, медиана выживаемости без прогрессирования (ВБП) составляла 6,9 месяца, медиана ОВ – 14,5 [6]. Возраст и предшествовавшая терапия моноклональными антителами не повлияли на эффективность изучаемой комбинации [7]. В небольшом исследовании из США, несмотря на то, что, как и в России, большинству больных афлиберцепт назначался не только во 2-й линии, но и на более поздних этапах лечения, медиана ВБП составила 8 месяцев, а частота нежелательных явлений была аналогичной данным VELOUR [8].
В 2019 г. опубликованы результаты многоцентрового ретроспективного исследования по оценке токсичности и эффективности терапии комбинацией FOLFIRI и афлиберцепта при мКРР в РФ. Частота объективных эффектов (20,3%), ВБП (6 месяцев) и частота отмены афлиберцепта в связи с токсическими реакциями при применении комбинации FOLFIRI+афлиберцепт во 2-й линии (12,1%) среди пациентов в РФ были аналогичными результатам исследования VELOUR. При этом авторы указывают: лекарственная терапия по поводу сопутствующей патологии и число линий терапии, предшествовавших афлиберцепту, служат независимым предиктивным фактором развития нежелательных явлений 3–4-й степеней негематологического профиля [3].
Цель исследования: клиническая оценка эффективности и безопасности применения афлиберцепта при мКРР.
Методы
Проанализированы данные 50 пациентов, получавших лечение афлиберцептом в сочетании с режимом FOLFIRI по поводу мКРР в нашем учреждении в 2018–2020 гг.
Критериями отбора для терапии афлиберцептом были: возраст пациентов ≥18 лет, функциональный статус по шкале ECOG <2, патоморфологическое подтверждение диагноза, наличие измеримых очагов опухоли по критериям RECIST, предшествовавшая противоопухолевая терапия, включившая оксалиплатин. Допускалась предшествовавшая терапия антиангиогенными препаратами, а также лучевая терапия. Обязательным условием было подписание информированного согласия на лечение.
Афлиберцепт вводили внутривенно капельно в дозе 4 мг/кг 1 раз в 14 дней в сочетании с режимом FOLFIRI.
Оценивались непосредственный противоопухолевый эффект (RECIST-критерии), время до прогрессирования заболевания, ОВ, нежелательные явления на фоне противоопухолевой терапии. Статистическая обработка полученных данных осуществлялась с помощью программ статистического пакета SPSS (IBM SPPS Statistics v. 20). Для оценки показателей динамической выживаемости использовали метод Kaplan‒Meier.
Результаты
В анализируемую группу вошли 50 пациентов в возрасте от 37 до 78 лет, средний возраст составил 56,5 года, 21 (42 %) мужчина и 29 (58 %) женщин.
В отношении 22 (44%) пациентов установлено прогрессирование заболевания после предшествовавшего радикального лечения, 28 (56%) имели исходно метастатический процесс. Время генерализации после радикальной операции составило от 6 месяцев до 5 лет, в среднем – 14,5 месяца.
Гистологически преобладала аденокарцинома G2 – 82% (41), аденокарцинома G3 составила 18% [9]. У 21 (42%) пациентов выявлены мутации RAS, 29 (58%) – имели дикий тип опухоли.
Распределение больных по локализации опухоли было следующим: слепая кишка – 6% [3], ободочная кишка – 20% [10], сигмовидная кишка – 30% [15], ректосигмоидный отдел – 10% [5], прямая кишка – 34% [17].
По локализации метастазов пациенты распределились следующим образом: изолированные метастазы в печень – 10% [5], изолированное поражение отдаленных лимфоузлов – 4% [2], сочетание метастазов в печень с метастазами в яичники – 4% [2], кости – 8% [4], поражение печени и легких пациентов – 38% [19], рецидив в малом тазу – 14% [7]. Тридцать два (64%) пациента имели ≥2 зон метастатического поражения.
Все больные ранее получали противоопухолевую терапию, включавшую оксалиплатин, либо по поводу метастатического рака, либо в адъювантном режиме после хирургического вмешательства. Большинство пациентов получили одну предшествовавшую линию химиотерапии до назначения афлиберцепта – 28 (56%), 16 (32%) – 2-й линии, 5 (10%) – 3-й и 1 (2%) больной – 5-й линий. Пациенты с диким типом RAS (31; 62%) в сочетании с химиотерапией получали блокаторы EGFR, 8 (16%) пациентов с наличием RAS-мутаций ранее получали бевацизумаб. С учетом спектра токсичности афлиберцепта также проанализировали имевшуюся у пациентов сопутствующую патологию. У 27 (54%) больных имела место АГ, контролируемая медикаментозно, у 18 из них помимо этого имелись в анамнезе другие заболевания сердечно-сосудистой системы: ишемическая болезнь сердца – 5 (10%), нарушения ритма сердца – 7 (14%), миокардиодистрофия – 5 (10%), инфаркт миокарда – 1 (2%), у 5 (10%) пациентов в анамнезе были язвы желудка и 12-перстной кишки, у 4 (8%) – нарушение мозгового кровообращения, у 7 (14%) – тромбоз периферических вен, у 5 (10%) – сахарный диабет.
Противоопухолевая терапия FOLFIRI+афлиберцепт проводилась до прогрессирования заболевания или непереносимой токсичности. Среднее количество курсов составило 4,8 (от 1 до 15).
Непосредственный противоопухолевый эффект лекарственной терапии мКРР с применением афлиберцепта удалось оценить у 48 из 50 пациентов. Данные оценки противоопухолевой эффективности в зависимости от линии терапии представлены в табл. 1.
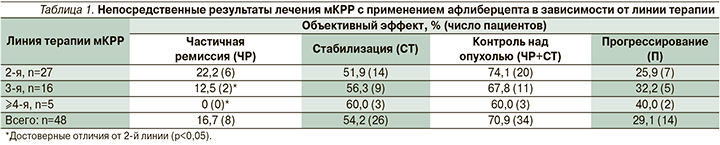
В результате проведения 2-й линии терапии с афлиберцептом объективный противоопухолевый эффект (ЧР) составил 22,2% (6), у 74,1% (20) больных был достигнут контроль над опухолью (ЧР+СТ). Для 3-й линии терапии данные показатели составили 12,5% [2] и 67,8% [11], для 4-й и последующих – 0 и 60% [3] соответственно. Различия в частоте регистрации частичной ремиссии были достоверными (р<0,05).
Данные о динамической выживаемости представлены на рис. 1, 2.
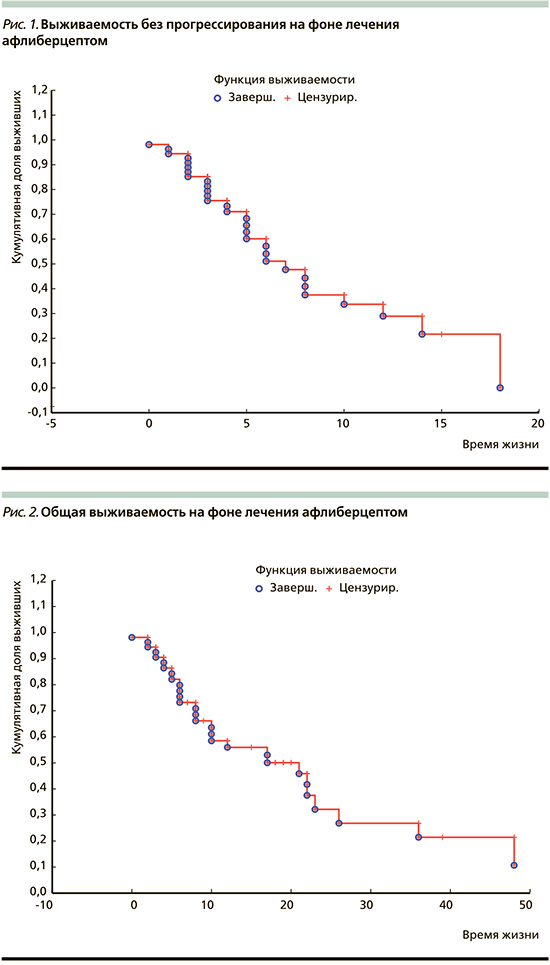
Медиана ВБП составила 6,3 месяца (от 2 до 18), что соответствует опубликованным данным. Медиана ОВ для проанализированной когорты пациентов составила 17,1 месяца (от 2 до 48), что превосходит показатели ОВ в регистрационном исследовании для общей группы пациентов.
Нежелательные явления любой степени зарегистрированы у 82% пациентов [41], и чаще они были ограничены 1–2-й степенями. Спектр зарегистрированных нежелательных явлений представлен в табл. 2.
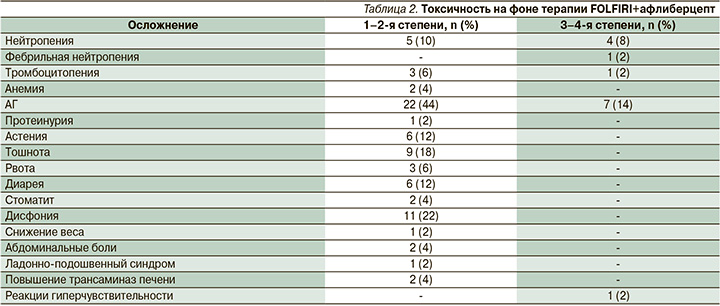
При этом негематологические осложнения развились у 75% (3–4-я степени – у 18%) больных. Наиболее частым осложнением оказалась АГ – 58% (3–4-я степени – 14%). Также обращает на себя внимание высокий процент развития дисфонии – 22%. Гематологические осложнения отмечены у 32% пациентов. Наиболее часто имела место нейтропения различной степени тяжести, при этом фебрильная нейтропения отмечена у 2% больных.
У 3 (6%) пациентов доза афлиберцепта была редуцирована, очередное введение афлиберцепта было отложено 7 (14%) больным; отсрочка и редукция доз химиопрепаратов цитостатиков отмечены в 22% случаев [11]. Основной причиной прекращения терапии стало прогрессирование болезни 50% [25], в 16% случаев [8] препарат был отменен из-за нежелательных явлений, причем в 14% [7] – из-за АГ 3–4-й степеней, в 2% (1) – после первого введения в связи с инфузионной реакцией на препарат.
Обсуждение
Результаты исследований, проводимых в реальной клинической практике в различных клиниках, посвященных оценке эффективности и токсичности противоопухолевых препаратов, нередко отличаются от данных крупных регистрационных исследований. Для афлиберцепта также отмечены некоторые различия между результатами регистрационного исследования и наблюдательными исследованиями в различных популяциях больных мКРР. В частности, в РФ отмечена меньшая частота диареи, тошноты, астении по сравнению с исследованием VELOUR. В нашем исследовании в отношении непосредственной эффективности и ВБР результаты при более раннем назначении афлиберцепта (во 2-й линии) согласуются с опубликованными ранее. Медиана ОВ в нашем анализе была выше, чем в регистрационном исследовании. Вероятно, это связано с характеристикой включаемых исследование пациентов, а именно – отсутствием у них таких неблагоприятных факторов прогноза, как прогрессирование болезни в течение 6 месяцев с момента окончания адъювантной терапии и низкий функциональный статус больных (ECOG-2). Однако нами было зарегистрировано более частое развитие АГ – осложнения, в связи с которым наиболее часто прекращалась терапия афлиберцептом. Авторы многоцентрового ретроспективного исследования, проведенного в РФ и опубликованного в 2019 г., указывают, что сопутствующая патология, требующая медикаментозной коррекции, и число линий терапии, предшествовавших афлиберцепту, по-видимому, служат фактором риска развития негематологических нежелательных явлений 3–4-й степеней [3]. Возможно, повышенная частота развития АГ в нашем исследовании обусловлена включением пациентов в группу лечения без учета факторов риска ее развития.
Заключение
В проведенном исследовании афлиберцепт продемонстрировал достаточно высокую клиническую эффективность при лечении мКРР, сравнимую с результатами многоцентровых международных и российских исследований в отношении объективного эффекта и ВБП. Медиана ОВ была выше, чем в регистрационном исследовании. Вместе с тем выявлена более высокая частота развития АГ. Полученные данные указывают на необходимость учета факторов риска развития нежелательных негематологических явлений, таких как АГ, при отборе пациентов для терапии афлиберцептом.
Вклад авторов
Концепция и дизайн исследования – Владимирова Л.Ю., Абрамова Н.А. Сбор и обработка материала – Абрамова Н.А., Попова И.Л., Тихановская Н.М., Рядинская Л.А., Льянова А.А., Сторожакова А.Э., Мягкова В.С., Теплякова М.А., Страхова Л.К. Кабанов С.Н., Калабанова Е.А., Саманева Н.Ю., Тишина А.В., Ежова М.О. Стати-стическая обработка данных – Новоселова К.А. Написание текста – Абрамова Н.А. Редактирование – Владимирова Л.Ю. Перевод – Теплякова М.А.
Источник финансирования. НИР согласно госзаданию.



