Введение
Рак толстой кишки (РТК) представляет собой гетерогенную группу злокачественных новообразований, занимает одну из лидирующих позиций в структуре онкологической заболеваемости и смертности во всем мире. Число больных местнораспространенным и диссеминированным РТК при первичной постановке диагноза составляет не менее 30%. Основным методом лечения данной категории пациентов служит проведение системной лекарственной терапии [1, 2]. При выборе тактики лечения необходимо учитывать не только клинические факторы, такие как распространение опухоли, функциональный статус пациента, сопутствующие заболевания, но и молекулярный профиль опухолевых клеток. РТК является классическим примером применения персонализированного подхода к выбору терапии. Одним из первых успехов персонализированного подхода к лечению РТК было определение эффективности терапии анти-EGFR антителами больных диким типом гена KRAS в опухоли.
До 2000-х гг. стандартом лечения метастатического колоректального рака (КРР) оставались режимы химиотерапии на основе комбинации фторпиримидинов и оксалиплатина и/или иринотекана. Ожидаемая медиана продолжительности жизни при этом составляла не более 20 месяцев [3]. За последние 15 лет возможности лекарственной терапии РТК значительно расширились за счет внедрения в клиническую практику таргетных препаратов – блокаторов ростовых факторов: рецепторов эпидермального фактора роста (EGFR) и ингибиторов ангиогенеза (VEGF).
В 2004 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило сразу два новых таргетных препарата: бевацизумаб (анти-VEGF антитело) и цетуксимаб (анти-EGFR антитело). Добавление данных препаратов к стандартным режимам химиотерапии позволило достоверно увеличить медиану общей выживаемости больных метастатическим РТК до 30 месяцев [4]. Панитумумаб – полностью гуманизированное анти-EGFR-моноклональное антитело последнего поколения. В отличие от цетуксимаба, панитумумаб обладает меньшей иммуногенностью, соответственно, меньшей частотой инфузионных реакций, не требует премедикации, что обусловлено различными структурами препаратов [5]. В настоящее время панитумумаб зарегистрирован для лечения метастатического РТК в качестве первой или второй линии терапии в комбинации с режимами FOLFOX или FOLFIRI, в монорежиме при прогрессировании заболевания на фоне химиотерапии с включением фторпиримидинов, оксалиплатина и иринотекана [6–8]. Препарат не рекомендуется использовать пациентам при наличии мутаций в генах RAS и BRAF либо их неизвестном мутационном статусе, а также при локализации опухолевого процесса в правых отделах толстой кишки [6–8].
Ниже мы представляем собственное клиническое наблюдение применения панитумумаба в комбинации с химиотерапией FOLFOX-6 пациенткой с диссеминированной формой рака сигмовидной кишки после прогрессирования на фоне трех линий системной лекарственной терапии.
Клинический случай
Пациентка Ч. 71 года. Из анамнеза известно, что в апреле 2016 г. при обследовании выявлена опухоль сигмовидной кишки с метастазами в печени. В мае 2016 г. больной выполнено оперативное вмешательство в объеме резекции сигмовидной кишки. По данным гистологического исследования операционного материала: высокодифференцированная аденокарцинома толстой кишки с поражением регионарных лимфатических узлов, (p)T3N1. Далее с июня 2016 по январь 2017 г. проведено 12 циклов первой линии химиотерапии по схеме FOLFOX-6+бевацизумаб с максимальным эффектом лечения в виде частичного регресса. В апреле 2017 г. больной выполнено 2 сеанса химиоэмболизации резидуальных метастатических очагов печени. В августе 2017 г., по данным контрольного обследования, выявлено прогрессирование заболевания в виде увеличения размеров и количества метастазов в печени. Выполненное молекулярно-генетическое исследование мутаций в генах RAS, BRAF, MSI не обнаружило, экспрессия PD-L1 отрицательная (0).
В рамках 2-й линии проведено 6 циклов химиотерапии по схеме FOLFIRI+бевацизумаб, далее поддерживающая терапия капецитабином в метрономном режиме в сочетании с бевацизумабом. В апреле 2018 г., по данным магнитно-резонансной томографии (МРТ) брюшной полости, отмечено незначительное увеличение размеров очагов в печени, новых образований не выявлено. Учтя тенденцию к росту метастазов, пациентку перевели на лечебный режим терапии капецитабином в сочетании с бевацизумабом.
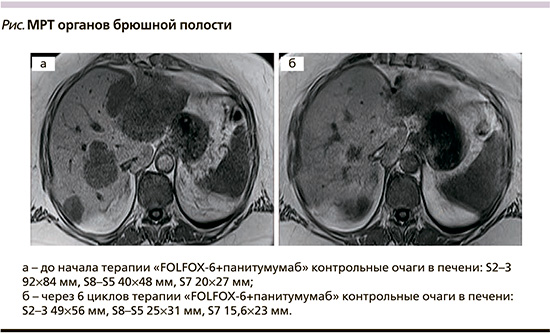
При очередном контрольном обследовании в декабре 2018 г. отмечено увеличение размеров и количества ранее выявленных образований в печени (см. рисунок). Приняв во внимание результаты инструментального исследования, была рекомендована реиндукция режима FOLFOX-6 с добавлением ингибиторов EGFR. С декабря 2018 по август 2019 г. проведено 12 циклов 4-й линии химиотерапии по схеме FOLFOX-6+панитумумаб. Осложнения терапии были ожидаемыми и легкокупируемыми: лечение сопровождалось развитием кожной токсичности 2–3-й степеней, что потребовало временной приостановки противоопухолевого лечения и проведения симптоматической терапии, на фоне которой проявления кожной токсичности значительно уменьшились. Максимальный эффект лечения, по данным МРТ брюшной полости, оценен как частичный регресс (см. рисунок). После 12-го цикла терапии (9 месяцев лечения) зарегистрировано прогрессирование заболевания, больная была переведена на 5-ю линию противоопухолевого лечения регорафенибом.
Обсуждение
Метастатический РТК – одно из трудноизлечимых заболеваний, для которого комбинация цитостатических агентов и таргетных препаратов является наиболее рациональным подходом к лечению. Известно, что критическую роль в патогенезе опухолей толстой кишки играет EGFR-сигнальный каскад, в то время как гиперэкспрессия EGFR наблюдается в 25–80% случаев карцином данной локализации и всегда ассоциируется с неблагоприятным прогнозом [9].
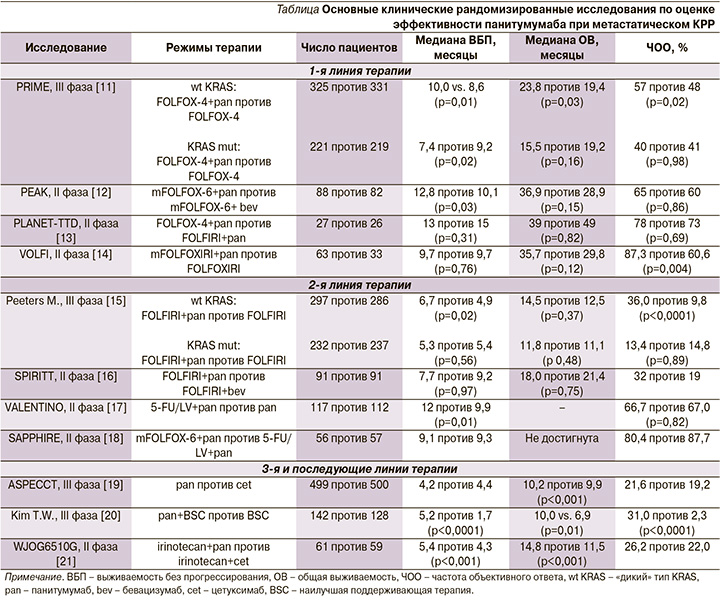
В злокачественных клетках активация EGFR приводит к связыванию его внеклеточного домена и лигандов, что вызывает димеризацию рецептора с аутофосфорилированием ряда тирозинкиназ. В последующем сигналы каскадно передаются в ядро клетки, в т.ч. за счет инициации других сигнальных путей (RAS/RAF/MAPK и PI3K/AKT/mTOR). В результате запускаются клеточная пролиферация, дифференцировка, ангиогенез, метастазирование и ингибирование механизмов апоптоза [10]. Панитумумаб благодаря высокой аффинности к экстрацеллюлярному домену EGFR конкурентно препятствует связыванию рецептора с другими природными лигандами, тем самым блокируя дальнейший сигнальный путь. Эффективность панитумумаба подтверждена в ряде клинических исследований (см. таблицу).
Согласно отечественным и зарубежным рекомендациям, панитумумаб рекомендуется применять начиная с первой линии лекарственной терапии, преимущественно при первичной локализации опухоли в левых отделах толстой кишки, в отсутствие мутаций в генах RAS и BRAF [7, 8, 22]. Как правило, при третьей и последующих линиях лечения препарат применяется в монорежиме либо в сочетании с иринотеканом [6, 21]. Наше клиническое наблюдение демонстрирует эффективность применения панитумумаба в комбинации с режимом FOLFOX-6 в качестве четвертой линии терапии без выраженного изменения общего состояния пациентки, что позволило увеличить время до прогрессирования на 8 месяцев, общую выживаемость до 41+ месяцев. Таким образом, возможно рассматривать интенсивные режимы лечения с включением панитумумаба и полихимиотерапии при удовлетворительном соматическом статусе пациента как лечебную опцию при прогрессировании метастатического КРР не только при первых двух линиях терапии.
Заключение
Основываясь на результатах клинических исследований и собственном опыте, применение ингибиторов EGFR последнего поколения в сочетании с химиотерапией достоверно увеличивает частоту объективных ответов и демонстрирует улучшение показателей безрецидивной и общей выживаемости больных диссеминированной формой РТК. Однако до конца не определена категория пациентов, у которых вероятность ответа на предполагаемый вид противоопухолевой терапии окажется выше, чем в общей популяции.
Кроме того, необходимо продолжить оценку целесообразности одновременного назначения панитумумаба и других таргетных и иммунологических препаратов с целью улучшения результатов лечения.



