Диагностика острой пневмонии разработана, а критерии, позволяющие заподозрить и установить данный диагноз, четко сформулированы. Несмотря на это, приходится часто сталкиваться с диагностическими ошибками и нерациональной терапией, которые наблюдаются чаще в амбулаторной практике. Помимо диагностики пневмонии как таковой существенное влияние на результаты лечения оказывает своевременное определение ее этиологии: разделение внебольничной пневмонии на группы типичных (с абсолютным преобладанием пневмококковой этиологии) или атипичных (среди которых чаще встречается микоплазмоз, реже – респираторный хламидиоз).
Осенью 2012 г. (сентябрь–октябрь) в Москве наблюдалась вспышка острых респираторных инфекций с поражением нижних дыхательных путей, вызванных микоплазменной инфекцией. Характерные вспышки происходят с регулярной периодичностью в 3–5 лет. Вызванные микоплазмой бронхиты и пневомонии наблюдаются в осенние месяцы, когда вообще учащаются инфекции, в т.ч. вызванные Mycoplasma pneumoniae [1, 2].
Атипичные возбудители в этиологии поражения нижних дыхательных путей занимают достаточно важное место, особенно пневмоний у детей старше 4–6 лет. Так, в Нидерландах и Италии у детей с рентгенологически подтвержденной пневмонией с помощью полимеразной цепной реакции (ПЦР) M. pneumoniae была выявлена в 2,4 и 11,3% соответственно, чаще в возрасте после 4 лет, среди них 63% составляли школьники и подростки [3, 4].
В Финляндии M. pneumoniae была выявлена в 14% случаев у детей с пневмонией в возрасте до 5 лет и в 42% – у детей старшего возраста. В аналогичном исследовании в Техасе M. pneumoniae была выявлена в 14% случаев у детей до 5 лет и в 22% – у детей старшего возраста [5, 6]. Проспективное исследование пневмоний у детей в Японии выявило M. pneumoniae у 41% больных, чаще старше 4 лет [7].
Приведенные данные показывают, что атипичные возбудители, в первую очередь микоплазма, занимают существенное место среди возбудителей пневмонии, особенно у детей школьного возраста и подростков.
Инфекционное заболевание, вызываемое микоплазмами, протекает обычно по типу инфекции нижних дыхательных путей (бронхит или острая микоплазменная пневмония) с острым началом, длительной лихорадкой без токсикоза, упорным кашлем, обилием мелкопузырчатых, влажных, разлитых (одно- или двусторонних) хрипов с преобладанием на стороне поражения. Групповая вспышка пневмонии среди детей в замкнутом коллективе всегда должна натолкнуть врачей на мысль о возможности микоплазменной инфекции. Комплексная оценка физикальных и рентгенологических данных достаточно надежна для целенаправленного выбора адекватного антибактериального средства, а отсутствие эффекта от пенициллинотерапии может служить доказательством микоплазменной пневмонии.
К основным лабораторным методам диагностики микоплазменной инфекции относится иммуноферментный анализ (ИФА) для определения титров иммуноглобулинов М (IgM) и G к M. pneumoniae, ПЦР для выявления антигена возбудителя в материале.
Определение ДНК бактерий методом ПЦР – это наиболее чувствительный и точный метод выявления микоплазм. Однако по результатам проведенного исследования в Нидерландах, частота наличия М. pneumoniae, выявленная методом ПЦР у больных детей, существенно не отличалась от носительства у здоровых детей (21,2 и 16,2% соответственно) [8]. Таким образом, ввиду частого носительства M. pneumoniae у здоровых детей в течение длительного времени этот метод является малоспецифичным.
Диагностическое значение может иметь обнаружение антител класса IgM, однако антитела к микоплазме в течение 1-й недели от начала болезни появляются всего у 21% больных (на 2-й неделе – у 56%, на 3-й – у 100%) [9].
Нарастание антител IgM в титре 1:8 и более и/или появление антител IgG в титре 1:64 и более является достоверным, но ретроспективным анализом.
Таким образом, выявление маркеров микоплазменной инфекции у ребенка, не имеющего соответствующей клинико-рентгенологической картины пневмонии, не позволяет ставить этиологический диагноз (а тем более служить доказательством наличия пневмонии). Неправильная интерпретация может приводить к гипердиагностике микоплазменной инфекции и необоснованному назначению антибактериальной терапии, в то же время отрицательные данные исследований приводят к запоздалому установлению этиологии.
У больных, перенесших микоплазмоз в прошлом, определяются только антитела типа IgG. При наличии микоплазмоза концентрация специфических антител во второй сыворотке больше, чем в первой, но точные диагностические критерии не разработаны.
С учетом этих положений диагностика «атипичных» инфекций у детей требует прежде всего учета клинических данных, поскольку даже в случае обнаружения патогена в материале из верхних дыхательных путей его роль как возбудителя не определена [10].
Бронхиты, вызванные M. рneumoniae, чаще встречаются у детей школьного возраста. При этом часто диагностируются клинические признаки обструкции без признаков аллергии или бронхиальной астмы.
Пневмония, вызванная M. pneumoniae, чаще наблюдается у подростков. Для нее характерно острое начало с повышением температуры до 39°С и выше, что обычно сочетается с нетяжелым состоянием. Это часто ведет к позднему (на 9–12-й день) обращению к врачу. Характерны кашель, масса мелкопузырчатых хрипов, чаще асимметричных, покраснение конъюнктив при скудных катаральных симптомах, изменения на рентгенограмме в виде негомогенного инфильтрата. Число лейкоцитов может быть нормальным или слегка повышенным и умеренно повышенная СОЭ.
В диагностике микоплазменной пневмонии учет клинических признаков заболевания, отличающих их от типичных пневмонии, является залогом правильного выбора стартовой терапии.
Распространенный бронхит с крепитацией, обилием мелкопузырчатых хрипов, часто ассиметричных, характерен для пневмоний, вызванных M. pneumoniae (атипичных), и имеет диагностическое значение.
Нередко на основании клинико-рентгенологических изменений не удается точно определить этиологию пневмонии. В этих случаях только отсутствие быстрого эффекта от применения β-лактамов (амоксициллина/клавуланата, цефалоспиринов) подтверждает диагноз атипичной пневмонии и служит показанием к смене терапии на макролид.
Целью исследования стало изучение клинического течения и особенностей серологической диагностики микоплазменной инфекции у детей.
Материал и методы
Исследование было проведено на базе отделения диагностики и восстановительного лечения ФГБНУ «Научный центр здоровья детей».
Клиническими критериями постановки диагноза внебольничной пневмонии служили наличие постоянной или упорно повторяющейся температуры тела от 38°С и выше без существенных нарушений общего состояния, скудные катаральные явления, конъюнктивит без выпота, обилие мелкопузырчатых хрипов или крепитация с двух сторон или чаще всего ассиметричных, наличие тени на рентгенограмме – обычно негомогенной с размытыми границами, часто двусторонней, отсутствие воспалительных изменений в общем анализе крови.

Бронхиты, вызванные микоплазмой, имели сходную картину с пневмонией той же этиологии. Рентгенография позволила исключить пневмонию – выявлялось лишь усиление мелких элементов легочного рисунка.
Мы предоставляем данные о 21 ребенке, поступившем во время подъема микоплазменной заболеваемости осенью 2012 г. Для верификации микоплазмоза проводилось серологическое исследование крови на антитела к микоплазме.
У 10 детей микоплазменная этиология была подтверждена лабораторно. По клинико-рентгенологическим данным у 7 детей был выставлен диагноз «бронхит», у 14 детей – «пневмония».
Микоплазменная инфекция в возрасте до 3 лет отмечалась у 2 детей, от 4–9 лет – у 8, с 9 до 17 лет – у 11 детей, что характерно для этой формы пневмонии.
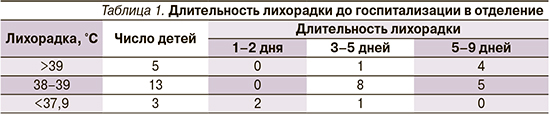
У 3 детей наблюдалось субфебрильное повышение температуры тела, у 13 детей фебрильная лихорадка (38–39°С), у 5 пациентов – 39°С и выше. Таким образом, преобладание больных с высокой лихорадкой типично для микоплазмоза (табл. 1).
Несмотря на то что у большинства детей была длительная лихорадка до поступления в стационар, симптомы интоксикации не были выражены, по крайне мере они волновали родителей меньше, чем лихорадка.
Для всех детей был характерен частый кашель, не вызывающий большого дискомфорта. У всех детей отмечено покраснение конъюнктив (без зуда в области глаз).
Клинических признаков бронхообструкции у наблюдаемых детей не было. Аускультативная картина зависела от сроков начала лечения.
У 5 детей с пневмонией, поступивших на 7–9-е сутки, хрипы не прослушивались, имело место ослабление дыхания в зоне пневмонического инфильтрата.
У двоих детей, поступивших в поздние сроки, прослушивались лишь проводные хрипы с двух сторон. Влажные мелкопузырчатые хрипы над зоной поражения определялись у 7 детей, поступивших до 7-го дня. У всех детей с бронхитом выслушивались мелкопузырчатые хрипы с двух сторон. Вне зависимости от сроков начала заболевания рассеянные хрипы, часто напоминающие крепитацию, выслушивались у 4 детей.
Число лейкоцитов до 15×109/л отмечено у 7 детей с бронхитом и у 10 – с пневмонией.
Повышение уровня С-реактивного белка (СРБ) в крови до 30 мг/л наблюдалось у 7 детей, от 30–60 мг/л – у 4, больше 60 мг/л – у 3 детей. Уровень прокальцитонина (ПКТ) не превышал 1 нг/мл у всех больных.
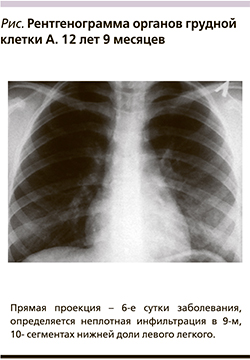 Рентгенологические изменения, позволившие ставить диагноз «пневмония», были выявлены у 14 детей.
Рентгенологические изменения, позволившие ставить диагноз «пневмония», были выявлены у 14 детей.
У 7 больных отмечено усиление легочного рисунка, не сопровождавшееся достаточно отчетливой инфильтрацией, что позволило поставить диагноз «бронхит». Из 14 детей с пневмоническими участками неплотные инфильтрации с видимым бронхососудистым рисунком на их фоне имели место у 8 детей, у 3 пациентов выявлены плотные альвеолярные инфильтраты.
Для определения этиологической роли атипичных возбудителей в развитии внебольничной пневмонии изучались частота выявления и уровень специфических антител изотипов IgM, IgA и IgG в динамике заболевания.
Из 7 детей, обследованных на 1-й неделе болезни, только у 2 выявлены специфические IgM-антитела к микоплазме. Из 2 больных с положительными IgM-антителами на 1-й неделе парную сыворотку мы взяли у одного ребенка. При этом антитела сохранялись на прежнем уровне. Из 5 пациентов без наличия антител на 1-й неделе заболевания парные сыворотки были исследованы у одного ребенка: отмечено появление IgM-антител на 2-й неделе болезни.
Из 14 пациентов, первично обследованных на 2-й неделе болезни, у 11 детей выявлялись IgM-антитела. Из этих 11 больных повторно обследованы 5 детей, у всех отмечено появление IgG-антител при сохранении IgM. Парные сыворотки были исследованы на 3 детях, не имевших антител на 2-й неделе болезни: у всех появились антитела класса IgM во второй сыворотке крови.
Таким образом, у 10 из 21 обследованного серологически больного при повторном тестировании была подтверждена микоплазменная этиология заболевания (на основании наличия IgM в отсутствие IgG на 1-й и 2-й неделях и появление IgG при сохранении IgM-класса антител).
У 7 детей, обследованных однократно, были выявлены IgM-антитела (из них у 2 пациентов при высокоположительных антителах класса IgM определялись IgG-антитела в низких титрах). Учитывая сроки обследования, мы можем предполагать у этих 7 больных микоплазменную этиологию болезни с достаточной степенью вероятности, особенно с учетом положительного ответа на лечение.
В группу также были включены 4 больных, обследованных на 1-й неделе заболевания с отрицательными серологическими результатами, которые не реагировали на β-лактамы, но быстро купировались на фоне терапии макролидами (табл. 2)
Дополнительным подтверждением микоплазменной этиологии пневмонии был быстрый эффект от назначенной терапии макролидами (снижение температуры, отмечалось улучшение самочувствия, появление аппетита).
Лечение в клинике проводилось джозамицином в дозе 40 мг/кг массы тела в сутки в течение 7 дней.
Антибактериальную терапию до поступления в стационар получали 16 из 21 ребенка, 13 детей в течение первых пяти дней заболевания получали антибиотики пенициллинового и цефалоспоринового рядов, 3 больных получали макролиды (2 ребенка – джозамицин, 1 – азитромицин) и 5 пациентов поступили в отделение без антибактериальной терапии. Лишь у 3 детей оказалось достаточным продолжение терапии макролидами в условиях стационара тем же препаратом, что и на догоспитальном этапе. Во всех остальных случаях потребовалась смена антибиотика на джозамицин.
У всех больных был отмечен положительный эффект от антибактериальной терапии: снижение температуры до нормальной или субфебрильной в течение первых суток от начала терапии. Кашель и хрипы в легких купировались в течение 4–5 дней.
Результаты исследования и обсуждение
Из 21 ребенка у 10 детей диагноз микоплазменной инфекции был подтвержден лабораторно с помощью ИФА. У 7 детей, обследованных однократно с выявленными IgM-антителами, диагноз был установлен с учетом сроков обследования, положительного ответа на лечение макролидами. Еще 4 больным диагноз верифицирован на основании типичной клинической картины заболевания, рентгенологических данных; в пользу микоплазменной инфекции говорило и отсутствие эффекта от применения β-лактамов.
Большинство детей с микоплазмозом (19 из 21) были старше 3 лет, что типично для этой инфекции. Преобладание больных с высокой лихорадкой характерно для микоплазменной пневмонии, как и наличие сухого конъюнктивита, который в нашем случае был диагностирован у всех больных. В большинстве случаев заболевание сопровождалось асимметричными влажными мелкопузырчатыми хрипами, иногда с крепитацией. У 5 пациентов с пневмонией, поступивших на 7–9-е сутки; хрипы не прослушивались, имело место ослабление дыхания в зоне пневмонического инфильтрата.
Рентгенологические изменения, позволившие установить диагноз «пневмония», были выявлены у 14 детей. У 7 больных отмечалось усиление легочного рисунка, не сопровождавшееся достаточно отчетливой инфильтрацией, что позволило поставить диагноз бронхит». Из 14 детей с пневмоническими участками неплотные инфильтрации с усилением бронхососудистого рисунка имели место у 8 детей (см. рисунок), а у 3 были выявлены плотные альвеолярные инфильтраты. Таким образом, для микоплазменной инфекции было характерно либо отсутствие инфильтрации, либо негомогенная неплотная инфильтрация, не закрывавшая собой бронхососудистый рисунок.
Общий анализ крови выявил низкий или умеренно повышенный уровень лейкоцитов: у всех больных он не превышал 15×109/л.
Лечение микоплазменной инфекции включило джозамицин в дозе 40 мг/кг/сут в течение 7–10 дней, а 2 детей –азитромицин в соответствующей дозировке. У всех больных был отмечен положительный эффект от антибактериальной терапии.
Таким образом, диагностика атипичных инфекций у детей требует учета клинических данных, несмотря на расширяющийся арсенал лабораторных методик.



