Введение
Хроническая болезнь почек (ХБП) у пациентов с сахарным диабетом (СД) – лидирующая причина терминальной почечной недостаточности (ТПН) во многих странах [1], которая определяет высокий риск сердечно-сосудистой патологии и смертности [2]. Патогенез ХБП, особенно в случае СД 2 типа (СД2), сложный, включает метаболические, гемодинамические, генетические факторы. Кроме того, ассоциированные с СД2 дислипидемия, ожирение, гиперурикемия, несомненно, вовлечены в механизмы почечного повреждения [3, 4]. Современные методы лечения, определяющие эволюцию осложнений, привели к различным фенотипам ХБП [5], не обеспечив достаточной ренопротекции пациентам с СД. Влияние на суррогатные конечные ренальные точки, такие как снижение альбуминурии и расчетной скорости клубочковой фильтрации (рСКФ), а также прогрессирование до ТПН, показали возможности современных сахароснижающих препаратов. И здесь важно обсудить недооцененный нефропротективный потенциал группы современных сахароснижающих препаратов – агонистов рецепторов глюкагоноподобного пептида 1 (арГПП-1).
У препаратов этой группы сложилась репутация средств эффективного управления гликемией (снижение уровня гликированного гемоглобина (HbA1c) на 1–2%) [6], основных составляющих метаболического синдрома (масса тела, систолическое артериальное давление [АД], липидный спектр) [7, 8]. На основании результатов рандомизированных клинических исследований сердечно-сосудистой безопасности аналогов человеческого ГПП-1 длительного действия со значимым снижением риска первичной 3-компонентной конечной точки (МАСЕ) (кардиоваскулярная смерть, нефатальный инфаркт миокарда, нефатальный инсульт) [9] Американская диабетическая ассоциация (ADA) рекомендовала эти препараты как достойные выбора независимо от уровня HbA1c и применения метформина пациентам с СД2 с установленными атеросклеротическими сердечно-сосудистыми заболеваниями (АССЗ) и при высоком риске их развития [10].
Анализ исследований арГПП-1
Оценка микроваскулярных исходов у пациентов с СД2, получавших арГПП-1, была проведена в ряде мета-анализов [11–13]. Первый мета-анализ (60 исследований, 60 077 пациентов) не определил увеличения риска развития диабетической ретинопатии, макулярного отека, отслойки и кровоизлияния сетчатки, снижение рСКФ, но показал умеренную редукцию альбуминурии по сравнению с плацебо или другими сахароснижающими агентами. Второй (51 исследование) выявил снижение частоты развития нефропатии (0,74; 95% доверительный интервал [ДИ]: 0,60–0,92; р=0,005) по сравнению с плацебо. Результаты третьего мета-анализа, включившего
7 рандомизированных исследований с участием 56 004 пациентов с СД2 определили значимое снижение МАСЕ (на 12%) (0,88; 95% ДИ: 0,82–0,94; р<0,001) с убедительными данными не случайного, а фиксированного эффекта для препаратов группы арГПП-1. Риск достижения комбинированной ренальной конечной точки (развитие макроальбуминурии, снижение рСКФ, прогрессирование до ТПН, ренальная смерть) по данным этого анализа в случае терапии арГПП-1 был на 17% ниже (0,83; 95% ДИ: 0,78–0,89; р<0,001) – преимущественно за счет альбуминурического компонента.
Последний мета-анализ, включавший 8 исследований (69 080 пациентов), наряду с анализом сердечно-сосудистых исходов, провел оценку комбинированного конечного исхода (развитие макроальбуминурии, удвоение креатинина, снижение рСКФ на 40% и более, инициация заместительной почечной терапии, ренальная смерть) и снижения почечной функции по динамике рСКФ. Риск достижения комбинированной ренальной точки на фоне терапии арГПП-1 был на 21% ниже ((0,79; 95% ДИ: 0,73–0,87; р<0,0001) без повышения риска развития серьезной гипогликемии, ретинопатии или панкреатических побочных эффектов по данным 6 из 8 исследований. Более того, по данным дополнительного чувствительного анализа (с исключением исследования ELIXA по причине различия популяции пациентов от других исследований) было показано и преимущество по снижению риска почечной функции с учетом динамики рСКФ на 18% (0,82; 95% ДИ: 0.69–0,98); р=0,03) [14].
Возможные ренальные эффекты арГПП-1 (прямые и непрямые) представлены в таблице.

Натрийуретический и диуретический эффекты (прямые) при введении ГПП-1 показаны у здоровых лиц, пациентов с СД2, при ожирении с инсулинорезистентностью [16,17, 18]. Подобное воздействие (как у нативного ГПП-1) определено при инфузии арГПП-1 у здоровых лиц и у пациентов с СД2 [19, 20]. Даже однократная подкожная инъекция арГПП-1 (лираглутида) повышает экскрецию натрия [21]. В эксперименте показана стимулирующая роль предсердного натрийуретического пептида (ANP) в реализации натрийуретического и гипотензивного эффектов ГПП-1 [22]. Ограничением этих исследований был короткий период проведения. Ускользание натрийуретического эффекта по вероятной причине десенсибилизации рецептора ГПП-1 характерна для регулирующихся систем [23]. Другие возможные причины – прерывистая стимуляция рецептора ГПП-1 и реакция контррегуляции, предотвращающая потерю натрия почками. При этом данные о представительстве рецепторов ГПП-1 в почках весьма противоречивы: имеются исследования, подтверждающие их присутствие в афферентной артериоле и в юкстагломерулярном аппарате [24], но не определены антитела для картирования рецептора ГПП-1 в почках с достаточной чувствительностью и специфичностью [25].
Следует отметить схожесть механизмов натрийуретического воздействия арГПП-1 и ингибиторов натрий-глюкозного контранспортера-2 (НГЛТ2), связанного с ингибированием путем фосфорилирования натрий-водородного антипортера NHE3, локализованного в проксимальных канальцах [26, 27]. Свидетельство участия NHЕ3 в этом процессе независимо от гликемического статуса – изменение почечного клиренса лития – маркера проксимальной тубулярной реабсорбции натрия и рН мочи [16, 17, 21]. К этому следует добавить, что инсулин, глюкагон, аденозинтрифосфат, модулируя регуляцию NHЕ3 глюкозой, а также натрий-глюкозные транспортеры в почках, влияя на ренин-ангиотензин-альдостероновую системы (РААС), могут опосредованно контролировать натрийурез. Изменение клубочковой гемодинамики под влиянием канальцевых эффектов арГПП-1 (как и в случае ингибиторов НГЛТ2) ведет к блокированию реабсорбции натрия в проксимальных канальцах с увеличением его доставки в macula densa, активации канальцево-клубочковой обратной связи, вазоконстрикции афферентной артериолы и снижению внутриклубочкового давления. Однако реализации этого классического пути в полной мере в случае арГПП-1 препятствует прямое сосудорасширяющее действие ГПП-1 на афферентную артериолу с компенсацией ее вазоконстрикции, что в целом определяет нейтральное действие на рСКФ [28]. Уменьшение содержания макронутриентов в гломерулярном фильтрате при физиологическом действии ГПП-1 на почки может снижать прандиальное внутруклубочковое давление, что ведет к уменьшению энергозатрат на транспортировку макронутриентов через проксимальные канальцы, контролируемое снижением симпатической активности в клубочках под воздействием центральной нервной системы или прямыми эффектами на мезангиум и почечный интерстиций [29]. Рис. 1 демонстрирует эффекты арГПП-1 на уровне почек [30].
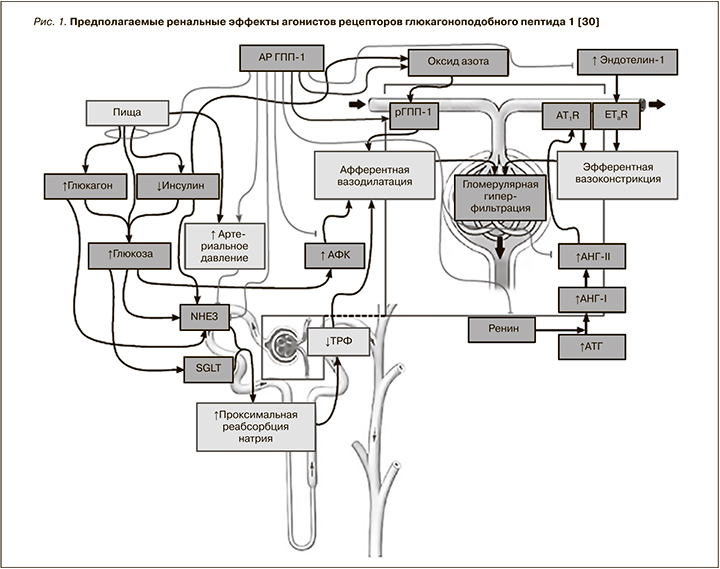
У здоровых лиц острая инфузия ГПП-1 не влияла на рСКФ и эффективный почечный кровоток [16, 18], а у здоровых лиц с ожирением инфузия эксенатида повышала эти показатели [19]. Вероятно, в последнем случае имело место снижение резистентности афферентной артериолы, частично зависимой от уровня оксида азота. У лиц с СД2 острое введение эксенатида [20] или лираглутида [21] не влияло на показатели почечной гемодинамики даже в случае очевидной гиперфильтрации отдельных нефронов, хотя данные по лечению лираглутидом пациентов с СД2 в открытых исследованиях предполагали снижение рСКФ [31, 32]. Это подтвердилось и в рандомизированных клинических исследованиях лираглутида, эксенатида, дулаглутида для пациентов с наличием или отсутствием почечной патологии [33–35]. Лечение лираглутидом лиц с альбуминурией в течение 12 недель по сравнению с плацебо не продемонстрировало существенного влияния на рСКФ [36], как и 8-недельное лечение ликсисенатидом по сравнению с инсулином глулизином [37].
Каким же образом арГПП-1 снижают альбуминурию у пациентов с СД2, несмотря на нейтральное влияние на показатели почечной гемодинамики? Предположительно это происходит путем подавления процессов воспаления, продукции фиброгенных цитокинов, оксидативного стресса, инфильтрации макрофагами, аккумуляции коллагена IV типа в почке [38]. Активация ГПП-1 ведет к стимуляции циклической аденозинмонофосфат-зависимой протеинкиназы А (цАМФ-ПКА), обладающей антиоксидантными свойствами и тем самым способной предотвращать повреждения почечных структур [39]. Лираглутид подавлял окислительный стресс за счет увеличения уровня цАМФ и активности ПКА, а также снижения активности мультикомпонентного ферментного комплекса НАДФH-оксидазы в исследовании мышей, нокаутированных по гену Glp1r, с увеличенной продукцией супероксида в клубочках [24]. Важно, что ГПП-1 может непосредственно оказывать антиоксидантное и противовоспалительное действия на диабетическую почку без существенных изменений секреции и инсулина или толерантности к глюкозе. Это подтверждено у крыс со стрептозотоцин-индуцированным диабетом (модель СД 1 типа). У них арГПП-1 снижал альбуминурию без снижения уровня гликемии [40, 41]. Индуцированная ГПП-1 активация цАМФ у животных моделей может приводить к снижению экспрессии рецептора конечных продуктов гликирования [42], с которыми связывают альбуминурический эффект гипергликемии наряду с активацией NF-kB, повышением синтеза провоспалительных и фиброгенных факторов, подоцитопатией [43]. Животная модель помогла оценить роль арГПП-1 в смягчении ишемических повреждений в почке, подавляя экспрессию апоптического фактора (каспаза-3), предотвращая продукцию активных форм кислорода путем индукции гена окислительной защиты гемоксиназы-1/ферритин (НО-1/Ft) [44].
Весьма заманчива перспектива терапии арГПП-1 почечной патологии, связанной с ожирением, в основе которой лежат гиперпродукция провоспалительных и фиброгенных цитокинов, дисбаланс адипокинов, оксидативный стресс, нарушение регуляции экспрессии нефрина подоцитами, приводящее к развитию альбуминурии. А именно, арГПП-1 (лираглутид) в экспериментальной работе у крыс на диете, богатой жирами, восстанавливал функцию митохондрий в почках, противодействуя снижению биогенеза генов, кодирующих белки митохондриального дыхания, предотвращал депозицию липидов в почках, контролируя липогенные и липолитические факторы [45].
Еще один потенциальный механизм нефропротекции при ХБП показан в экспериментальных исследованиях ГПП-1 и арГПП-1 – снижение уровня ангиотезина II – маркера активации РААС, в нефронах [46]. К сожалению, пока нет убедительных данных для подтверждения эффектов острого или длительного лечения арГПП-1 на циркулирующие компоненты РААС.
Данные по связи состава кишечного микробиома с заболеванием почек [47] находят подтверждение в некоторых исследованиях с модулированием микробиома у мышей под влиянием арГПП-1 как результат изменения пищевого поведения после начала терапии [48].
Такой многогранный ренопротективный потенциал арГПП-1, несомненно, способен изменить лечебную и профилактическую тактику при ХБП у лиц с СД2. Результаты исследований по оценке сердечно-сосудистой безопасности препаратов пролонгированного действия этой группы позволяют им занять достойное место в отечественных и международных рекомендациях по лечению пациентов с СД2 и ХБП [49, 50].
Первое в этом ряду исследование ELIXA (длительность – 108 недель) показало, что арГПП-1 короткого действия ликсисенатид по сравнению с плацебо способен снижать риск развития макроальбуминурии у пациентов с СД2 после перенесенного острого коронарного синдрома (n=6026). Показатель не изменился после коррекции по возрасту, АД, рСКФ, динамике HbA1c, массы тела. Другой показатель почечной функции – рСКФ, остался стабильным в группе лечения (общей группе и с макроальбуминурией). Не представилось возможным исследовать твердые конечные почечные точки из-за малочисленности группы пациентов с рСКФ менее 60 мл/мин/1,73 м2 [51].
Более продолжительное исследование LEADER уже смогло зафиксировать значимое снижение на 22% (отношение шансов [ОШ]=0,78, 95% ДИ: 0,67–0,92; р=0,003) конечной комбинированной почечной точки (развитие макроальбуминурии, удвоение содержания креатинина, инициация заместительной почечной терапии или почечная смерть) у пациентов с СД2 и по преимуществу с АССЗ через 3,8 года лечения лираглутидом по сравнению с плацебо в основном за счет снижения риска развития макроальбуминурии (на 26%) [52]. В этом исследовании полученный эффект также оставался неизменным после корректировки по HbA1c, АД и массе тела. Заслуживает особого внимания сообщение о более медленном снижении рСКФ в группе лечения по сравнению с группой плацебо с наибольшим преимуществом для пациентов с умеренным или значимым снижением почечной функции исходно (рСКФ – 30–59 мл/мин/1,73 м2 и рСКФ<30 мл/мин/1,73 м2).
Твердая конечная комбинированная ренальная точка (без альбуминурии), как и рСКФ, не различалась в группах лечения и плацебо в близких к предыдущему исследованию популяциях пациентов (73% из 14 752 имели АССЗ) в исследовании EXSCEL для изучения эффектов эксенатида [53]. По результатам исследования HARMONY альбиглутид также не показал значимой динамики рСКФ у пациентов с СД2 и АССЗ через 16 месяцев лечения [54].
Наиболее позднее исследование REWIND оценивало эффекты арГПП-1 дулаглутида (1,5 мг подкожно 1 раз в неделю) по сравнению с плацебо в развитии наряду с МАСЕ вторичной конечной комбинированной почечной точки (развитие макроальбуминурии – соотношение альбумин/креатинин мочи >33,9 мг/ммоль, снижение рСКФ более чем на 30% на основании двух измерений, инициация заместительной почечной терапии) при подключении к терапии пациентов с СД2 с установленными АССЗ (31,5%) или кардиоваскулярными факторами риска (68,5%). Этот показатель значимо реже регистрировался в группе пациентов, получавших дулаглутид, чем в группе пациентов, получавших плацебо (ОШ=0,86, 95% ДИ: 0,77–0,93; р=0,0004) [55].
Исследование SUSTAIN-6 определило возможности конт-роля МАСЕ арГПП-1 длительного действия инъекционного семаглутида у пациентов с СД2 (3297, из них 83% имели установленные АССЗ, ХБП 3-й стадии и выше или то и другое вместе) на фоне стандартной терапии по сравнению с плацебо (медиана наблюдения – 2,1 года). Участники исследования двойным слепым методом были рандомизированы в группы 1:1:1:1, получавшие 0,5 или 1,0 мг инъекционного семаглутида подкожно 1 раз в неделю по сравнению с плацебо. Эскалация дозы инъекционного семаглутида начиная с 0,25 мг происходила 1 раз в 4 недели. Большинство (93,5%) пациентов получали антигипертензивную терапию, включая ингибиторы ангиотензин-превращающего фермента (49,8%) и блокаторы рецепторов ангиотензина II (33,7%), липидснижающую (76,5%), антитрормботическую терапию (76,3%). Первичная конечная точка (кардиоваскулярная смерть, нефатальный инфаркт миокарда, включая безболевой, нефатальный инсульт) была зафиксирована у 6,6% участников группы лечения и у 8,9% участников группы плацебо (ОШ=0,74, 95% ДИ: 0,58–0,95; р=0,02), что позволяет рассматривать инъекционный семаглутид в качестве эффективного препарата для успешного контроля значимых кардиоваскулярных исходов у пациентов средней и старшей возрастных групп с СД2 [56].
Среди вторичных конечных точек было продемонстрировано значимое снижение ренальных исходов (развитие макроальбуминурии, удвоение уровня креатинина и его клиренс по MDRD [Modification of Diet in Renal Disease] <45 мл/мин/1,73 м2, инициация заместительной почечной терапии в отсутствие острого почечного повреждения или ренальная смерть) в группах терапии инъекционным семаглутидом по сравнению с плацебо (3,8 и 6,1% соответственно; ОШ=0,64, 95% ДИ: 0,46–0,88; р=0,005) (рис. 2).

Основную роль в полученном преимуществе для группы инъекционного семаглутида, как и в предыдущих исследованиях арГПП-1, сыграло снижение риска развития макроальбуминурии (ОШ=0,80, 95% ДИ: 0,72–0,90; р<0,001 для семаглутида 0,5 мг и ОШ=0,67, 95% ДИ: 0,60–0,76; р<0,001 для семаглутида 1,0 мг). Снижение уровня HbA1c, систолического АД и массы тела было более выраженным в группе инъекционного семаглутида, что, возможно частично, могло влиять на ренальные исходы и особенно на альбуминурический компонент, согласно имеющимся литературным данным [57, 58].
Ретроспективный анализ имел целью изучить влияние инъекционного семаглутида на функцию почек в большой популяции пациентов с СД2 (n=8416), участвовавших в программе исследований SUSTAIN-1–7 [59]. Во всех исследованиях применялся режим эскалации дозы инъекционного семаглутида, начиная с 0,25 мг 1 раз в 4 недели до терапевтических доз 0,5 или 1,0 мг.
Длительность исследований простиралась от 30 до 104 недель. SUSTAIN-1, SUSTAIN-5 и SUSNAIN-6 были плацебо-контролируемыми, а SUSTAIN-2, SUSTAIN-3, SUSTAIN-4 и SUSTAIN-7 имели активные препараты сравнения (ситаглиптин, эксенатид пролонгированного высвобождения, инсулин гларгин и дулаглутид соответственно). Более широкий post-hoc-анализ оценил динамику рСКФ и соотношения альбумин/креатинин мочи в ходе испытаний (последний показатель не измерялся в исследовании SUSTAIN-7). Исходный уровень рСКФ, определенный как критерий включения, варьировал от не менее 60 мл/мин/1,73 м2 в исследованиях SUSTAIN-2, SUSTAIN-3 и SUSTAIN-7 до не менее 30 мл/мин/1,73 м2 в SUSTAIN-1, SUSTAIN-4 и SUSTAIN-5. А в исследовании SUSTAIN-6 критерием исключения была диализная терапия.
В исследованиях SUSTAIN-1–6 для оценки рСКФ применялась формула MDRD, в последующем для данного мета-анализа использована более точная формула CKD-EPI (Chronic Kidney Desease Epidemiology Collaboration), как и в исследовании SUSTAIN-7. Альбуминурия оценивалась по соотношению альбумин/креатинин в утренней порции мочи. В каждом исследовании было достаточное представительство пациентов с патологической альбуминурией (от 23,5% в SUSTAIN-1 до 47% в SUSTAIN-6).
В SUSTAIN-1–5 и SUSTAIN-7 отмечено начальное снижение рСКФ у пациентов на инъекционном семаглутиде примерно до 12 недель с последующей стабилизацией к 30-й неделе.
В исследовании SUSTAIN-6 также было аналогичное снижение рСКФ при приеме инъекционного семаглутида, но с 16-й по 104-ю неделю этот показатель оказался менее выраженным у пациентов, получавших обе дозы инъекционного семаглутида, по сравнению с группой плацебо. Снижение такого рода характерно для периода инициации нефропротективной терапии (ингибиторы РААС, ингибиторы НГЛТ2). Начальная динамика рСКФ оказалась зависимой от ее базового уровня и была менее выраженной у пациентов с умеренной и значимо сниженной почечной функцией по сравнению с лицами с нормальной и незначительно сниженной почечной функцией.
В исследованиях SUSTAIN-1–6 снижение альбуминурии было значимо у пациентов на инъекционном семаглутиде с преимущественным эффектом для пациентов с микро- и макроальбуминурией. Это преимущество ассоциировалось с улучшением ренального исхода, прежде всего – снижением риска ТПН (рис. 3).
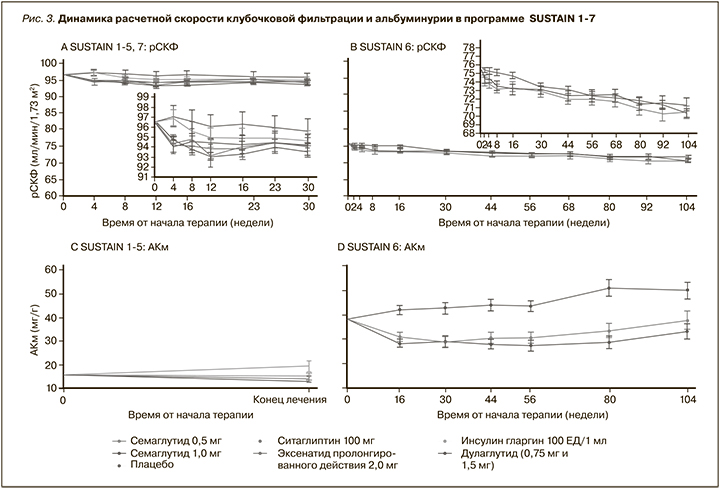
Динамика альбуминурии и ее мониторирование очень важны для пациентов с СД2, поскольку позволяет прогнозировать смертность, сердечно-сосудистые и почечные исходы. Следует особо отметить, что была подтверждена ренальная безопасность инъекционного семаглутида по сравнению с компараторами. Таким образом, ретроспективный анализ семи исследований с инъекционным семаглутидом показал его безопасный ренальный профиль и потенциальные нефропротективные эффекты.
Полученные результаты позволили дополнить наши знания о ренальных эффектах арГПП-1. Подтверждена возможность терапии инъекционным семаглутидом для снижения риска прогрессирования почечной патологии и сохранения этого эффекта у пациентов с СД2, получавших нефропротективную терапию, с широким диапазоном базовой почечной функции, контроля гликемии и выраженности сердечно-сосудистой патологии. Многоцентровый дизайн, большая популяция пациентов, длительность наблюдения, несомненно, усиливают значимость полученных данных. Важно отметить, что результаты ренальных исходов выходят за рамки влияния инъекционного семаглутида на контроль гликемии, массы тела, АД и независимы от блокады РААС.
Заключение
И все же, несмотря на убедительные результаты исследований арГПП-1, следует с осторожностью делать однозначные выводы о ренальных преимуществах препаратов этой группы, поскольку они получены в рамках оценки их сердечно-сосудистой безопасности. Инициированное исследование FLOW, испытывающее действия инъекционного семаглутида у пациентов с СД2 и ХБП, призвано ответить на вопрос: могут ли быть арГПП-1 полезным инструментом для лечения почечной патологии? Первичная конечная точка в 5-летнем исследовании имеет определенный ренальный статус – снижение рСКФ на 50% и более, достижение ТПН, ренальная смерть или смерть от сердечно-сосудистых заболеваний.
Активное применение новых препаратов (по сути сахароснижающих) для профилактики и лечения ХБП у пациентов с СД2 с учетом высокого кардиоваскулярного риска нацелено на долгосрочную перспективу клинических преимуществ. Различающиеся пути ренопротекции могут дать комплементарный результат при их комбинации (прежде всего арГПП-1 с ингибиторами НГЛТ2). Исследуемые механизмы кардиоренальных влияний препаратов этих групп в будущем могут быть значимыми для всех пациентов независимо от гликемического статуса.



