Введение
Сахарный диабет 2 типа (СД2) является острой медико-социальной проблемой современности и относится к приоритетным направлениям для национальных систем здравоохранения практически всех стран мира. Быстрорастущая распространенность позволила экспертам Всемирной организации здравоохранения (ВОЗ) определить данное заболевание как эпидемию, развивающуюся среди взрослого населения [1].
В настоящее время известно, что в основе патогенеза СД2 лежит синдром инсулинорезистентности (ИР), также сопутствующий ряду других метаболических заболеваний, одним из которых является подагра. Сведения о частом сочетании подагры с нарушениями углеводного обмена появились довольно давно. В последние десятилетия отмечается непрерывный рост заболеваемости подагрой, что можно объяснить влиянием метаболических нарушений на пуриновый обмен [2].
Цель исследования: оценить взаимосвязь адипокинов и гормонально метаболических показателей у больных СД2 и подагрой.
Материал и методы
Были обследованы 43 мужчины в возрасте от 43 до 70 лет. В первую группу вошли 25 пациентов с подагрой, средний возраст которых составил 59,52±1,27 года, индекс массы тела (ИМТ) – 32,31±0,88 кг/м2. Во вторую – 18 мужчин с СД2, средний возраст которых составил 57,83±1,67 года, ИМТ – 32,11±0,88 кг/м2.
Контролем служили результаты обследования 40 практически здоровых мужчин. В первую (младшую) контрольную группу вошли 20 мужчин со средним возрастом 21,03±0,15 года и ИМТ 23,14±0,35 кг/м2. Во вторую (старшую) контрольную группу – 20 человек, средний возраст которых составил 51,31±1,34 года, ИМТ – 25,96±0,47кг/м2.
Диагноз «сахарный диабет 2 типа» ставился на основании критериев ВОЗ (2013) [3]. Диагноз «подагра» ставился врачом-ревматологом на основании критериев, разработанных S. Wallace и соавт. (1977) [4] и утвержденных ВОЗ в 2000 г. Все больные СД2 на момент обследования находились на таблетированной сахароснижающей терапии. Определены антропометрические показатели всех пациентов: рост, масса тела, окружность талии (ОТ), окружность бедер (ОБ), соотношение ОТ/ОБ, ИМТ по формуле ИМТ=масса тела (кг)/рост (м)2. ИМТ, равный 25–29,9 кг/м2 расценивался как избыточная масса тела, 30–34,9 кг/м2 – ожирение I степени, 35–39,9 кг/м2 – ожирение II степени, 40 и более кг/м² – ожирение III степени. ОТ более 94 см, соотношение ОТ/ОБ более 0,95 у мужчин и отложение жира в области живота соответствовали висцеральному типу ожирения. Глютеофеморальный тип ожирения характеризовался преимущественным отложением жира на бедрах, ягодицах, области грудных желез, ОТ менее 94 см и соотношением ОТ/ОБ менее 0,95 для мужчин.
Всем пациентам произведен забор крови из локтевой вены утром натощак. Определение гликемии в плазме венозной крови проведено глюкозооксидазным методом на биохимическом анализаторе «Erba XL-200» (Erba Lachema, Чехия). Уровень иммунореактивного инсулина (ИРИ) исследован методом иммуноферментного анализа на аппарате «Architect i1000SR» (Abbot, Германия). ИР оценена по показателю HOMA-IR (Homeostatic model assessment), рассчитанному по формуле HOMA-IR=ИРИ×гликемия натощак/22,5.
Превышение этого показателя уровня 2,77 свидетельствовало о наличии ИР. Уровни адипонектина, лептина и резистина в сыворотке крови исследованы методом иммуноферментного анализа на аппарате «Expert Plus» (Asys, Австрия). Показатели липидного спектра крови (общий холестерин, холестерин липопротеидов низкой плотности – ЛПНП, триглицериды, холестерин липопротеидов высокой плотности – ЛПВП), а также уровень мочевой кислоты определены спектрофотометрическим методом на биохимическом анализаторе «Screen Master Plus» (Hospitex diagnostic, Швейцария).
Для обработки численного материала использованы следующие методы математической статистики: t-критерий Стьюдента равенства средних (при неизвестной дисперсии), однофакторный многомерный дисперсионный анализ. Проведена проверка выборки на нормальность, использован критерий согласия Колмогорова–Смирнова. Рассчитаны показатели дескриптивной статистики: среднее арифметическое значение со средней ошибкой М±m, среднее квадратическое отклонение среднего арифметического значения (σ). При проверке всех гипотез использован уровень значимости р=0,05. Статистическая обработка результатов проведена с помощью Microsoft Excel для Windows.
Результаты и обсуждение
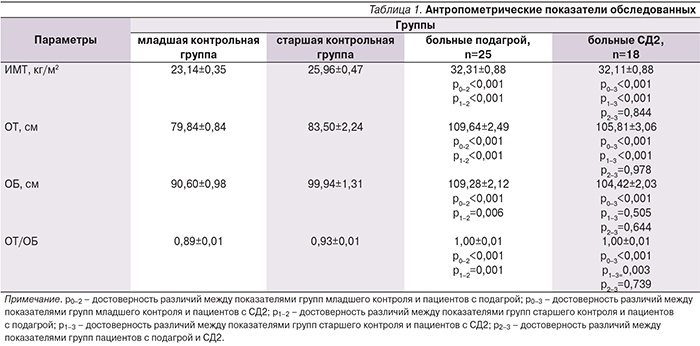
В табл. 1 представлены результаты антропометрического обследования.
У больных СД и подагрой ИМТ достоверно превышал контрольные значения и соответствовал I степени ожирения. Также у пациентов обеих групп ОТ была более 94 см, а отношение ОТ/ОБ больше 0,95, что позволило диагностировать у них висцеральный тип ожирения.
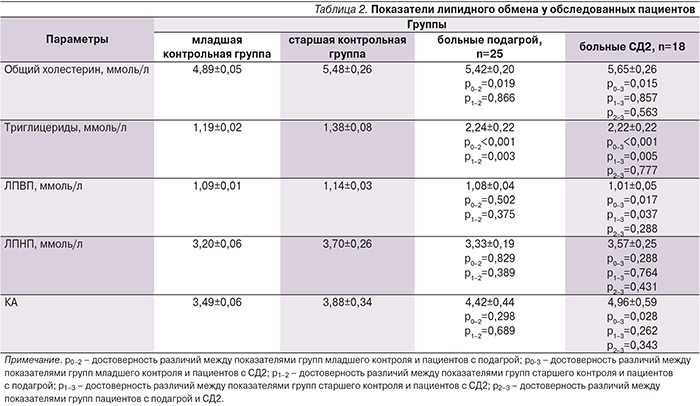
Как видно из табл. 2, и у больных СД2, и у пациентов с подагрой достоверно повышено содержание триглицеридов относительно обеих контрольных групп. Концентрация общего холестерина также повышена в обеих группах пациентов, но только по сравнению с младшим контролем. У обследованных пациентов с СД2 значимо снижен уровень ЛПВП в отсутствие каких-либо отличий его содержания у больных подагрой относительно и младшей, и старшей контрольных групп. Коэффициент атерогенности (КА) также повышен в обеих группах больных, но достоверности достигло его повышение только у пациентов с СД2.
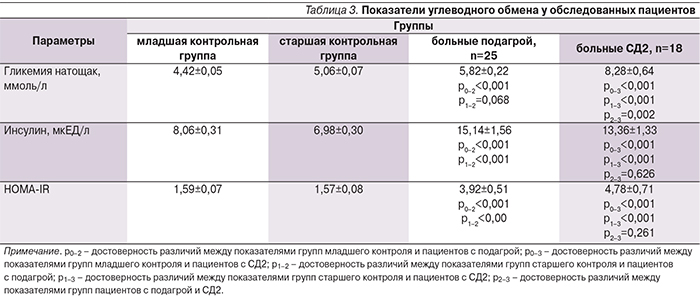
В обеих группах больных уровень гликемии превышал параметры и младшего, и старшего контроля (табл. 3). Необходимо отметить, что у пациентов с подагрой гликемия находилась в пределах нормального диапазона. Повышение уровня глюкозы происходило на фоне ИР, более выраженной у больных СД2. ИР сопровождалась компенсаторной гиперинсулинемией. Наличие ИР у пациентов с подагрой установлено и в работах В.Г. Барсковой и соавт. (2004–2007), М.С. Елисеева и соавт. (2005) [5–9].
Уровень мочевой кислоты был значимо повышен в обеих группах обследованных только по сравнению с группой контроля младшего возраста (табл. 4).

В ряде работ также указывается о повышении концентрации мочевой кислоты у больных СД2 [10, 11]. Так, в работе И.В. Мадянова, О.Б. Илюхиной (2014) приводятся результаты обследования 198 пациентов с СД2, у которых был повышен уровень мочевой кислоты.
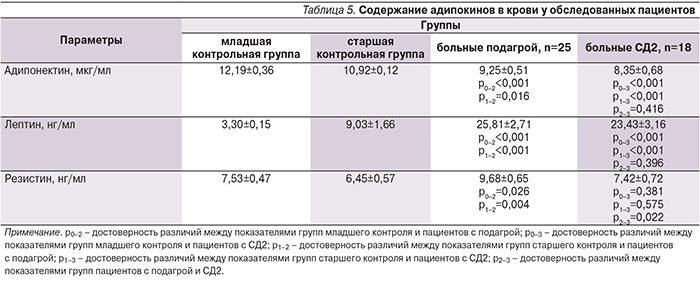
Жировая ткань секретирует большое количество метаболически активных пептидов, т.н. адипокинов, к которым относятся адипонектин, лептин, резистин и др. [12]. И у больных СД2, и у пациентов с подагрой выявлено достоверное повышение уровня лептина относительно обеих контрольных групп. Значимых различий в содержании этого адипокина в группах обследованных пациентов с этими заболеваниями не было. Гиперлептинемия сопровождалась снижением уровня адипонектина и у больных СД2, и у пациентов с подагрой. Минимальное содержание адипонектина выявлено у лиц с СД2. У больных подагрой значимо (p<0,05) был повышен уровень резистина относительно и младшей, и старшей контрольных групп в отсутствие изменений этого адипокина при СД2 (табл. 5).
У пациентов и с СД2, и с подагрой выявлена отрицательная корреляция лептина с адипонектином: r=-0,505, p=0,010 в группе больных подагрой и r=-0,608, p=0,007 в группе пациентов с СД2.
В группе пациентов с подагрой выявлены положительные корреляции между уровнем мочевой кислоты и концентрацией резистина (r=0,419, p=0,037). В группе пациентов с СД2 выявлена положительная корреляция уровня мочевой кислоты с содержанием адипонектина (r=0,548, p=0,019) и отрицательная – с концентрацией лептина (r=-0,737, p=0,000).
Выводы
В группах пациентов с подагрой и СД2 выявлена атерогенная дислипидемия, что выражается повышением уровней общего холестерина, триглицеридов, а также коэффициента атерогенности.
У всех обследованных пациентов установлено повышение ИР на фоне компенсаторной гиперинсулинемии.
У пациентов с подагрой и СД2 выявлены гиперлептинемия, гиперрезистинемия и гипоадипонектинемия.



