Введение
Функциональные нарушения органов пищеварения (ФНОП) занимают лидирующее положение в структуре заболеваний органов пищеварения у детей различных возрастов. По некоторым данным, распространенность ФНОП в развитых странах среди детей в возрасте от 4 до 18 лет составляет от 14 до 24% [1]. Результаты эпидемиологических исследований в нашей стране свидетельствуют о том, что жалобы, характерные для данной группы заболеваний, предъявляют 6% учащихся средних, 14% старших классов и более 50% детей с рецидивирующим абдоминальным болевым синдромом [2].
В Международной классификации болезней ФНОП присвоены номера K58 (Синдром раздраженного кишечника: K58.0 Синдром раздраженного кишечника с диареей и K58.9 Синдром раздраженного кишечника без диареи) и K59 (Другие функциональные кишечные нарушения: K59.0 Запор, K59.1 Функциональная диарея, K59.2 Неврогенная возбудимость кишечника, неклассифицированная в других рубриках, и K59.9 Функциональное нарушение кишечника неуточненное).
Общепринятым стандартом диагностики и классификации ФНОП являются Римские критерии, предложенные Комитетом по изучению функциональных расстройств у детей и Международной рабочей группой.
В соответствии с Римскими критериями IV пересмотра (2016) ФНОП у детей разделяют на две группы в зависимости от возраста ребенка (табл. 1).

Среди всех ФНОП наиболее распространенной нозологической формой является функциональный запор (ФЗ). В западных странах, по оценочным данным, он диагностируется у 2–27% населения [4, 5]. Запор отмечается примерно у 12% населения мира, при этом жители Америки и стран Юго-Восточной Азии страдают им в 2 раза чаще, чем европейцы (17,3 и 8,75% соответственно) [5]. Эти цифры не в полной мере отражают истинную распространенность из-за низкой обращаемости пациентов. В России подобная статистика носит фрагментарный характер. Отдельные исследования говорят о сопоставимости данных в нашей стране представленным [6]. Широкая распространенность запоров дала основание отнести это расстройство к болезням цивилизации.
Нормальная периодичность стула – показатель, индивидуальный для каждого человека, при этом принято считать, что у практически здоровых людей она колеблется от 1–3 раз в сутки до 1 раза в 3 дня (5–7% обследованных) [7]. Как правило, такие особенности носят наследственный характер.
В настоящий момент значительно расширились представления о возможных механизмах, лежащих в основе генеза ФНОП у этой группы пациентов.
В частности, установлено, что у значительной доли больных с ФЗ имеются стойкие дисбиотические явления, которые приводят к гиперреактивности кишечной стенки, а также к нарушениям переваривания и пассажа пищи [8]. У данной группы пациентов были выявлены характерные изменения цитокинового профиля, поддерживающие воспалительные изменения слизистой оболочки кишечника и приводящие к повышению висцеральной чувствительности [9, 10]. Растет количество сообщений о высокой частоте ФЗ после перенесенной новой коронавирусной инфекции [11].
В настоящее время рационы питания недостаточны по микро- и макронутриентам, что отрицательно влияет на здоровье, активность и долголетие всех наций. Доказано, что хронические дефициты эссенциальных нутриентов служат одной из основных причин роста алиментарно зависимых заболеваний и в частности ФЗ.
Недостаточное содержание пищевых волокон (некрахмальных полисахаридов – НПС) в рационе сопровождается функциональными нарушениями желудочно-кишечного тракта, дисбактериозами, снижением функции иммунной системы, повышением риска развития сердечно-сосудистых заболеваний, ожирения, сахарного диабета 2 типа, желчнокаменной болезни, некоторых онкологических заболеваний.
НПС за счет образования короткоцепочечных жирных кислот и снижения водородного показателя способствуют развитию бифидо- и лактобактерий и ингибируют рост патогенных видов за счет стимуляции колонизационной резистентности, подавления эпителиальной адгезии и стимуляции секреции бактерицидных веществ. Расширение представлений о механизмах формирования ФЗ способствует расширению возможностей терапии данных состояний.
Цель исследования: изучение эффективности различных схем лечения ФЗ у детей.
Методы
В исследование были включены 106 пациентов возрасте от 4 до 17 лет, проходивших лечение амбулаторно в Консультативно-диагностическом центре ДНКЦИБ ФМБА России, 57-е ДПО, ММЦ «Согаз», в связи с ФЗ, из них 51 (48,1%) мальчик и 55 (51,9%) девочек.
Для постановки диагноза ФЗ использовались критерии Римского консенсуса IV пересмотра. Набор диагностических критериев, из которых должно наблюдаться не менее 2, минимум 1 раз в неделю в течение 1 месяца:
- 2 дефекации (и меньше) в туалете в неделю;
- 1 эпизод недержания кала в неделю (минимум);
- сознательное удержание кала;
- боли при дефекации и твердый стул в анамнезе;
- большой диаметр каловых масс;
- скопление массы каловых масс в прямой кишке.
Наблюдение осуществляли 1 раз в месяц амбулаторно в течение 6 месяцев (I период). Фиксировали динамику симптомов ФЗ в соответствии с Римскими критериями IV пересмотра. Проводилось исключение симптомов тревоги (табл. 2)

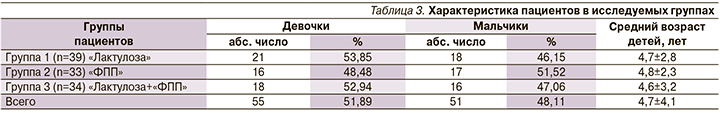
Медикаментозное лечение ФЗ осуществляли в трех группах (табл. 3), образованных в соответствии с проводимой схемой лечения:
- группа 1 – лактулоза (n=39);
- группа 2 – ФПП хлеб функциональный «белково-полбяной многозерновой» (n=33);
- группа 3 – лактулоза+ФПП хлеб функциональный «белково-полбяной многозерновой» (n=34).
Пациенты получали лактулозу в течение 1 месяца в соответствующей дозировке: дети от 1 до 6 лет: 5–10 мл/сут; дети от 7 до 14 лет: 15 мл/сут; дети 4 лет и старше: в первые три дня по 15–45 мл/сут, затем 10–30 мл/сут). Хлеб дети получали в дозе 60 мг в возрасте от 1 до 3 лет и 80–100 мг в день в возрасте 4–14 лет.
В случае негладкого течения заболевания (увеличение частоты стула, усиление болей, ухудшение общего состояния ребенка) осуществлялась коррекция терапии и исключение пациентов из исследования. Допускалось применение симптоматических средств: спазмолитики, ветрогонные препараты.
Критериями исключения больных из исследования также были:
- несоблюдение протокола исследования;
- отказ пациента или его законных представителей от участия.
Клиническое наблюдение больных осуществляли еженедельно. Оценивали динамику и выраженность клинических проявлений ФЗ (боли в животе, частота стула, вздутие, метеоризм). Критериями эффективности лечения считались нормализация частоты и консистенции стула.
Микробиоценоз кишечника детей оценивали в начале лечения и на 21-е сутки путем исследования образцов фекалий методом ПЦР-РВ, которое выполняли в отделе молекулярной микробиологии ФГБНУ ИЭМ. Выделение ДНК из фекалий осуществляли с помощью набора ДНК-ЭКСПРЕСС (ООО «Литех», Россия). Применялся набор праймеров «Колонофлор-16» (ООО «АльфаЛаб», Россия), служащий для выявления общей бактериальной массы, Lactobacillus spp., Bifidobacterium spp., Bacteroides fragilis group, Bacteroides thetaiotaomicron, Faecalibacterium prausnitzii, Escherichia coli, Klebsiella oxitoca/pneumoniae, Proteus spp., Pseudomonas aeruginosa, Acinetobacter spp, Citrobacter spp., Staphylococcus aureus, Salmonella spp, Shigella spp. и Candida spp. Полученные результаты были представлены как количество колониеобразующих единиц (КОЕ) изучаемых микроорганизмов в 1 г фекалий в десятичных логарифмах (lg КОЕ/г).
Статистическая обработка материала проведена с помощью программы Statistica for Windows, v. 10 (StatSoft, США) с использованием параметрических и непараметрических критериев. Анализ соответствия вида распределения признака закону нормального распределения проводился с использованием теста Колмогорова–Смирнова. Для каждой группы были вычислены дескриптивные характеристики: частота встречаемости признака (для дискретных признаков), среднее значение показателя (M), стандартное отклонение (σ), ошибка среднего значения (m), минимум, максимум, медиана и квартили для признаков с непрерывным распределением. Для определения статистической значимости различий в сравниваемых выборках использовали t-критерий Стьюдента, ранговый U-критерий Манна–Уитни, ранговый дисперсионный анализ Краскела–Уоллиса. Сравнение частоты встречаемости признаков в группах и анализ таблиц сопряженности выполняли с помощью χ2-критерия Пирсона и точного метода Фишера. Статистическую обработку данных о концентрации возбудителей в кале выполняли после предварительной логарифмической трансформации исходных величин. Графики и диаграммы построены в программах Excel, GraphPadPrism.
При анализе динамики показателей в процессе лечения использовали парный td-критерий и ранговый Ud-критерий Вилкоксона (для связанных выборок). Статистически значимыми считали результаты анализа при p<0,05.
Результаты
Среди жалоб, предъявляемых пациентами, абдоминальный болевой синдром оказался ведущим. Особенности клинических проявлений у детей при ФЗ на момент начала терапии приведены в табл. 4.
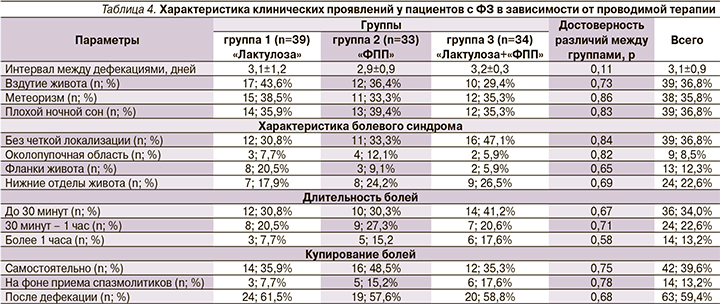
Исследуемые группы были сопоставимыми по тяжести и выраженности симптомов заболеваний. С максимальной частотой выявлялись дискомфорт и боли в животе без четкой локализации длительностью до 30 минут, купировавшиеся при дефекации. Средний интервал между дефекациями в сравниваемых группах также не имел статистических различий.
Стоит отметить, что выраженность абдоминального болевого синдрома менялась в течение наблюдения. К концу первой недели терапии данный синдром характеризовался умеренной интенсивностью, нестойкими болезненными ощущениями без четкой локализации, не оказывал значительного влияния на поведение ребенка и его социальную активность. Характеристика продолжительности сохранения симптомов заболеваний у пациентов исследуемых групп представлена в табл. 5.
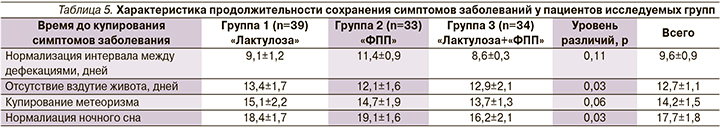
В большинстве случаев уменьшение дискомфорта в животе у детей отмечалось после акта дефекации. Выявить наличие связи болей с характером пищи и особенностями стула, а также оценить эффект использованных фармакологических препаратов для купирования болей не удалось.
Частота появления диспептических симптомов у детей на фоне терапии снижалась во всех группах. Еще одной особенностью, характерной для исследуемого контингента, была большая вариабельность жалоб пациентов в динамике наблюдения. При повторных осмотрах дети отмечали появление новых симптомов на фоне полной или частичной регрессии предшествующих. Подобного рода особенности отмечены в работах и других исследовательских групп [10]. Данный феномен большинство исследователей связывают с морфофункциональными особенностями органов пищеварения, а также системы ноцицепции и висцероцепции в детском возрасте [11].
Полного купирования болевого синдрома после курса лечения удалось достичь 64 (60,4%) детям. В зависимости от выбранной медикаментозной схемы отмечались значимые различия в частоте полного длительного купировании симптомов ФЗ: в группе 1 – у 21 (53,8 %), в группе 2 – у 19 (57,6%), в группе 3 – у 24 (70,6%).
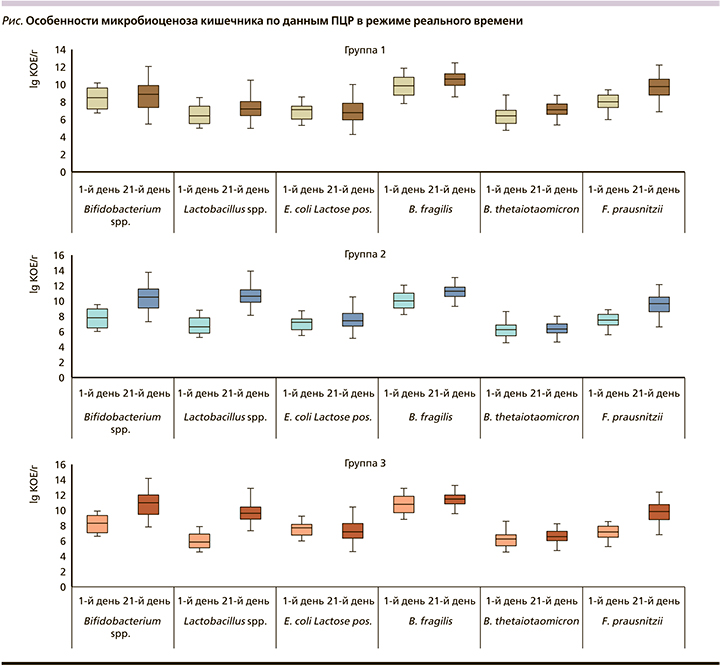
Несомненно, что значительное влияние на течение ФЗ оказывает состояние микробиоценоза кишечника (см. рисунок). Нарушения микробиоценоза кишечника отмечались во всех группах на момент начала терапии и характеризовались уменьшением уровня симбиотических микроорганизмов разной степени выраженности. Наиболее типичным было снижение уровня Lactobacillus spp. и Bifidobacterium spp. Данный показатель был ниже референсных значений на 2 lg КОЕ/г у 22 детей из группы 3 (64,7,7%) и 24 из группы 2 (72,7%). Стоит также отметить, что применение продуктов ФП способствовало восстановлению нормальных уровней данных параметров. Данный феномен может частично объяснять частое стойкое купирование симптомов ФЗ у пациентов данных групп.
Заключение
Таким образом, комбинированная терапия запоров с использованием ФПП хлеб функциональный «белково-полбяной многозерновой» в сочетании со слабительными повышает эффективность лечения, обеспечивая достоверно более эффективное восстановление показателей микробиоценоза и сокращение продолжительности клинических симптомов. Применение ФПП хлеб функциональный «белково-полбяной многозерновой» в качестве монотерапии также оказывало влияние на симптомы заболевания, способствуя нормализации частоты дефекации и уменьшению симптоматики, связанной с задержкой стула.
Публикация статьи осуществляется в рамках диссертационной работы на соискание ученой степени докт. мед. наук: «Кампилобактериоз у детей: диагностика, клинико-патогенетическая характеристика и персонифицированная терапия».



