Введение
Данные более 80 тыс. клинических, биохимических, клеточно-молекулярных исследований, опубликованные за последние 30 лет, показывают, что поддержание физиологических уровней магния в тканях организма – фундаментальный параметр здоровья человека. Систематическое истощение магниевого депо способствует развитию хронического эндотелиального воспаления, увеличению
риска сердечно-сосудистых и цереброваскулярных заболеваний, а также инсулинорезистентности, глюкозотолерантности и сахарного диабета [1]. Диагностическими критериями дефицита магния (ДМ; диагноз “Е61.3. Недостаточность магния по МКБ-10”) являются его клинические признаки; сниженные уровни магния в плазме крови (ПК) и эритроцитах, тромбоцитах и др.; специфические изменения
зубцов и интервалов на ЭКГ [2].
Проблема ДМ настолько распространена во всем мире, что многие страны (Франция, Япония, Германия,
Швейцария, Финляндия, Канада) проводили долгосрочные правительственные программы по его компенсации, включившие скрининговую клиническую и лабораторную диагностику ДМ с последующим осуществлением компенсаторных мер (информирование населения о необходимости
рационального питания, прием препаратов магния). По результатам этих специальных нутриологических программ проведены эпидемиологические исследования [3].
Скрининговые исследования имеют большое значение для понимания той фундаментальной роли, которую дефицит магния играет в патогенезе различных заболеваний [3–9]. Например, эпидемиологическое исследование более 100 тыс. человек показало достоверную корреляцию между смертностью от сердечно-сосудистых заболеваний и уровнями магния в питьевой воде (США, 1962) [4]. Европейское эпидемиологическое исследование по кардиоваскулярным заболеваниям определило гипомагнеземию как важный фактор риска смертности от инсульта и сердечно-сосудистых заболеваний [9].
Исследование когорты 14 495 мужчин 35–74 лет в Финляндии показало, что при увеличении содержания магния в питьевой воде на каждый 1 мг/л риск острого инфаркта миокарда (ИМ)
снижается на 4,9 % [5].
Исследование 1679 пациентов в Швеции показало, что риск смерти от ИМ был ниже в группе с высокими уровнями магния в ПК (> 0,83 ммоль/л), чем в группе с меньшими уровнями (< 0,75 ммоль/л): относительное снижение риска составило 36 % [6].
Исследование смертности после коронарного шунтирования в когорте 957 пациентов показало, что низкий (< 0,8 ммоль/л) уровень магния в сыворотке связан с повышенным риском смерти или ИМ (двукратное увеличение риска) [7].
Отметим, что разные скрининговые исследования дают несколько различающиеся оценки наиболее приемлемого уровня магния в ПК, который считается нижней границей нормы (0,76–0,83 ммоль/л). Это связано с различным этническим составом изучаемых когорт, географическими факторами, бременем заболеваемости в данной популяции и другими факторами. Поэтому проведение крупномасштабного скрининга россиян имеет принципиальное значение для обоснованного выбора критериев ДМ и определения его должных референсных значений в лабораторно-клинической практике.
В связи с вышесказанным особый интерес представляет изучение комплексного воздействия недостаточности магния на этиопатогенез коморбидных заболеваний. Этому было посвящено многоцентровое наблюдательное исследование “Скрининг уровня магния в плазме крови и эритроцитах в условиях многопрофильного стационара”. Первичной целью исследования было определить частоту ДМ у различных категорий пациентов. Вторичными целями cтали изучение
влияния ДМ в качестве фактора риска на развитие различных заболеваний и патологических состояний, а также определение распространенности частоты дефицита пиридоксина (витамина В6).
Существенным моментом при проведении подобного рода крупномасштабных исследований является выбор корректной стратегии анализа полученных данных. Результаты медицинских исследований отличаются значительной сложностью, обусловленной массой измеряемых клинических и лабораторных параметров (сотни), сложными взаимосвязями между этими параметрами в контексте биологических систем, разнородностью признаковых описаний параметров, множественными интерпретациями значений параметров, большими выборками пациентов (тысячи, десятки тысяч)
и т. д. Поэтому можно ожидать, что закономерности, устанавливаемые на основе анализа медицинских данных, также будут сложными.
Однако, судя по публикациям в области клинической медицины, в анализе данных большинства медицинских исследований преобладает некоторая упрощенность. Из всего массива корреляций, как правило, выделяются одна-две (т. н. первичная точка исследования [англ. – primary outcome] и вторичная точка), “особо интересные” для исследователя, и анализируется их “статистическая значимость” с поправками на “вмешивающиеся факторы”. Остальные корреляции просто игнорируются. Очевидно, что при таком подходе огромный массив ценной медицинской информации,
собранной в ходе весьма трудоемких и дорогостоящих исследований, утрачивается.
Приведем пример. В настоящем исследовании была собрана информация о 187 параметрах 2000 пациентов. Очевидно, что в таком массиве данных может существовать до 187 × 186 = 34 782 значимых парных корреляций параметров, до 187 × 186 × 185 = 6 434 670 тройных взаимодействий и т. д. Ни в одном биомедицинском исследовании, как правило, не проводится детальный анализ таких массивов корреляций.
Одной из существенных причин пренебрежения значительными массивами собранной информации является отсутствие общепринятых математических методов комплексного анализа сложных данных. Отсутствие математического обоснования наряду с использованием статистических эвристик, произвольно выбранных просто из соображений “удобства”, способствует тому, что довольно многие
современные исследования по клинической доказательной медицине приводят к результатам, противоречащим не только фундаментальным исследованиям по клеточной биологии, биохимии и молекулярной физиологии, но и просто здравому смыслу. Например, в крупномасштабном исследовании
3681 человека, наблюдаемого в течение 8 лет, было “доказано” отсутствие взаимосвязи между уровнями натрия в крови и риском артериальной гипертонии [10]. Такого рода “выводы” являются прямым следствием прямо-таки безграмотного использования методов математической статистики.
В настоящей работе для анализа данных, собранных в ходе скрининга, были использованы новые математические концепции “метрических сгущений” и “метрических карт”, позволяющие исследовать весь массив корреляций биомедицинского исследования и наглядно представлять все установленные корреляции на достаточно простой диаграмме. Эти методы были разработаны в рамках алгебраического подхода научной школы академика РАН Ю.И. Журавлева, в которой в течение многих лет разрабатываются специализированные и высокоэффективные математические методы анализа биомедицинских данных [11–14]. Анализ метрических сгущений также позволяет исследовать вопросы о множественном тестировании (в плане мультипараметрического анализа и смешения эффектов различных факторов [англ. – confounding]) и однородности выборки.
Материал и методы
Данное исследование было проведено как крупномасштабный многоцентровой скрининг. Продолжительность исследования составила 9 месяцев. В исследование были включены 2000 пациентов, соответствующих установленным критериям. Все пациенты предоставили информированное согласие на участие в настоящем исследовании и были информированы о результатах лабораторного тестирования уровня электролитов в крови, получили рекомендации по организации рационального питания и здорового образа
жизни.
Выборка пациентов
Пациенты, поступившие в лечебные учреждения из следующих отделений: сердечно-сосудистой патологии (n = 150), гастроэнтерологии (n = 150), гематологии (n = 150), неврологии (n =150), нефрологии (n = 150), урологии (n = 150), пульмонологии (n = 150), дерматологии (n = 150), гинекологии (n = 150), эндокринологии (n = 150); здоровые добровольцы, проходящие профосмотр (n = 500).
В исследование включены пациенты, соответствовавшие следующим критериям: 1) возраст 18–90 лет;
2) поступившие в государственные лечебные учреждения; 3) подписавшие информированное согласие. Пациенты не включались в скрининг, если был поставлен хотя бы один диагноз из следующих классов заболеваний по МКБ-10: II (новообразования), XIX (травмы, отравления), XX (внешние причины заболеваемости и смертности), XXI (факторы, влияющие на состояние здоровья населения).
Лабораторная диагностика
Определение уровней магния и других электролитов осуществлено методом абсорбционной спектрофотометрии на полуавтоматическом фотометре “StatFax 1904+”(США). Концентрации анализируемых элементов установлены по методу внутреннего стандарта. Использовались реагенты магний, калий и т. д. (HUMAN, Германия). Забор крови осуществлен из локтевой вены в количестве 3 мл с 08.00 до 10.00, строго натощак (согласно циркадному ритму магния и калия в ПК, в это время их уровни отражают средние концентрации электролитов за сутки; исключается пищевой подъем уровней магния и калия). Кровь для исследования брали с гепарином из расчета 5 мг (650 ЕД) на 1 мл крови или 1 капля (0,02 мг) на 5–10 мл крови. Уровни магния определены с ксилидиновым синим, уровни калия – в свободной от белка щелочной среде с тетрафенилбороном натрия.
Статистика
Для стандартной статистической обработки результатов исследования использованы методы математической статистики, включившие расчет числовых характеристик случайных величин, проверку статистических гипотез с использованием параметрических и непараметрических критериев, корреляционного и дисперсионного анализа. Сравнение прогнозируемых и наблюдаемых частот встречаемости исследуемых признаков проведено с помощью критерия хи-квадрат, T-критерия Вилкоксона–Манна–Уитни и теста Стьюдента. Для статистической обработки материала использованы прикладная программа STATISTICA 6.0 и электронные таблицы Microsoft Excel. Помимо стандартных методов статистики в ходе анализа данных скрининга были использованы новые математические подходы интеллектуального анализа данных для установления интервалов информативных значений
численных параметров, нахождения метрических сгущений в пространстве параметров биомедицинского исследования и построения метрических карт.
Установление интервалов информативных значений численных параметров
Диагностические критерии в медицине формируются как совокупности логических правил “если... то...”
и др. [15], т. е. врачи-исследователи, как правило, сводят диагностические критерии к некоторой бинарной форме (например, температура выше или равна 37 оС–температура ниже 37 оС; уровни гемоглобина ниже 100 г/л–гемоглобин более 100 г/л) или комбинациям нескольких бинарных признаков (гемоглобин ниже 130 г/л у мужчин, возраст более 70 лет). Поэтому анализ данных требует проведения процедуры разбивки значений численных параметров на интервалы информативных значений (т. н. факторизация). Например, численный параметр может быть факторизован с использованием т. н. процентилей: тертилей (нижняя, средняя и высокая трети значений), квартилей (четверти), квинтилей и т. д.
Очевидно, что каждый параметр может быть факторизован несколькими способами, имеющими свои особенности. Например, использование процентилей – достаточно простой способ, но при его применении учитываются различия в “типичных” значениях параметров. Более приемлемым представляется установление интервалов типичных значений параметров с разбивкой на классы значений в соответствии с этими интервалами – метод, который и был использован в настоящей работе.
Таким образом, после сбора данных исследования каждый пациент характеризуется набором описаний – клиническими симптомами, демографическими, биохимическими и другими параметрами. Пусть Т – исходная таблица данных описаний n пациентов, в которой каждая строка соответствует масcиву данных из m признаков о состоянии конкретного пациента; rλ = (r1,r2,...,rm) – λ-й вектор размерности факторизации, λ = 1..Λ и Xλ – λ-я факторизованная таблица бинарных описаний. Факторизующей функцией φλ назовем отображение φ(rλ): Xλ= φ(rλ,T). Определим операцию конкатенации матриц описаний “X1UX2” как теоретико-множественное объединение столбцов матриц X1 и X2. Тогда X = UXλ ={xij} – таблица элементарных бинарных описаний пациентов над заданным {rλ}, в которой xij – значение i-го элементарного бинарного описания j-го пациента.
Бинарные признаки в X соответствуют интервалам информативных значений, а элементы вектора rλ задаютчисло этих интервалов. При факторизации на основе установления интервалов типичных значений функция φ(rλ) определяется как композиция
элементарных факторизующих функ-
ций:
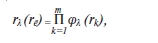
каждая из элементарных функций φλri построена так, что строит интервалы значений на основе выделения максимумов частоты распределения значений k-го признака таблицы Т при заданном числе информативных интервалов (т. е. rk). В настоящей работе rk вычислялось автоматически как плато максимальной длины на графике распределения числа получаемых интервалов в зависимости от шага разбиения.
Нахождение метрических сгущений в пространстве параметров биомедицинского исследования
Одной из основных проблем анализа биомедицинских данных является адекватное проведение мультипараметрического анализа, что связано с эффектами т. н. множественного тестирования (термин математической статистики) или смешивания эффектов различных факторов (биостатистика). Например, если найдены статистически достоверные корреляции между ИМ и ДМ, ИМ и возрастом,
ИМ и повышенными уровнями триглицеридов и т. д., то какая из корреляций важнее? Насколько независимы вклады, например, ДМ и возраста в увеличение риска ИМ? Методы стандартной математической статистики даже при условии их правильного применения [16, 17] дают достаточно
спорные ответы на эти вопросы.
В настоящей работе впервые в мировой практике использован подход, основанный на фундаментальной концепции метрики (в математике метрика – функция измерения расстояния
между точками, которая удовлетворяет аксиоме треугольника). Точками в данном случае являются изученные параметры пациентов. Набор точек с заданной метрикой называется метрической конфигурацией. Измеряя попарные расстояния между этими точками, становится возможным установление метрических сгущений [18] (кластеров близколежащих точек), а затем построение метрических карт (проекций метрических конфигураций на плоскость), которые являются наглядными диаграммами, отражающими весь массив исследованных корреляций биомедицинских параметров.
Ниже приведены краткое описание алгоритма поиска метрических сгущений на основе p-сетей, выбор вершин p-сети, построение метрической конфигурации как матрицы попарных расстояний и процедур поиска собственно метрических сгущений.
Общее описание алгоритма поиска метрических сгущений. Пусть X – таблица элементарных бинарных описаний пациентов, в которой каждый из пациентов описывается набором из N-признаков. Будем считать каждый из признаков точкой в пространстве соответствующей размерности, тогда
X = {X1,..., XN} – множество, состоящее из N-точек. Задана метрика p(xi,xj), определенная на всех парах точек из X, для которой выполняются условия полуметрики: p(xi,xj)=0, p(xi,xj)= p(xi,xj), i,j {1,...,N}. Требуется найти множество K X — подмножество X, образующее метрическое сгущение. В настоящем исследовании в качестве метрики использовалось нормированное значение стандартного статистического параметра хи-квадрат следующим образом: px2(xi,xj)=x2(xi,xj)/x2max, где x2max – максимальное значение x2 по всему множеству X.
Метрическим сгущением называется множество близких в смысле заданной метрики точек, образующих компактные области. Метрические сгущения K находятся посредством следующей итеративной процедуры: 1) из заданного набора X вычитаем множество точек K, образующих уже найденное
сгущение, X*=X\K; 2) находим сгущение K* на полученном наборе X*; 3) повторяем процедуру до нахождения всех сгущений {K}.
Для отыскания множества K вводится понятие p-сети как некоторого “опорного” множества, образующего систему координат метрического сгущения. Например, p-сетью является множество X'={Xk| I} фиксированной мощности n, состоящее из объектов множества X={X1|1 J}, которые находятся на максимальном расстоянии друг от друга, т. е.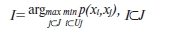
Затем строится матрица D попарных расстояний между точками, принадлежащими p-сети, и всеми остальными точками множества X: D={di,j}, где i {1,...,n}=I – индекс объекта p-сети, а j {1,...,n}=J – индекс объекта из X. Точки, входящие в p-сеть X', также принадлежат множеству X, X' X, причем предполагается, что N=|X|>> n=|X'|. Множество точек p-сети отыскивается с помощью следующей процедуры.
Выбор вершин p-сети Х'. Положим, что изначально X'= . Берется произвольный элемент yi X, вычисляется 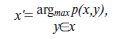
элемент x' заносится в p-сеть, X'=X' x', Процедура повторяется, пока |X'|<n.
Построение и сортировка метрической конфигурации как матрицы попарных расстояний. Построим матрицу D R+m×n парных расстояний между точками p-сети и остальными точками X:D={dij},dij=p(xi,xj), где i I — индекс вершины p-сети, а j J — индекс точки из X. Иначе говоря, матрица
D содержит расстояния от каждого объекта p-сети X2 до каждого объекта множества X|X'.
Каждой строке i матрицы D ставится в соответствие строка индексов точек, отсортированных по возрастанию расстояний от i-й точки p-сети до остальных точек множества X, {ňij| j J} а {sort(ňik| K J}. Затем строится матрица R={rij|rij=φi-1(j)}, содержащая в строках индексы rij N отсортированных значений расстояний, и матрица R'={r'ik|r'ik=φi-1(k)}, содержащая индексы r'ij N “обратных” сортировке значений.
Поиск метрического сгущения. На строках матрицы R' задается “окно” заданной ширины, включающее dN=[1/2KD×N] элементов строки, где KD — задаваемый параметр, описывающий желаемую выраженность сгущения. Значение параметра KD алгоритм находит автоматически,
принимая во внимание, что искомое сгущение является разрезом максимального веса. За центр “окна” примем k-й столбец матрицы R', индекс K {dN+1,...,N-dN-1}.
Найдем кластер K с наибольшим количеством элементов, |K|→max. Для этого для каждого номера точки j J в каждой строке с номером i матрицы R' найдем окрестность Ki J соседние элементы j-го столбца мощностью 2dN+1. Кластером K будет являться пересечение множеств ближайших соседей Ki по всем i,
Построение метрических карт. Как было указано выше, карта метрической конфигурации, или метрическая карта, является наглядной диаграммой, отражающей весь массив исследованных
корреляций. С математической точки зрения метрическая карта представляет собой проекцию метрической конфигурации на плоскость. Эта проекция осуществляется на основе определенной ранее матрицы D расстояний точек p-сети до остальных точек X. Посредством гомоморфного преобразования метрическая конфигурация (X, ρ), описанная матрицей D, проецируется в декартово пространство Rn размерности n. Подпространство R3 Rn, построенное на двух главных вершинах p-сети, содержит искомую проекцию исследуемой метрической конфигурации на плоскость.
Результаты
В результате проведения скрининга была собрана информация о 2000 пациентах, поступивших в 4 медицинских учреждения из 6 регионов России: 1. Москва и Московская область, 2. Иваново и Ивановская область, 3. Кострома и Костромская область, 4. Владимир и Владимирская область, 5.
Кемерово и Кемеровская область, 6. Уфа и Уфимская область.
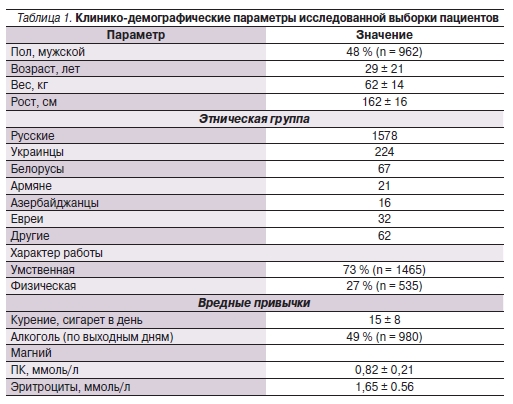
Основной массив данных о пациенте составила информация об анамнезе (диагноз по МКБ-10, всего 142 диагноза), данные по клинической симптоматике ДМ (18 параметров), уровни основных электролитов (магния, калия, натрия, кальция) в крови. Также были собраны данные о диете пациентов (7 параметров). Клинико-демографические параметры пациентов приведены в табл. 1.
В скрининг была включена информация о 142 диагнозах по МКБ-10. Отметим, что в исследованной выборке пациентов большинство диагнозов (более 100) встречалось достаточно редко. Например, 108 диагнозов по МКБ-10 (таких как A08.0. Ротавирусный энтерит, A09. Диарея и гастроэнтерит, A39. Менингококковая инфекция, G04.8. Другой энцефалит, миелит и энцефаломиелит, G09 Последствия воспалительных болезней ЦНС и т. д.) встречались в выборке менее, чем у 10. Наиболее часто встречающиеся диагнозы, установленные в исследованной выборке пациентов, приведены в табл. 2.
Таблица 2. Наиболее часто встречающиеся в выборке диагнозы (n > 10).
В соответствии с данными по 2000 пациентам в исследованной когорте отмечена значительная встречаемость коморбидных состояний. В среднем на пациента приходилось 1,9 ± 1,3 диагноза (95 % доверительный интервал [ДИ] – 1–6); пациенты, имевшие 2 и более диагнозов (табл. 3), составили
большинство – 1251 (62,55 %).
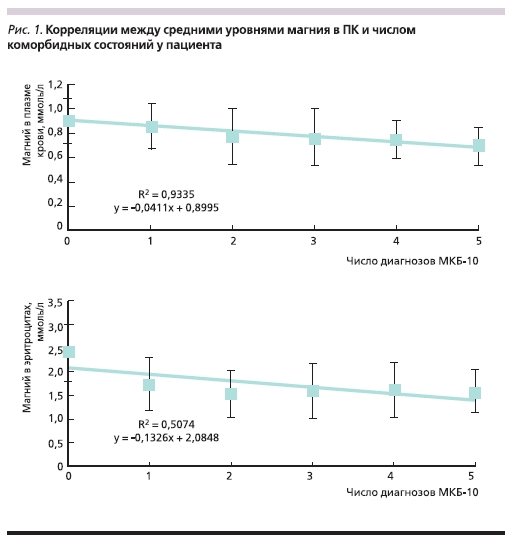
Важно отметить, что число диагнозов по МКБ-10, отражающее степень проявления коморбидности, продемонстрировало достоверную корреляцию с уровнями магния в ПК и эритроцитах (рис. 1). В группе здоровых лиц, проходивших диспансеризацию, средний уровень магния в ПК составил 0,92 ± 0,07 ммоль/л (95 % ДИ – 0,82–0,96), в эритроцитах – 2,45 ± 0,66 ммоль/л (95% ДИ – 1,71–3,56). В то же
время даже при наличии одного диагноза уровни магния были значительно снижены (ПК – 0,86 ± 0,19, эритроциты – 1,74 ± 0,57 ммоль/л). При наличии двух и более диагнозов средние уровни магния в ПК были ниже 0,8 ммоль/л, причем нижние границы достоверных интервалов прогредиентно снижались (табл. 3). Всего же низкие уровни концентрации магния в сыворотке крови были установлены для 956 (47,8 %) пациентов из 2000. В то же время высокий уровень магния отмечен только у 70 (3,5 %) пациентов.
Таблица 3. Встречаемость коморбидных состояний и магниевый статус в исследованной когорте.
Некоторое незначимое возрастание уровней магния у пациентов с 6 и более диагнозами объясняется значительным сокращением соответствующих подгрупп пациентов (6 диагнозов – 51, 7 диагнозов – 12, 8 диагнозов – 1 человек), возможно, приемом витаминно-минеральных комплексов и препаратов магния, не отраженным в медицинских картах.
Следует также подчеркнуть, что именно уровни магния показали достоверные проградиентные корреляции с числом коморбидных состояний. В отношении, например, антропометрических показателей наблюдалась более сложная картина: увеличение возраста, веса, индекса массы тела
(ИМТ) пациентов до определенного числа коморбидных состояний, затем сменяющееся падением (табл. 4).
Таблица 4. Число коморбидных состояний и антропометрические показатели пациентов.
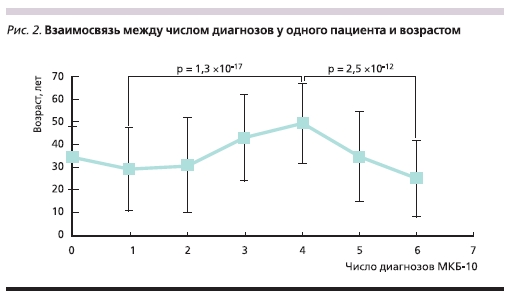
Наиболее показательна взаимосвязь между коморбидностью (т. е. числом диагнозов у одного пациента) и возрастом (рис. 2). Хотя более пожилой хронологический (т. н. паспортный) возраст традиционно рассматривается как фактор риска развития патологий, наши результаты показывают несколько более сложную картину, указывающую на необходимость различать хронологический и т. н. физиологический (биологический) возраст, соответствующий определенному состоянию организма. Установленное взаимодействие между паспортным возрастом и коморбидностью демонстрирует достоверное возрастание числа коморбидных состояний с возрастом – но только до определенного предела. Если у пациента установлено 5 и более коморбидных состояний, наблюдается статистически значимая обратная зависимость (рис. 2).
Интервалы информативных значений уровней магния и других численных переменных
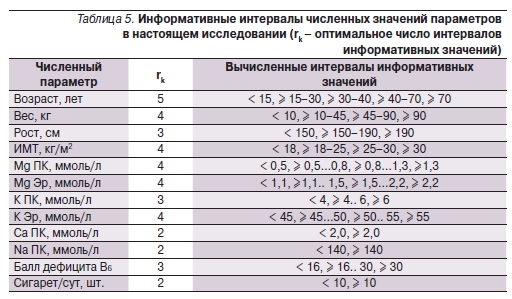
Поскольку использование диагностических критериев в медицине практически неразрывно связано с применением некоторых граничных значений численных параметров (температура выше или равна 37 оС, гемоглобина ниже 100 г/л и т. д.), анализ биомедицинских данных включает разбивку значений численных параметров на интервалы информативных значений (факторизация). В частности, процедура факторизации необходима для проведения анализа метрических сгущений, результаты которого представлены ниже. При установлении интервалов типичных значений параметров (см. Методы) информативные интервалы строятся как максимумы частоты распределения значений соответствующей численной переменной. Таким образом, были вычислены интервалы информативных значений для изученных численных переменных (табл. 5). Полученные интервалы информативных значений были использованы при последующем анализе данных скрининга.
Анализ метрических сгущений в пространстве параметров проведенного скрининга
В ходе настоящего скрининга для каждого из 2000 пациентов были собраны данные по 187 клинико-
лабораторным параметрам. Наглядное визуальное представление всех возможных взаимодействий между изученными параметрами невозможно при использовании стандартных статистических подходов. Использованный в настоящей работе метод метрических сгущений и метрических карт позволяет наглядно представить весь массив корреляций на одной диаграмме.
Метрическая карта исследования представляет каждый из исследованных параметров точкой на плоскости. Расстояние между каждой парой точек пропорционально статистической значимости взаимодействия между соответствующими параметрами. Соответственно, кластеры (сгущения) на метрической карте исследования отражают степень корреляции между параметрами.
Прежде всего следует отметить чрезвычайно важный факт, отчетливо наблюдаемый при изучении метрической карты скрининга: параметры, соответствующие снижению концентрации магния в плазме крови (Mg ПК < 0,5 ммоль/л; Mg ПК 0,5… 0,8 ммоль/л) располагаются в центре метрической карты, что соответствует более сильным и достоверным ассоциациям с остальными параметрами исследования. В то же время параметры, соответствующие концентрации магния в плазме более 0,8 ммоль/л (Mg ПК 0,8… 1,3 ммоль/л; Mg ПК >1,3 ммоль/л), расположены на границе метрической карты, что соответствует
менее статистически значимым ассоциациям.
Отметим, что большинство точек на карте (т. е. параметров исследования) представляет собой диагнозы заболеваний по МКБ-10. Последнее означает, что концентрация магния в сыворотке крови менее 0,8 ммоль/л соответствует повышенному риску заболеваний, в то время как достаточная обеспеченность магнием является защитным фактором. Таким образом, метрическая карта настоящего скрининга – наглядное подтверждение известного принципа “ДМ является патофизиологическим ядром” многочисленных патологий [2]. Рассмотрим вышеупомянутые сгущения параметров подробно
(рис. 3).
Рисунок 3. Анализ статистически значимых корреляций с сгущении параметров "Mg ПК 0,5...0,8 ммоль/л".
Как следует из рис. 3, низкие концентрации магния в плазме крови (менее 0,8 ммоль/л) и в эритроцитах (менее 1,5 ммоль/л) достоверно коррелировали с наличием вредных привычек (курение более 10 сигарет в сутки, регулярное употребление алкоголя) и, вероятно, со значительными нарушениями питания (например, диагноз D50.8 ЖДА). Многие из ассоциаций на рис. 4 соответствуют дисбалансу между симпатической и парасимпатической системами. Патогенез по крайней мере трех заболеваний на рис. 4 непосредственно связан с избытком катехоламинов (F43.0. Острая реакция на стресс, I47.9. Пароксизмальная тахикардия, G47.8. Нарушения сна). Такие общепринятые факторы риска, как алкоголь и курение, также способствуют нарушениям обмена катехоламинов. Известно, что магний активирует фермент катехоламин-О-метилтрансферазу (КОМТ), который разрушает избыток катехоламинов, в то время как ДМ снижает активность КОМТ [2].
Рисунок 4. Анализ статистически значимых корреляций в сгущении параметров "Mg ПК < 0,5 ммоль/л".
Интересно отметить, что экстремально низкие значения концентрации магния в плазме крови (Mg ПК <
0,5 ммоль/л) сформировали кластер статистически значимых ассоциаций, связанных преимущественно с состоянием беременности (рис. 6). Именно пациентки, поступавшие в отделение патологии беременности, отличались самыми низкими уровнями магния в ПК. Экстремально низкие уровни магния были достоверно ассоциированы с внутриутробной гипоксией плода (P20.9) и такой типичной
для второй половины беременности патологии, как судороги (R56.8). Ассоциации экстремально низкого уровня магния в плазме с инсулиннезависимым диабетом (E11.8) и судорогами были статистически
значимыми не только для женщин, но и для детей.
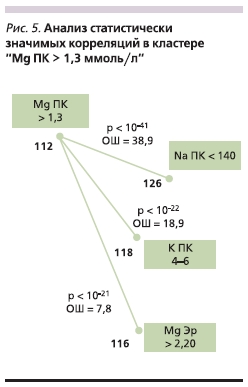
В отличие от рассмотренных ранее статистически значимых ассоциаций пониженных уровней магния в плазме крови с другими параметрами исследования высокие уровни магния в ПК (> 1,3 ммоль/л) были ассоциированы не с патологиями, а с показателями баланса других электролитов (рис. 5). Они, в частности, были связаны с повышенными уровнями магния в эритроцитах (> 2,2 ммоль/л), уровнями калия в плазме в диапазоне нормы (4–6 ммоль/л) и отсутствием гипернатриемии (Na ПК менее 140
ммоль/л). Известно, что магний способствует поддержанию физиологического уровня калия в плазме крови и предотвращает потери калия при использовании калий-выводящих диуретиков [19].
Метрические сгущения (кластеры) и коморбидные состояния
Как было показано выше, в ходе скрининга было установлено преобладание у пациентов коморбидных
состояний. Метрические карты представляют собой чрезвычайно удобный инструмент для иллюстрации коморбидности – ведь соответствующие диагнозам близколежащие точки и отражают степень взаимодействия соответствующих патологий. Анализ метрических сгущений позволил установить наиболее частые сочетания диагнозов. Всего было установлено более 150 таких статистически достоверных сочетаний. Ниже приведен краткий обзор наиболее достоверных и, с нашей точки зрения, наиболее интересных примеров коморбидных состояний, имеющих непосредственное отношение к ДМ.
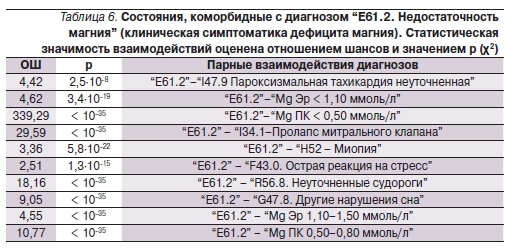
Прежде всего следует отметить, что диагноз “E61.2. Недостаточность магния” (установленный на основании характерной клинической симптоматики ДМ) показал высокую степень коморбидности как с т. н. быстрыми проявлениями ДМ (тахикардия, судороги, нарушения сна), так и с долговременными его проявлениями (пролапс митрального клапана, миопия, см. табл. 6).
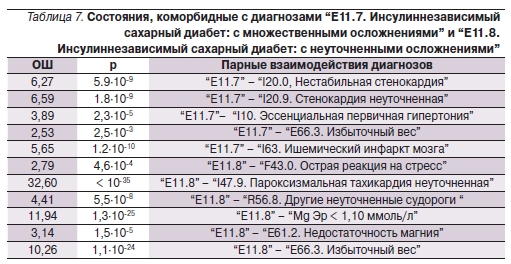
Анализ позволил подтвердить хорошо известную из фундаментальных, экспериментальных и клинических исследований связь между ДМ, инсулинрезистентностью, компонентами метаболического синдрома и развитием соответствующих осложнений диабета (табл. 7, 8). Отметим, что диагнозы ‘E11.7. Инсулиннезависимый сахарный диабет: с множественными осложнениями” и “E11.8. Инсулиннезависимый сахарный диабет: с неуточненными осложнениями” сами по себе предполагают коморбидность как обязательный компонент диагноза. Действительно у многих пациентов с этими тяжелыми диагнозами были многочисленные сопутствующие заболевания.

Избыточный вес – один из существенных компонентов метаболического синдрома, который является
фактором риска многочисленных сердечно-сосудистых и цереброваскулярных заболеваний. Избыточная масса тела также создает излишнюю нагрузку на позвоночник, провоцируя патологические смещения позвонков и формирование межпозвонковых грыж. В настоящем исследовании сердечно-сосудистые, цереброваскулярные заболевания, дорсопатия и избыточный вес были ассоциированы с пониженными уровнями магния в плазме крови (0,5–0,8 ммоль/л).
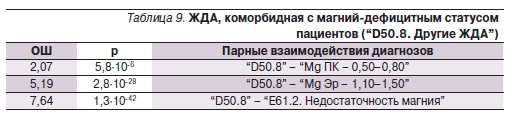
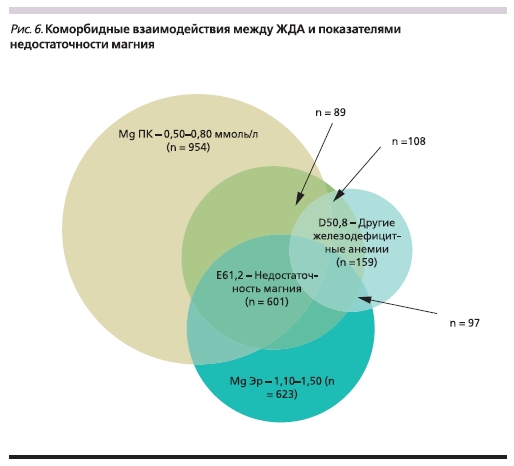
Интересно отметить существованиестатистически сильного взаимодействия между ЖДА и ДМ (табл. 9,
рис. 8). Наличие клинических признаков ДМ соответствовало 7-кратному повышению риска ЖДА. Взаимосвязь между ЖДА и ДМ обусловлена скорее всего алиментарным фактором. Например, низкое потребление зеленолистых растений характерно как для ДМ, так и для дефицита фолатов, необходимых для осуществления биологических функций железа. Низкое потребление зеленолистных растений также соответствует дефицитам витамина С и биофлавоноидов (витамин Р), необходимых для усвоения железа из ЖКТ [20].
Другие примеры коморбидных состояний, в которых недостаточность магния играет центральную
роль, приведены в табл. 10. Эти патологии соответствуют преимущественно долговременным последствиям ДМ, приводящим к нарушениям катехоламинового баланса (острое переживание стресса, нарушения сна), развитию атеросклероза и нарушениям структуры соединительной ткани (пролапс митрального клапана, миопия, снижение эластичности сосудов).
Взаимосвязь обеспеченности пациентов магнием и пиридоксином
Была проведена оценка обеспеченности пиридоксином всех пациентов с использованием патентованного структурированного опросника (рационализаторское предложение РФ № 2461 от 17.11.08) [21]. Опросник состоит из 40 пунктов, включающих различные клинические симптомы и состояния; интенсивность выраженности каждого проявления оценивалась 0–3 баллами. Максимальное значение баллов по опроснику составляло 120, сумма в 15–30 баллов соответствовала маргинальному гиповитаминозу В6, 31–50 – выраженному гиповитаминозу В6, 51 и более – глубокому гиповитаминозу В6.
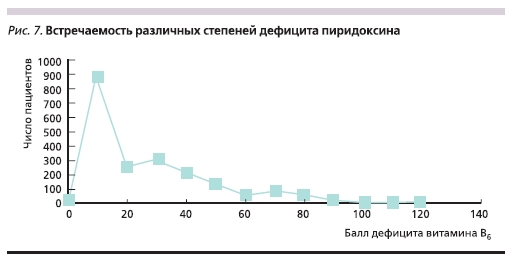
Среднее значение баллов гиповитаминоза в исследованной когорте составило 20 ± 19. Встречаемость
различных степеней дефицита существенно различалась (рис. 7). Значительная часть пациентов (n =
940, 47%) не имели дефицита (сумма баллов менее 15), пациенты с глубоким дефицитом (более 50 баллов) составили всего 16 % от всей выборки (n = 320).
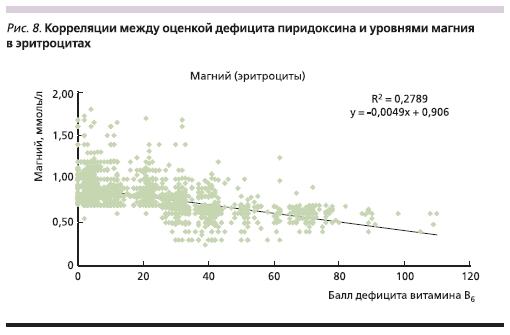
Сопоставление данных по балльной оценке дефицита витамина В6 с уровнями магния в крови показало достоверную обратную корреляцию: более высокая степень дефицита пиридоксина соответствовала более низким уровням магния (рис. 8). При этом корреляция наблюдалась с уровнями как магния в ПК (r = -0,33), так и магния в эритроцитах (r = -0.53). Одной из функций пиридоксина является улучшение всасываемости магния в кишечнике, перенос магния в тканях организма, поэтому дефицит пиридоксина может действительно приводить к усилению потерь магния организмом и, следовательно, снижению уровней магния в крови и других биосубстратах.
Заключение
В настоящем исследовании был проведен скрининг 2000 пациентов, поступивших в медицинские учреждения из 6 регионов России. В ходе скрининга была использована новая информационная технология интеллектуального анализа данных – метод метрических карт, что позволило изучить весь комплекс взаимодействий между уровнями магния в ПК и эритроцитах с остальными 187 параметрами пациентов (анамнестические, антропометрические, демографические, диетологические и другие
данные). ДМ широко распространен в популяции: низкие концентрации магния в ПК были установлены у 47,8 % пациентов, обратившихся в многопрофильные лечебные учреждения. Показано, что в качестве нижней допустимой границы уровня магния в ПК целесообразно использовать значения в диапазоне 0,80–0,85 ммоль/л, т. к. значения ниже 0,80 ммоль/л ассоциированы со статистически значимым повышением риска многочисленных патологий. И наоборот, значения Mg ПК > 0,8 ммоль/л соответствовали достоверному снижению у пациента частоты коморбидных состояний. Данные уровни магния в ПК должны использоваться в качестве референсных значений сетевыми клинико-диагностическими медицинскими лабораториями при рутинной оценке ДМ у различных категорий
населения России. Среднее значение уровня магния в ПК у здоровых пациентов без каких-либо диагнозов составило 0,92 ± 0,07 ммоль/л (95 % ДИ – 0,82–0,96), в эритроцитах – 2,45 ± 0,66 ммоль/л (95 % ДИ 1,71–3,56), а при наличии даже одного диагноза по МКБ-10 уровни магния были значительно снижены (ПК – 0,86 ± 0,19 ммоль/л, эритроциты – 1,74 ± 0,57 ммоль/л). Важно отметить, что высокие уровни магния в ПК (> 1,3 ммоль/л) не были связаны с какими либо патологиями, а соответствовали
нормализации электролитного баланса (уровни К в пределах нормы, отсутствие гипернатриемии). Более низкие уровни магния соответствовали более высокой степени дефицита пиридоксина по опроснику (r = -0.53), что косвенно подтверждает роль пиридоксина как синергиста магния. Убедительно подтвержденная в ходе исследования широкая распространенность ДМ (а также сопутствующего дефицита пиридоксина – витамина В6), ассоциированная с множеством серьезных заболеваний и патологических состояний, с позиций доказательной медицины диктует необходимость применения лекарственных средств, содержащих органические соли магния (пидолат, цитрат) вместе с витамином В6 для устранения и предупреждения ДМ.
Таблица 10. Примеры коморбидных взаимодействий между диагнозами, связанными с магний-дефицитными состояниями.
Такими лекарственными средствами являются французские препараты Магне В6 форте и Магне В6 (питьевой раствор), содержащие органические соли магния в комбинации с витамином В6 (пиридоксином). Ампульная форма Магне В6 (питьевой раствор) содержит пидолат магния и пиридоксин, что обеспечивает быстрое повышение уровня магния в плазме крови (в течение 2–3 часов), для быстрой ликвидации магниевого дефицита. В состав таблеток Магне В6 форте входит цитрат магния и пиридоксин. Цитрат магния – одна из органических солей, используемых для изготовления современных магнийсодержащих препаратов – характеризуется рядом существенных преимуществ в использовании, перед лактатом магния и, особенно, перед неорганическими солями магния (оксид магния, сульфат магния, хлорид магния). Цитрат магния – соль лимонной кислоты с высокой биодоступностью магния, ощелачивающая рН крови, мочи и синовиальной жидкости. Цитрат
нормализует баланс водной и минеральной фракции мочи, способствует уменьшению кристаллообразования в моче. Цитрат играет роль в цикле Кребса (“цитратный цикл”). В таблетках Магне В6 форте содержится 100 мг элементного магния, что дает возможность использовать 3–4 таблетки в день. Восполнение дефицита магния органическими солями (цитрат магния, пидолат магния) является эффективной мерой в комплексной терапии пациентов многопрофильных лечебно-профилактических учреждений.
Дополнительные наблюдательные и интервенционные контролируемые исследования необходимы с целью пополнения объема данных о влиянии терапии органическими солями магния на контроль и профилактику различных заболеваний, способствующие повышению качества жизни пациентов.



