Введение
В настоящее время выделяют следующие синдромы когнитивных расстройств: деменция – грубые нарушения когнитивных функций, и недементные (додементные) расстройства, когда когнитивные нарушения еще не достигли степени деменции (главный критерий – отсутствие социальной, бытовой или профессиональной дезадаптации), но уже приводят к затруднениям при осуществлении сложных повседневных действий и обучении [4, 24, 25, 37].
В нашей стране додементные когнитивные расстройства (ДКР) подразделяют на “легкие когнитивные нарушения” [24] и “умеренные когнитивные нарушения” [28]. В иностранной литературе ДКР часто называют “mild cognitive decline (impairment)” – “мягкое” когнитивное снижение.
Клиническая значимость ДКР состоит в том, что у большинства пациентов со временем наблюдается прогрессирование с развитием деменции. Примерно у 10–15 % пациентов с ДКР в течение года развиваются признаки того или иного варианта деменции [27, 37]. С другой стороны, примерно в 20–40 % случаев ДКР при динамическом наблюдении и лечении отмечается не ухудшение, а улучшение когнитивных функций.
Существует масса этиологических факторов, которые приводят к развитию когнитивного снижения [12]. Описано свыше 100 заболеваний, которые могут сопровождаться развитием деменции [5, 35]. Основными причинами деменции являются нейродегенеративные или сосудистые заболевания мозга и смешанные сосудисто-дегенеративные процессы [32, 34]. Причинами же легкого когнитивного снижения могут выступать гипоксические процессы на фоне сердечнососудистой патологии или легочной недостаточности. Существуют понятия “деменции после глобальной ишемии мозга в результате остановки сердца”, “деменция после длительных оперативных вмешательств” и др. [10]. Большое количество когнитивных расстройств встречается на фоне метаболических нарушений – при патологии щитовидной железы [17, 29, 39], сахарном диабете, патологии печени и почек. Много дефицитарных состояний (недостаточность витаминов В12, В1, В6 [30], фолиевой [40], никотиновой кислот [31] и др.) также могут приводить к снижению когнитивного потенциала. Возможно развитие псевдодеменции на фоне депрессии. Снижению когнитивных функций способствуют токсические воздействия (алкоголь [6], медикаментозные средства, наркотики [7] и др.), побочное действие наркоза (послеоперационная когнитивная дисфункция [22]).
ДКР в большинстве своем являются вторичными или симптоматическими, причем врачи общей практики и терапевты сталкиваются с данной патологией в первую очередь.
Кроме того, врачи общей практики должны знать о возможных лекарственных ятрогениях, когда в результате некорректного назначения или приема медикаментов развивается когнитивное снижение (например, назначение ноотропных препаратов во второй половине дня приводит к нарушению качества сна, как результат – нарушение бодрствования и когнитивной активности).
Многообразие причин развития когнитивного снижения определяет разнообразие терапевтических подходов при данной патологии.
Терапия ДКР, чтобы быть эффективной, должна быть этиопатогенетической и включать коррекцию имеющихся дисметаболических нарушений [3, 5, 8], сосудистых факторов риска (стабилизация артериальной гипертензии, атеросклероза церебральных артерий и других сердечно-сосудистых заболеваний [13, 38]), лечение депрессии [36], применение антиоксидантов, вазоактивных [26], метаболических средств и препаратов [14, 15], влияющих на нейротрансмиттерные системы (ингибиторы ацетилхолинэстеразы, блокаторы NMDA-рецепторов к глютамату [33], агонисты дофаминовых рецепторов).
Так, с чего же начинать? Что выбрать врачу общей практики в этом огромном арсенале? Какие медикаменты являются препаратами первого выбора, а какие можно отнести к препаратам резерва? Именно на эти вопросы мы постарались ответить в статье.
Целью представленного ниже исследования являлась разработка алгоритма целесообразных терапевтических действий врача общей практики при ДКР различного генеза.
Материал и методы
В исследование были включены 114 амбулаторных и стационарных пациентов в возрасте от 18 до 60 лет с легкими и умеренными ДКР. В рамках обследования изучался неврологический статус по общепринятой методике, проводилось нейропсихологическое тестирование [19]. Все обследуемые пациенты были разделены на четыре клинические группы:
- ДКР на фоне хронической сосудистой патологии (ХСП) – начальных проявлений недостаточности кровоснабжения мозга и дисциркуляторной энцефалопатии 1 [18];
- ДКР на фоне последствий мозговых катастроф (ПМК) – острых нарушений мозгового кровообращения (ОНМК), черепно-мозговых травм (ЧМТ);
- ДКР на фоне психо-вегетативного синдрома (ПВС);
- ДКР на фоне токсических, дисметаболических, гипоксических энцефалопатий (ТДГЭ).
При разделении на группы кроме клинических критериев мы опирались на изменения, выявленные на компьютерной и/или магнитно-резонансной томографии головного мозга, данные дуплексного сканирования брахиоцефальных артерий, клинические и биохимические исследования крови.
Нейрометаболизм мозга оценивался методом “Нейроэнергокартирование” (НЭК) с использованием аппаратно-программного комплекса НЕЙРОЭНЕРГОКАРТОГРАФ в 12 стандартных отведениях. Активность нейрометаболизма оценивалась по фоновому уровню постоянных потенциалов, проводились функциональные афферентные пробы: трехминутная гипервентиляция с постгипервентиляционным периодом, тест быстрой словесности [21]. Всего методом НЭК были обследованы 104 пациента с ДКР различного генеза (по 26 пациентов в каждой из 4 клинических групп). В контрольную группу вошли 20 здоровых добровольцев, сопоставимых по возрасту и половой принадлежности с клиническими группами пациентов.
Для оценки перфузии головного мозга проведена однофотонная эмиссионная компьютерная томография на двухдетекторной гамма-камере ECAM фирмы “Siemens”. Для визуализации мозговой перфузии использовался Теоксим Тс-99, который вводился внутривенно струйно в дозе 740 мБк. Сканирование проводилось в статическом режиме в течение 35 минут с постинъекционной задержкой не менее 15 минут.
Результаты и обсуждения
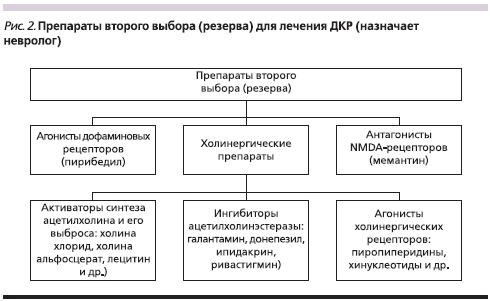
Основными классами препаратов, рекомендуемыми для лечения когнитивных расстройств, являются ноотропы, нейротрофические, нейрометаболические препараты, антиоксиданты, вазоактивные препараты, медикаменты с разнонаправленным действием, комбинированные препараты. Все перечисленные классы лекарственных средств являются неспецифической терапией когнитивных расстройств, препаратами первого выбора (рис. 1). Но существуют и специфические лекарственные средства, используемые для лечения только данной патологии (рис. 2). Это препараты, влияющие на уровень ацетилхолина: ипидакрин, ривастигмин, донепезил, галантамин и др., которые могут быть назначены при ДКР, но способны при этом усиливать депрессию. Это также антагонисты NMDA-рецепторов (мемантин), которые предпочтительно назначать при выраженных расстройствах когнитивных функций, деменциях. Это наконец агонисты дофаминовых рецепторов (пирибедил). По нашему мнению, назначать специфическую терапию должен врач-невролог. Если же эти средства назначает врач общей практики, то по крайней мере они не должны быть препаратами первого выбора и начинать лечение следует с неспецифической терапии.
Рисунок 1. Препараты первого выбора для лечения ДКР врачом общей практики или неврологом.
Предлагаемый нами алгоритм терапевтических действий описывает использование неспецифической терапии ДКР, препаратов первого выбора. Мы посчитали необходимым внести в алгоритм препараты, влияющие на психо-эмоциональный статус. В него включены также медикаменты, корректирующие дефицитарные состояния.
Ноотропы
По определению ВОЗ, ноотропные препараты – это средства, оказывающие прямое активирующее влияние на когнитивные функции, а также повышающие устойчивость мозга к агрессивным воздействиям.
По мнению ряда авторов, все препараты, применяемые для защиты головного мозга от экзогенных и эндогенных повреждающих факторов, объединяются общим названием “ноотропы”, имеют при этом разные точки приложения и обладают разнообразными эффектами [23].
Кроме лечения ДКР ноотропные средства применяют и при лечении деменции различного генеза, хронической цереброваскулярной недостаточности, психоорганического синдрома, последствий ОНМК, ЧМТ, интоксикации, астено-депрессивного синдрома, невротических и неврозоподобных расстройств, вегетососудистой дистонии [11, 20].
В основе терапевтического действия ноотропных препаратов лежит несколько механизмов: коррекция энергетического обмена путем снижения повреждающего действия гипоксии, уменьшения энергетической потребности нейронов; активация пластических процессов в ЦНС; стимуляция окислительно-восстановительных процессов и усиление утилизации глюкозы; уменьшение интенсивности свободнорадикального перекисного окисления липидов; стимуляция системы нейротрансмиттеров и нейромодуляторов; торможение высвобождения возбуждающих медиаторов (глутамата, аспартата), обладающих эксайтотоксическим действием. В целом можно сказать, что ноотропные препараты обладают активирующим действием на церебральный метаболизм и высшие психические функции [2, 9, 16].
С одной стороны, активация церебрального метаболизма имеет позитивное значение, но стоит обратить внимание, что в некоторых случаях стимулировать метаболизм мозга не следует. В первую очередь это касается состояний и заболеваний, провоцирующих судорожную готовность мозга. Это последствия ЧМТ и ОНМК, алкоголизм и токсикомании, выраженные нейродегенартивные и/или атрофические процессы головного мозга. Кроме того, активируя психические функции, при некорректном назначении ноотропы способны повышать тревожность и провоцировать психо-вегетативные пароксизмы, нарушать сон пациентов.
Наши исследования функционального метаболизма при ДКР выявили следующую картину (рис. 3). Оказалось, что более чем в половине случаев (59 %) имеет место повышение метаболизма, что говорит о напряженности энергетических процессов, включении резервного пути метаболических процессов (анаэробный катаболизм глюкозы, катаболизм кетоновых тел и аминокислот). Очевидно, что в такой ситуации назначать препараты, интенсивно стимулирующие и без лесообразно. Назначив большие дозы ноотропных препаратов, мы будем, что называется, “стегать загнанную лошадь”. Нормальный метаболизм был выявлен в 24 % случаев, пониженный – в 17 %.
Рисунок 3. НЭК п-та Р.Д., 44 года. Динамика фоновых показателей метаболизма в процессе лечения.
Исходя из этого, в алгоритме терапевтических действий (см. таблицу) использование большинства ноотропов при ДКР должно проводиться с осторожностью – т. е. в небольших дозах, недлительными курсами, под контролем ЭЭГ и по возможности НЭК.
Таблица.Алгоритм терапевтических действий врача общей практики при ДКР различного генеза.
Счастливым исключением из этого правила можно считать ГАМКергические ноотропы, которые не провоцируют усиления судорожной готовности, не стимулируют, а оптимизируют энергетическую и метаболическую активность головного мозга. Такая особенность данных препаратов позволяет широко использовать их у пациентов с ЧМТ и последствиями ОНМК, не опасаясь развития эпилептических приступов [1].
Коррекция психо-эмоциональных нарушений
Поскольку в большинстве случаев при ДКР регистрируется повышение метаболизма мозга, становится очевидным, что практически во всех случаях целесообразна коррекция психо-эмоционального, вегетативного статуса пациентов.
Именно на основании полученных нами данных, а также практического клинического опыта мы посчитали целесообразным рекомендовать в алгоритме терапевтических действий коррекцию психо-эмоционального статуса в большинстве случаев ДКР различного генеза.
В ситуациях же, когда когнитивное снижение обусловлено психо-вегетативными причинами (эмоциональный стресс, переутомление, нарушения сна, социальная дезадаптация, информационный стресс), к применению психотропных средств для коррекции нарушений психо-эмоциональной сферы имеются абсолютные показания. Если функционально мозг перевозбужден, регистрируются повышение уровня постоянных потенциалов, ацидоз, оксидативный стресс, следует снижать функциональную активность мозга седативными препаратами, антидепрессантами, антиоксидантами, гипнозом, психотерапевтическими методами, исходя из вида и степени выраженности патологии. И совершенно очевидно, что в этой ситуации нецелесообразно стимулировать функциональную активность мозга, на какие бы усталость, утомляемость, снижение памяти и рассеянность ни жаловался пациент.
Это относится и к назначению стимулирующих психотропных средств, например стимулирующих антидепрессантов, таких как флуоксетин.
Рассмотрим клинический пример. Пациент Р.Д. 44 лет обратился с жалобами на снижение работоспособности и концентрации внимания, раздражительность, быструю утомляемость, расстройство сна. Кроме того, у пациента появились приступы учащенного сердцебиения, головокружения, дурноты, повышенной потливости, слабости, выраженного беспокойства за свое здоровье.
Из анамнеза удалось выяснить, что у больного ответственная и напряженная работа, причем 2 месяца назад он переехал в новый душный офис без окон.
Объективный статус: очаговых патологических неврологических симптомов нет, вегетативная лабильность перманентно-пароксизмального характера. Проведено обследование: ЭКГ, клинический минимум лабораторных анализов, магнитно-резонансная томография головного мозга (по настоятельной просьбе пациента), осмотр глазного дна – патологии не выявлено. По данным ЭЭГ – дисфункция неспецифических срединных структур мозга. По данным НЭК – выраженный оксидативный стресс, выраженная реакция на гипервентиляцию, отсутствие восстановления в постгипервентиляционном периоде.
Клинический диагноз: дисфункция вегетативной нервной системы перманентно-пароксизмального характера. Психо-вегетативный синдром с приступами панических атак средней частоты. Легкие когнитивные расстройства.
Несмотря на то что пациент настаивал на назначении ему “стимулирующих работоспособность” медикаментов, с учетом данных НЭК ему была проведена седативная терапия, в т. ч. курсы антидепрессанта, антиоксиданта, физиотерапия. Уже через 7 дней лечения пациент почувствовал значительное облегчение. Через 18 дней проведено контрольное НЭК и назначена поддерживающая терапия. Пациент наблюдался у невролога несколько месяцев с хорошим положительным результатом, нормализацией самочувствия и состояния. Динамика НЭК представлена на рис. 3.
Антиоксиданты
Полученные данные о напряженности метаболических процессов при ДКР, включении резервного пути энергообмена и развитии ацидоза (в 59 % случаев) говорят о нецелесообразности широкого использования в лечении ДКР препаратов, активно стимулирующих нейрометаболизм (большие дозы ноотропов, стимулирующие психотропные средства). Для оптимизации метаболизма и перевода энергетических процессов на эффективный путь следует использовать универсальные нейрометаболические лекарственные средства. Препаратами первого выбора в такой ситуации для всех категорий ДКР являются антиоксиданты. Целесообразность использования антиоксидантов обусловлена еще и тем, что, блокируя действие свободных радикалов, они потенциально могут улучшать перфузию мозга, способствуя сопряжению нейронов и сосудов [13].
Вазоактивные средства
Как следует из полученных данных, у пациентов с ДКР в 48 % случаев регистрируется нормальная перфузия головного мозга. У 9 % больных выявлено диффузное снижение перфузии, которое, как правило, наблюдается при функциональном снижении кровенаполнения мозга на фоне уменьшения его энергетической активности или при измененной ауторегуляции мозговых функций. Наибольший интерес с клинической точки зрения представляют случаи локального снижения перфузии (43 % пациентов).
При анализе состояния перфузии в разных клинических группах ДКР мы получили следующую картину (рис. 4).
Чаще всего локальное снижение перфузии определяется при ДКР на фоне ХСП и ПМК (в 48 и 55 % случаев соответственно). Таким образом, нарушения перфузии мозга играют важную роль и являются ключевыми в патогенезе формирования ДКР у больных с ХСП и ПМК. Именно представителям этих клинических групп целесообразно широкое назначение вазоактивных медикаментозных средств.
Нормальные показатели перфузии мозга чаще всего наблюдаются при ДКР на фоне ПВС, что доказывает функциональный характер когнитивных нарушений и целесообразность назначения препаратов, стабилизирующих психо-эмоциональный и психо-вегетативный статус пациентов. Нарушения перфузии мозга в данной клинической группе играют важную роль, но не являются ключевыми в патогенезе формирования ДКР.
Как известно, стимулируют перфузию мозга в первую очередь средства, улучшающие реологические свойства крови. В то же время пока нет доказательств того, что вазоактивные средства стойко улучшают перфузию мозга [13]. Однако есть данные, что статины, ингибиторы ангиотензин-превращающего фермента и блокаторы ангиотензиновых рецепторов (периндоприл) повышают реактивность мелких сосудов, способствуя феномену рабочей (функциональной) гиперемии [41].
Коррекция дефицитарных состояний
Коррекцию возможных дефицитарных состояний (недостаточность витаминов В1, В6, В12, фолиевой, никотиновой кислот и др.) следует проводить всегда, когда на основании данных анамнеза жизни и заболевания врач может предположить наличие таких состояний. Если пациент применяет редуцированные диеты, недоедает, страдает заболеваниями желудочно-кишечного тракта (ЖКТ) с нарушениями переваривания и всасывания питательных веществ, страдает алкоголизмом, употребляет наркотики, то даже при невозможности лабораторно доказать наличие дефицитарного состояния следует проводить его коррекцию ex juvantibus. Курсы внутримышечных инъекций никотиновой кислоты, пиридоксина, тиамина, цианкоболамина, пероральный прием фолиевой кислоты целесообразны при лечении ДКР на фоне предположительных дефицитарных состояний.
Заключение
Таким образом, с учетом особенностей метаболизма, перфузии головного мозга, состояния психо-эмоционального статуса при тех или иных ДКР мы предлагаем алгоритм терапевтических действий, использования препаратов первого выбора врачом общей практики при ДКР. В алгоритме определены абсолютные и относительные показания к применению лекарственных средств первого выбора. В отношении некоторых классов препаратов даны рекомендации “использовать с осторожностью”.
Следует подчеркнуть, что все рекомендации даются для этиологически детерминированных вариантов ДКР. Однако на практике мы нередко сталкиваемся с полиэтиологичностью возникновения когнитивных нарушений. Например, при алкоголизме ДКР является этиологически не только токсическим, но и дисметаболическим (для алкоголиков характерно наличие патологии ЖКТ, у них нарушено всасывание питательных веществ, часты нарушения диеты), гипоксическим (т. к. возможны эпилептические припадки алкогольного генеза), иногда развиваются на фоне ЧМТ. Безусловно в случаях смешанного генеза ДКР следует выбирать препараты, исходя из преобладания того или иного этиологического фактора в процессе формирования ДКР, с учетом всех противопоказаний к использованию медикаментов.
Для улучшения когнитивного статуса у пациентов с ДКР, профилактики прогрессирования патологии немедикаментозным методом лечения с доказанной эффективностью является создание когнитивного резерва. Это значит, что пациент должен занимать активную жизненную позицию, много работать интеллектуально, иметь эмоционально насыщенную жизнь, богатую социальными связями и общением [13].
Выводы
- Врачи общей практики часто сталкиваются с проблемой когнитивных расстройств, должны знать основы диагностики и терапии данной патологии. ДКР в большинстве своем являются вторичными или симптоматическими, а значит, именно врачи общей практики и терапевты сталкиваются с данной патологией в первую очередь.
- Начинать терапию ДКР необходимо с выяснения этиологии синдрома когнитивного снижения. Исходя из выявленной этиологии, на основании предлагаемого нами алгоритма терапевтических действий проводят этиопатогенетическое лечение.
- Терапия ДКР должна начинаться с назначения препаратов первого выбора (антиоксидантов, адаптогенов, ноотропов, вазоактивных средств), коррекции дефицитарных состояний и психо-эмоциональных расстройств. Медикаментозные средства, влияющие на нейротрансмиттерные системы, мы относим к препаратам второго ряда (резерва) и считаем, что их должен назначать врач-невролог.
- Наиболее патогенетически обоснованным для пациентов с ДКР различного генеза является назначение препаратов, способствующих оптимизации метаболических процессов. В первую очередь речь идет о широком использовании антиоксидантов и антигипоксантов. Это самая универсальная группа препаратов, показанных при всех этиопатогенетических вариантах ДКР; именно с этих лекарственных средств следует начинать лечение ДКР.
- Ноотропы и нейротропные препараты, стимулирующие метаболизм, следует назначать лишь в небольших терапевтических дозах. В случаях ДКР на фоне токсических энцефалопатий, последствий ОНМК и ЧМТ ноотропы следует назначать с осторожностью и под контролем ЭЭГ. Исключение составляют ГАМКергические ноотропы (фенибут, пантогам и т. п.) и ноотропы, действующие на возбуждающие аминокислоты (такие как глицин), которые можно назначать более широко.
- Нарушения перфузии мозга играют важную роль, но не являются ключевыми в патогенезе формирования многих ДКР. Широкое назначение вазоактивных средств целесообразно лишь при ДКР, развившихся на фоне хронической сосудистой патологии и последствий мозговых катастроф (ОНМК, ЧМТ).
- Для коррекции измененного метаболизма и неадекватных психо-эмоциональных реакций, являющихся причиной формирования ДКР, целесообразно применение психотерапевтических методов и медикаментов, корригирующих (по показаниям) психо-эмоциональный и вегетативный статус. Психотропные средства следует назначать после консультации пациента неврологом. Необходимо помнить, что неадекватное назначение психотропных средств само по себе способно вызывать расстройство когнитивных функций.
- Если на основании анамнеза врач может предположить наличие у пациента дефицитарного состояния (патологию ЖКТ, редуцированные диеты и недоедание, злоупотребление алкоголем и т. п.), даже при невозможности лабораторно подтвердить его целесообразно назначать терапию, корректирующую дефицитарное состояние ex juvantibus.
- Во всех случаях додементных когнитивных нарушений важна своевременная коррекция неэффективного метаболизма.
Информация об авторах:
Соколова Любовь Петровна – кандидат медицинских наук, врач-невролог консультативного отделения
ФГУ “Клиническая больница № 1” УД Президента РФ, докторант кафедры неврологии
Учебно-научного методического центра УД Президента РФ.
E-mail: lsocolova@yandex.ru;
Шмырев Владимир Иванович – доктор медицинских наук, профессор ФГУ “Учебно-научный
методический центр” УД Президента РФ, главный специалист-невролог, заведующий
кафедрой неврологии УНМЦ УД Президента РФ



