Введение
Проблема хронического гастрита интересна и многолика. Пожалуй, ни одно из заболеваний желудочно-кишечного тракта не претерпевало таких дефинициальных изменений от «хронической флегмозии» и причины смерти в наполеоновскую эпоху (Broussais F., 1808) до хронического инфекционного заболевания слизистой оболочки желудка (СОЖ), вызванной прежде всего бактерией Helicobacter pylori (Marshall В. и Warren J., 1984), от функционального заболевания до формирования его «морфологической сущности». На сегодняшний день мы говорим о хроническом гастрите как о наиболее распространенном заболевании верхних отделов пищеварительного тракта, которое морфологически характеризуется воспалительными, дистрофическими и дисрегенераторными процессами в СОЖ [1, 2].
Для постановки правильного диагноза в первую очередь необходимо уточнение топики поражения, т.к. это оказывает влияние на выбор тактики лечения и выживаемость пациентов. Во-вторых, мы обязательно исследуем морфологические особенности инфильтрата, а именно наличие, распространенность (антральный отдел, тело желудка) и выраженность атрофических изменений СОЖ (рис. 1).

Ключевой этап на пути к диагнозу – установление этиологии заболевания для его дальнейшего лечения и разработки плана наблюдения за пациентом. Несомненно, H. pylori вызывает прогрессирующее повреждение СОЖ и в настоящее время воспринимается как причинный фактор при ряде серьезных заболеваний, включая язвенную болезнь и ее осложнения, а также рак желудка [3]. Но мы знаем, что еще в 1947 г. в своей монографии «Гастриты» R. Schindler, анализируя и сопоставляя эндоскопические и гистологические картины повреждения СОЖ, пишет о других возможных его причинах (дуодено-гастральный рефлюкс, нарушение кровоснабжения и др.).
Ключевым моментом при анализе и систематизации этиологических факторов хронического гастрита, оценке взаимосвязи структурных и функциональных изменений, патоморфологической картины внес в 2015 г. Киотский консенсус [4]. Была подчеркнута важность не только инфекции H. pylori, но и других форм гастрита, в число которых входит и аутоиммунный гастрит (АИГ).
Целью данной публикации стала актуализация информации по диагностике и лечению АИГ в медицинской практике (врача-терапевта и гастроэнтеролога) на конкретном клиническом примере.
Клинический случай
Пациентка Б. 1967 г. рождения обратилась к врачу с жалобами на тяжесть, распирающие боли в эпигастральной области через 30 минут после приема пищи, жжение в эпигастрии, изжогу после приема экстрактивной пищи. Вес пациентки стабилен, аппетит сохранен, стул ежедневный, оформленный, без патологических примесей. Со стороны других систем органов жалоб не предъявляла.
Из анамнеза заболевания известно, что жалобы на тяжесть и жжение в эпигастральной области впервые появились в 2016 г. При проведенной амбулаторно эзофагогастродуоденоскопии (ЭФГДС) были выявлены изменения в виде катарального дистального эзофагита, недостаточности кардии, гастрита с наличием эрозий в теле и верхней трети желудка (изменения слабые, на фоне субатрофии слизистой оболочки антрума), рубцовой деформации луковицы двенадцатиперстной кишки (ДПК), бульбита. Ранее эндоскопического исследования желудка, со слов пациентки, не проводилось, в связи с чем установление давности язвенной болезни ДПК не представляется возможным. При морфологическом исследовании гастробиоптата, взятого из антрума, выявлены поверхностные фрагменты слизистой оболочки антрального отдела желудка с наличием слабой мононуклеарной воспалительной инфильтрации собственной пластинки; колонизация H. pylori не выявлена. По результатам общего и биохимического анализов крови патологии выявлено не было. Пациентка наблюдалась с диагнозом «гастроэзофагеальная рефлюксная болезнь, неэрозивная форма, неосложненное течение. Недостаточность кардии. Хронический H. pylori – негативный гастрит со слабой атрофией антрального отдела и наличием эрозий тела и верхней трети желудка. Язвенная болезнь ДПК в анамнезе: рубцовая деформация луковицы ДПК». Была проведена беседа о возможных побочных эффектах от приема препаратов, обладающих повреждающим действием на слизистую оболочку желудка и ДПК (ацетилсалициловая кислота, нестероидные противовоспалительные препараты) [5], прием которых больная отрицала. Пациентка получала ингибиторы протонной помпы, препараты висмута трикалия дицитрата в стандартной дозировке в течение 4 недель, что привело к полному заживлению эрозий по результатам контрольной ЭФГДС. Рекомендовано повторное проведение ЭФГДС через год с забором биоптатов по стандартному протоколу для мониторинга атрофии СОЖ.
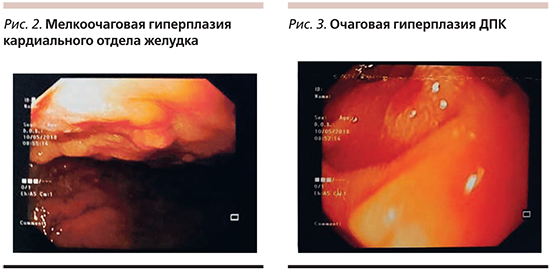
При проведении ЭФГДС в декабре 2017 г. выявлено: пищевод свободно проходим, просвет округлой формы, складки продольные, расправляются воздухом, стенки эластичные, слизистая оболочка бледно-розового цвета, кардия зияет; желудок в форме крючка средних размеров, свободно расправляется воздухом, стенки эластичные, складки извиты, средние по высоте, перистальтика умеренная, прослеживается во всех отделах, СОЖ пятнисто гиперемирована, в кардиальном отделе мелкоочаговая гиперплазия слизистой оболочки 2–3 мм (рис. 2), пилорус в виде овального отверстия, смыкается; ДПК – луковица округлой формы, просвет кишки овальный, складки циркулярные, слизистая оболочка проксимального отдела умеренно гиперемирована, большой дуоденальный сосочек не изменен, в нисходящей ветви по латеральному краю имеется приподнято-плоское образование до 5–6 мм (рис. 3), поверхность гиперемирована. Заключение по ЭФГДС: недостаточность кардии, диффузный поверхностный (эритематозный) гастрит, мелкоочаговая гиперплазия кардиального отдела желудка, дуоденит, очаговая гиперплазия ДПК.
Эндоскопический забор фрагментов СОЖ проведен в соответствии с рекомендациями (протоколом) OLGA-system [6]: три биоптата из антрального отдела (большая и малая кривизна, угол желудка) и два биоптата из тела желудка (передняя и задняя стенки). После процедур стандартной проводки материала и заливки в парафин выполнено окрашивание гистологических срезов гематоксилином и эозином. Для выявления H. pylori применяли окраску 0,1%-ным толуидиновым синим, использовали альциановый синий (рН=2,5) в сочетании с ШИК-реакцией для определения очагов кишечной и псевдопилорической метаплазии. При исследовании биопсийного материала обнаружены умеренная мононуклеарная воспалительная инфильтрация, признаки атрофии желез умеренной степени как в антральном отделе, так и в теле желудка.
 При этом в антральном отделе отмечено наличие неметапластической атрофии, характеризовавшейся укорочением желудочных (пилорических) желез с признаками фиброза собственной пластинки. В теле желудка количественный дефицит желез сочетался с признаками метапластической атрофии, хорошо выявляемой при использовании дополнительных гистохимических окрасок (рис. 4): оригинальные фундальные железы очагово были замещены слизепродуцирующим цилиндрическим эпителием, напоминающим пилорические железы (псевдопилорическая метаплазия), а также кишечным эпителием с наличием бокаловидных клеток и щеточной каемки (полная кишечная метаплазия, тип I). Колонизация H. pylori при гистобактериоскопии не выявлена. Во фрагменте ДПК – сохранная гистоархитектоника, умеренная лимфоплазмоцитарная инфильтрация собственной пластинки с примесью эозинофильных лейкоцитов.
При этом в антральном отделе отмечено наличие неметапластической атрофии, характеризовавшейся укорочением желудочных (пилорических) желез с признаками фиброза собственной пластинки. В теле желудка количественный дефицит желез сочетался с признаками метапластической атрофии, хорошо выявляемой при использовании дополнительных гистохимических окрасок (рис. 4): оригинальные фундальные железы очагово были замещены слизепродуцирующим цилиндрическим эпителием, напоминающим пилорические железы (псевдопилорическая метаплазия), а также кишечным эпителием с наличием бокаловидных клеток и щеточной каемки (полная кишечная метаплазия, тип I). Колонизация H. pylori при гистобактериоскопии не выявлена. Во фрагменте ДПК – сохранная гистоархитектоника, умеренная лимфоплазмоцитарная инфильтрация собственной пластинки с примесью эозинофильных лейкоцитов.
По критериям OLGA-system морфологические признаки хронического гастрита соответствовали степени III, стадии III.
Из анамнеза жизни известно, что пациентка родилась в Омской области доношенным, здоровым ребенком, работает. Туберкулез, вирусный гепатит, венерические заболевания отрицает. Травм, операций не было. Гемотрансфузии отрицает. Аллергологический, наследственный анамнез не отягощены. Из сопутствующих заболеваний – аутоиммунный тиреоидит, эутиреоз (уровень тиреотропного гормона, свободного Т3 и Т4 в норме).
При осмотре состояние пациентки удовлетворительное, сознание ясное, телосложение правильное, тип конституции смешанный, питание достаточное. Рост – 166 см, вес – 70,0 кг, индекс массы тела – 25,4 кг/м2. Кожные покровы бледно-розового цвета, сухие. Видимые слизистые оболочки бледные, чистые. Зев бледно-розового цвета, чистый, миндалины не увеличены. Лимфоузлы не пальпируются. Щитовидная железа 0-й степени по ВОЗ. Суставы не деформированы, ограничений активных и пассивных движений нет. Позвоночник искривлен (сколиоз), при пальпации безболезненный. Грудная клетка симметричная неправильной формы, сколиотическая. Перкуторно над легкими ясный легочный звук. Дыхание везикулярное, хрипов нет. Границы сердца в норме. Тоны сердца ритмичные, приглушены, 70 в минуту. Артериальное давление 130/70 мм рт.ст.
Язык влажный, обложен густым бело-желтым налетом у корня. Живот при поверхностной пальпации мягкий, безболезненный. При глубокой пальпации болезненность в эпигастрии, в проекции антрального отдела желудка. Симптомы напряжения брюшины отрицательные. Симптомы желчного пузыря: Кера, Ортнера – отрицательные, Мерфи – слабоположительные. Печень не увеличена, край гладкий, эластичный, безболезненный. Поджелудочная железа при пальпации по Гроту безболезненная. Селезенка не пальпируется. Почки не пальпируются. Симптом поколачивания отрицательный с обеих сторон. Отеков нет.
Таким образом, мы наблюдаем у пациентки с синдромом эпигастральной боли атрофические изменения слизистой оболочки антрального отдела и тела желудка с большей выраженностью морфологических изменений в теле, сочетание разнообразных форм атрофии (абсолютной в антральном отделе и метапластической в теле). Дважды проведенные эндоскопическое и морфологическое исследования говорят нам об отсутствии инфекции H. pylori, что стало причиной поиска других причин формирования подобных изменений. И безусловно, опираясь на данные о наличии атрофии слизистой оболочки тела желудка, мы рассмотрели возможность аутоиммунного характера заболевания.
Обсуждение
Впервые об атрофическом АИГ сообщил Томас Аддисон, который в 1849 г. описал «выдающуюся форму анемии», позднее названную пернициозной. В 1860 г. Флинт связал ее с развитием атрофии СОЖ. Успешное лечение сырой печенью позволило предположить, что мегалобластная анемия была вызвана недостаточностью внешнего (витамина В12) и внутреннего факторов Кастла в желудочном соке. Открытие антител к внутреннему фактору Шварцем в 1960 г. и антител к париетальным клеткам Ирвиным в 1962 г. обосновало иммунологическую природу атрофического гастрита, приводящего к пернициозной анемии [7, 8]. АИГ был описан в 1965 г. O.R. Mclntyre et al. у пациентов с пернициозной анемией, у которых выявляли гистаминоустойчивую ахлоргидрию, атрофию СОЖ и антитела к внутреннему фактору Кастла [9].
Распространенность АИГ в популяции составляет от 1 до 5%, по некоторым данным – до 15%, однако широкомасштабных эпидемиологических исследований, посвященных этому заболеванию, до сих пор проведено не было [10–12]. Указывалось, что возникновение АИГ ассоциировано с населением Северной Европы, однако последние исследования не поддерживают подобную этническую кластеризацию также ввиду недостаточности эпидемиологических данных. Однако все исследователи сходятся во мнении о частой встречаемости АИГ у лиц женского пола старшей возрастной группы, как и в нашем клиническом примере.
Клинические проявления АИГ можно представить в виде гастроэнтерологического, гематологического и неврологического синдромов, что обусловлено прогрессирующей атрофией СОЖ с постепенным угасанием активной желудочной секреции и выработки фактора Кастла, необходимого для усвоения витамина В12. Течение заболевания может быть и бессимптомным. Гастроэнтерологический синдром характеризуется симптомами желудочной диспепсии: тяжесть в эпигастральной области, возникающая во время или вскоре после еды, а также снижение аппетита, отрыжка (пустая, горького вкуса, с неприятным запахом), редко – тошнота и рвота, приносящая облегчение [13].
У пациентов с развернутым АИГ может наблюдаться железодефицитная анемия с типичными проявлениями в виде слабости, головокружения, сидеропенических симптомов. Гипохромная анемия (у 15% пациентов) может быть вызвана ахлоргидрией, т.к. соляная кислота важна для абсорбции негемового железа, составляющего две трети необходимого суточного количества железа у лиц, придерживающихся «западного типа питания» [14]. В связи с повышенной потребностью в железе в молодом возрасте и у половозрелых женщин его дефицит может предшествовать таковому кобаламина в течение многих лет – до тех пор, пока потеря внутреннего фактора не станет критичной для тех больных, у кого развивается типичная пернициозная анемия, в некоторых случаях сопровождающаяся гастроэнтерологическими симптомами (эрозии желудка) и фуникулярным миелозом.
Отсутствие патогномоничных клинических признаков АИГ обосновывает важность оценки эндоскопических и морфологических изменений СОЖ в теле и антральном отделе. СОЖ демонстрирует изменения от минимальных воспалительных до выраженной атрофии, максимально проявляющейся в теле желудка, с псевдополипозными и/или полипозными разрастаниями, что связано с чередованием атрофических участков СОЖ и гипертрофированных участков обкладочных и G-клеток, активизирующихся в условиях снижения секреции соляной кислоты.
При гастроскопии СОЖ истонченная, бледная с сероватым оттенком, складки слизистой оболочки продольные, извитые, просвечивают сосуды подслизистого слоя, могут обнаруживаться полипы (гиперпластические, аденоматозные и др.) [15, 16].
При исследовании биопсийного материала на ранних стадиях в слизистой оболочке тела желудка наблюдается многофокальная лимфоплазмоцитарная инфильтрация с проникновением в более глубокую железистую часть. Железы могут быть разрушены фрагментарно, а париетальные клетки могут подвергаться псевдогипертрофическим изменениям. Поскольку эти изменения неспецифичны, морфологи могут неправильно интерпретировать результаты без информации о сывороточных маркерах. Метаплазия, хроническое воспаление всех слоев стенки желудка и полная деструкция желез определены как ранние неспецифические изменения при АИГ. Кроме того, ранней находкой при АИГ может быть гиперплазия эндокринных клеток.
В нашем клиническом случае для выявления гиперплазии нейроэндокринных клеток использовали иммуногистохимический метод детекции с антителами к хромогранину А (клон SP12, Spring, США) и безбиотиновую систему детекции UnoVue (Diagnostic BioSystems, США), первичную высокотемпературную демаскировку антигена в гистологических срезах проводили на водяной бане в цитратном буфере (рH=6,0) в течение 30 минут. При реакции с хромогранином А в теле желудка определяли признаки гиперплазии нейроэндокринных ECL-клеток (рис. 5), определяемой по критерию наличия мелких кластеров из ≥5 позитивно-окрашенных клеток, расположенных в цепочку [17].

По мере прогрессирования заболевания обнаруживается диффузная лимфоплазмоцитарная инфильтрация собственной пластинки СОЖ с участками выраженной атрофии желез, отчетливо проявляется кишечная метаплазия. Конечная стадия заболевания характеризуется уменьшением или полной потерей желез тела желудка; более того, могут быть найдены псевдополипы или гиперпластические полипы, а воспалительная инфильтрация снижается по сравнению с более ранними стадиями заболевания [18, 19]. Обращает на себя внимание тот факт, что вышеописанные изменения при АИГ максимально проявляются в теле желудка по сравнению с антральным отделом, поэтому забор биоптатов следует выполнять по стандарту OLGA, как и было выполнено в представленном клиническом случае.
Обсуждается вопрос эффективности применения в диагностике АИГ pH-метрии желудка, однако данный метод не может отобразить всей полноты объема желудочной секреции и является технически трудной и инвазивной для пациента процедурой [120], что огранивает его использование в настоящей клинической ситуации.
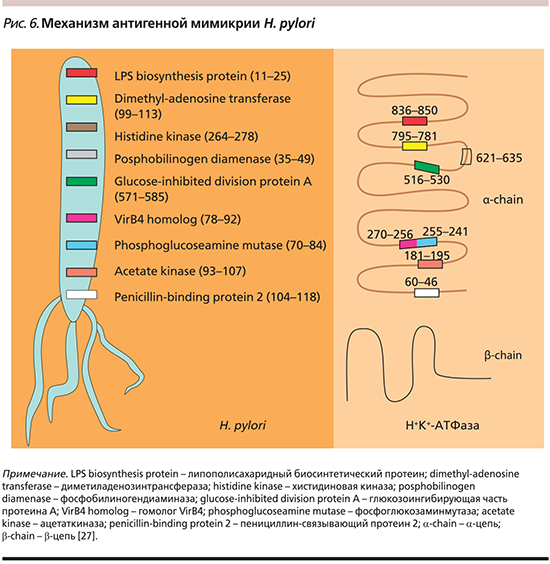
Не менее важным элементом диагностики АИГ является серологическое исследование: определение увеличения в сыворотке количества антител типа IgG к париетальным клеткам, антител типа IgG к Н+/К+-АТФазе (аденозинтрифосфатаза протонной помпы) в париетальной клетке, что клинически сопровождается умеренной или выраженной секреторной недостаточностью, а также антител типа IgG к внутреннему фактору Кастла, что клинически проявляется гиперхромной В12-дефицитной анемией, гипопепсиногенемии-1 и гипергастринемии в исходе функциональной гиперплазии антральных G-клеток. Антитела к внутреннему фактору продемонстрировали в исследованиях низкую чувствительность [21], однако их рост был отмечен при прогрессировании заболевания [22]. Стоит обратить внимание на то, что уровень витамина В12 не коррелирует с титрами антител к фактору Кастла [23]. Уровень же антител к париетальным клеткам характеризуется высокой специфичностью, но не коррелирует с тяжестью заболевания, что закономерно ввиду прогрессирующей атрофии желез желудка при АИГ [24], но эти специфические аутоантитела могут предшествовать клиническим симптомам в течение длительного срока, как продемонстрировано в ряде других аутоиммунных нарушений [25]. Уровни гастрина и пепсиногена не специфичны для диагностики АИГ, но предсказывают уровень атрофии. В целом определение антител к париетальным клеткам желудка считается оптимальным скрининговым тестом для АИГ, а определение антител к внутреннему фактору – резервной методикой для подтверждения диагноза. Нередко выявляются антитела к Н. pylori, однако роль этой инфекции в развитии АИГ спорна: участие Н. pylori в развитии атрофии СОЖ объясняется феноменом антигенной мимикрии [26, 27], что продемонстрировано на рис. 6.
Обсуждается роль грелина в качестве маркера выраженности атрофии слизистой оболочки тела желудка пациентов с АИГ [28]. Подобную взаимосвязь авторы объясняют анатомическими особенностями близкого расположения грелин-иммуннореактивных клеток в СОЖ и париетальных клеток, которые становятся клетками-мишенями при аутоиммунном поражении. Исследователи установили, что уровень грелина негативно коррелирует с выраженностью атрофических изменений и может их предсказывать с более высокими чувствительностью и специфичностью по сравнению с гастрином и пепсиногеном.
Известна взаимосвязь АИГ с другими заболеваниями аутоиммунного характера, что требует более тщательного обследования таких пациентов. Имеются данные о нередкой его ассоциации с сахарным диабетом 1 типа. Также АИГ может сосуществовать с полигландулярными аутоиммунными синдромами, но наиболее распространена его ассоциация с аутоиммунным тиреоидитом («тиреостатический аутоиммунитет»): более 50% пациентов, страдающих АИГ, имеют циркулирующие антитиреопероксидазные антитела [29], как и в случае с нашей пациенткой. Сообщалось об значимых ассоциациях АИГ с витилиго, алопецией, целиакией, миастенией и аутоиммунным гепатитом [30, 31].
Учтя имеющиеся данные эндоскопического и морфологического исследований, анамнез аутоиммунного тиреоидита у нашей пациентки, мы провели дополнительное обследование для уточнения причин выявленных изменений: по результатам общего анализа крови – без патологии; биохимический анализ крови – выявлено увеличение уровня триглицеридов до 1,94 ммоль/л; копрограмма – без патологии; цианокобаламин, железо сыворотки, общая железосвязывающая способность сыворотки, трансферрин, ферритин – в норме, антитела классов IgG и IgM к описторхозу, лямблиозу, токсокарозу не выявлены; гельминтологическое исследование кала комплексным сверхчувствительным методом – яйца гельминтов не выявлены. По результатам абдоминального ультразвукового исследования – диффузные изменения поджелудочной железы. Пациентке также было проведено исследование антител в сыворотке крови к фактору Кастла и париетальным клеткам: антитела к внутреннему фактору Кастла – 40,1 ЕД/мл при норме 0–6 ЕД/мл, антитела к париетальным клеткам желудка – титр 1:85 при норме до 1:40. Таким образом, больной был выставлен окончательный диагноз «гастроэзофагеальная рефлюксная болезнь, неэрозивная форма, неосложненное течение. Недостаточность кардии. Хронический атрофический Н. pylori негативный, аутоиммунный гастрит. Дуоденит. Язвенная болезнь ДПК в анамнезе: рубцовая деформация луковицы ДПК».
Пациенты с АИГ имеют более высокий риск развития рака в хронически воспаленной ткани желудка, согласно каскаду Корреа (1988). Мета-анализ от 2012 г. демонстрирует, что годовая заболеваемость аденокарциномой желудка составляет 0,27% на человеко-год с общим относительным риском 6,8% [32]. К тому же хроническая ахлоргидрия увеличивает выработку гастрина G-клетками в антруме, который затем стимулирует энтерохромафинные клетки, что приводит к их гиперплазии и развитию карциноидов желудка [33, 34]. Имеющие данные говорят о необходимости наблюдения и лечения АИГ.
Стандарты ведения пациентов с данным заболеванием отсутствуют. С учетом изменения СОЖ при АИГ (атрофия, кишечная метаплазия) отечественными согласительными документами рекомендовано динамическое эндоскопическое наблюдение, но, к сожалению, без указаний на кратность. Более подробную информацию мы можем найти в рекомендациях по ведению пациентов с предраковыми состояниями и изменениями желудка (Guidelines for the Management of Precancerous Conditions and Lesions in the Stomach – MAPS) [35]. При выборе метода исследования для диагностики и наблюдения за пациентами с подобными изменениями следует предпочесть увеличительную хромо- и узкоспектральную эндоскопию (как с увеличением, так и без него). Для адекватной диагностики предраковых изменений необходимо выполнить как минимум 4 нецелевые биопсии из двух топографических зон (тело, антрум) и брать целевой биопсийный материал из визуально измененных зон, а для оценки степени риска развития рака желудка следует использовать современные диагностические системы гистопатологического стадирования изучаемой патологии (OLGA). Пациенты с низкой степенью дисплазии и без эндоскопических повреждений могут проходить следующую эндоскопию через год. При наличии эндоскопических повреждений желательна эндоскопическая резекция с внимательным морфологическим исследованием. При высокой степени дисплазии и отсутствии эндоскопических повреждений требуется немедленно повторить эндоскопию с обширными биопсиями и тщательным наблюдением от 6 месяцев до 1 года. Учтя наличие в нашем клиническом случае кишечной метаплазии, мы рекомендовали пациентке проведение эндоскопического контроля через год с применением хромоэндоскопии и взятием гастробиоптатов по стандарту OLGA.
Этиопатогенетическая терапия АИГ не разработана. Стандартным заместительным лечением служат регулярные ежемесячные инъекции витамина В12 в дозе 100 мкг для коррекции его дефицита. Наиболее частым режимом поддерживающей терапии являются инъекции витамина В12 по 1000 мкг каждые 3 месяца [13]. Классическая схема лечения предполагает ежедневные внутримышечные инъекции витамина В12 в дозе 100 мкг в течение 1 недели с дальнейшим ежемесячным введением по 100 мкг. В тяжелых случаях показано парентеральное введение по 1000 мкг в день в течение 1 недели с дальнейшим назначением 1000 мкг в неделю в течение 1 месяца, затем – ежемесячно внутримышечные инъекции 1000 мкг.
Доказано, что у данной категории больных эрадикационная терапия ассоциируется с уменьшением активности и выраженности гастрита и в 80% случаев обеспечивает отсутствие прогрессирования атрофии СОЖ при наблюдении на протяжении 2 лет. Таким образом, проведение эрадикации у пациентов с АИГ при наличии H. pylori служит важным аспектом лечения этого заболевания [36, 37]. В начальной и прогрессирующей стадиях болезни с сохраненной секреторной функцией желудка при серьезном нарушении иммунных процессов назначаются глюкокортикостероиды (короткими курсами, средними дозами, не превышающими 30 мг преднизолона в сутки при условии проведения иммунных тестов). Отсутствие эффекта делает проведение повторного курса такой терапии нецелесообразным.
Кроме того, схема терапии АИГ должна включать лечение диспепсического синдрома с применением в дебюте заболевания антисекреторных препаратов и прокинетиков. В комплекс лечения включают также обволакивающие лекарственные средства, а при формировании секреторной недостаточности используют средства заместительной терапии [38].
Рассматривая АИГ с позиций атрофического гастрита, можно рекомендовать в прогрессирующих стадиях препараты, стимулирующие выработку соляной кислоты. В настоящее время существует масса лекарственных средств, которые «теоретически» должны оказывать стимулирующее действие на париетальные клетки. Однако в реальной клинической практике эффективность большинства из них весьма незначительна, а продолжительность действия короткая.
Следует все же упомянуть о некоторых методах стимулирующей терапии:
- минеральные воды (Ессентуки № 4, № 17, Нарзан, Миргородская) применяют в теплом виде за 15–20 минут до еды;
- отвар шиповника, а также лимонный, капустный, томатный соки, разведенные кипяченой водой;
- лекарственные сборы (подорожник, зверобой, полынь, чабрец). Особенно широко в практике используется Плантаглюцид – гранулы листьев подорожника, который применяют по 1 чайной ложке 3 раза в день с теплой водой за 20 минут до еды;
- Лимонтар (лимонная и янтарная кислота) по 1 таблетке 3 раза в день за 20 минут до еды [39].
Целесообразно рассматривать в качестве средства терапии АИГ и мукоцитопротекторы, улучшающие трофику и регенерацию СОЖ, а также, возможно, снижающие риск канцерогенеза. К таким препаратам можно отнести висмута трикалия дицитрат, ребамипид [40].
Данные о применении при АИГ ингибиторов протонной помпы с позиций влияния на атрофию СОЖ спорны и неоднозначны [41, 42]. В данном вопросе, вероятно, необходимо индивидуально подходить к вопросу о взаимосвязи причин повреждения СОЖ и возникновения атрофии с учетом прогрессирования заболевания и прогноза.
В рамках нашего клинического случая мы рекомендовали длительный прием пантопразола по 40 мг за 30 минут до завтрака, чередование курсов мукоцитопротекторов (висмута трикалия дицитрат 120 мг 4 раза в сутки за 30 минут до еды и ребамипид по 100 мг 3 раза в сутки по 4 недели) с приемом Плантоглюцида по 1 чайной ложке 3 раза в сутки с 100 мл теплой воды за 15 минут до еды в течение 4 недельс последующим наблюдением: выполнение ЭФГДС с увеличительной хромоэндоскопией и забором биоптатов, согласно протоколу OLGA-system, в сочетании с прицельным забором биоптатов измененной СОЖ через 6 месяцев.
Заключение
Таким образом, в каждом конкретном случае хронического гастрита важна оценка причинного фактора повреждения СОЖ, а также степени, вида, распространенности морфологических изменений слизистой оболочки (тело, антральный отдел желудка), что требует не только учета анамнестических данных и результатов физикального исследования, но по большей части грамотного анализа результатов эндоскопического и морфологического исследований. Тесная взаимосвязь клинициста и морфолога в вопросах дифференциальной диагностики хронического гастрита – залог правильности постановки диагноза и выбора тактики ведения пациента.



