Рак яичника (РЯ) остается ведущей причиной смерти среди злокачественных опухолей женских половых органов и пятой – среди всех злокачественных опухолей у женщин. Ежегодно в мире регистрируется более 200 тыс. новых случаев РЯ и более 100 тыс. женщин погибают от злокачественных новообразований яичника. Достижения последних 20 лет способствовали увеличению общей выживаемости больных с 35 до 40 %. Если пятилетняя выживаемость при ранних стадиях РЯ превышает 80 %, то для большинства (75 %) больных диссеминированными формами РЯ она составляет менее 25 %. Традиционное лечение распространенного РЯ заключается в выполнении циторедуктивных операций с последующей химиотерапией (ХТ). На практике энтузиазм в отношении назначения цитостатиков при прогрессировании опухолевого процесса угасает по мере развития химиорезистентности.
Новой стратегией в онкологии становится таргетная терапия – направленная на опухолевые “мишени”. На сегодняшний день наиболее разработана в отношении РЯ антиангиогенная терапия, действие которой направлено на блокирование роста новых сосудов в опухоли. Нормальный ангиогенез определяется балансом между ангиогенными стимуляторами и ингибиторами. В опухолях отмечен повышенный уровень стимуляторов ангиогенеза (фактор роста сосудистого эндотелия – VEGF, тимидинфосфорилаза, ангиогенин и др.) при сниженном уровне эндогенных ингибиторов (тромбоспондин, ангиостатин, эндостатин и др.). VEGF является важнейшим стимулятором ангиогенеза, а также роста и развития фолликулов яичника. Действие VEGF опосредуется через рецепторы VEGFR1 и VEGFR2, активация которых запускает каскад трансдукционных сигналов, приводящих к усилению ангиогенеза. При РЯ повышенная экспрессия VEGF на основании многофакторного анализа рассматривается как независимый неблагоприятный прогностический фактор [1–8]. Установлено также, что VEGF способствует формированию асцита, характерного для большинства случаев РЯ [9, 10]. На экспериментальных мышиных моделях РЯ продемонстрировано редуцирование роста опухоли и накопления асцита при блокировании VEGF [11, 12]. Разрабатываемые ингибиторы ангиогенеза действуют опосредованно на эндотелиальные клетки, блокируя их пролиферацию, миграцию и индуцируя апоптоз активированных эндотелиальных клеток.
Авастин™ (бевацизумаб) является первым антиангиогенным препаратом, продемонстрировавшим свою эффективность при некоторых солидных опухолях (колоректальный рак – КРР, рак молочной железы – РМЖ, рак почки, печени и др.). Препарат представляет собой химерные гуманизированные рекомбинантные антитела против VEGF. Особый интерес вызывают сообщения о его эффективности в паллиативной терапии асцитных форм опухолей [13–16].
Недавно опубликованные (2007, 2008) обнадеживающие результаты проспективных клинических исследований II фазы бевацизумаба в лечении рецидивов РЯ (в монотерапии и комбинации с цитостатиками), возможно, изменят стратегию лечения рецидивирующего РЯ яичника (табл. 1).
Примечание. Комб. тер. – бевацизумаб + цитостатики; ПР – полный регресс, ЧР – частичный регресс; МВБП – медиана выживаемости без прогрессирования.
В двух проспективных исследованиях II фазы, продемонстрировавших значительную эффективность бевацизумаба, препарат использован в монорежиме в дозе 15 мг/кг каждый 21-й день. В исследовании GOG 170D [17] были включены 62 больных РЯ с платиночувствительными (интервал > 6 месяцев) и платинорезистентными рецидивами (интервал < 6 месяцев), ранее получавших не более двух режимов химиотерапии [17]. В исследование AVF 2949 [18] вошли 44 пациентки с платиночувствительными и резистентными к препаратам платины, топотекану и липосомальному доксорубицину рецидивами, получившие 2–3 режима ХТ. Burger и соавт. [17] сообщили об объективном ответе (ПР + ЧР) в 21 % случаев и стабилизации у 52 % больных. При этом у 40 % отсутствовало прогрессирование опухоли в течение 6,0 месяцев с медианой выживаемости без прогрессирования (МВБП) 4,7 и медианой общей выживаемости (МОВ) 16,9 месяца. Cannistra и соавт. [18] продемонстрировали общий ответ у 15,9 % больных и стабилизацию в 64 % случаев с МВБП 4,4 и МОВ 10,7 месяца к окончанию исследования.
В четырех проспективных исследованиях II фазы бевацизумаб использовался в комбинации с ХТ (карбоплатин + паклитаксел, циклофосфамид или топотекан); в тех же работах была также продемонстрирована эффективность антиангиогенной терапии [19–22]. В одном из исследований [19] бевацизумаб применялся в дозе 10 мг/кг в 1-й, 8-й и 15-й дни с интервалом в 2 недели в комбинации с метрономной терапией циклофосфамидом по 50 мг ежедневно. При этом сообщается об общем ответе в 24 % случаев со стабилизацией у 63 % больных и 6-месячной выживаемостью без прогрессирования у 56 % пациенток. МВБП составила 7,2, а МОВ – 16,9 месяца. Комбинация бевацизумаба с ХТ оказалась, очевидно, более активной, чем один бевацизумаб, что отмечается также при КРР и РМЖ [23–25].
В исследовании II фазы при рецидивах РЯ была изучена комбинация бевацизумаба (Авастин™) с эрлотинибом (Тарцева™), ингибитором рецептора эпидермального фактора роста (EGFR). В работе преимуществ в сравнении с монотерапией бевацизумабом выявлено не было. При этом зарегистрировано два летальных исхода, связанных с гастроинтестинальной перфорацией, что заставило закрыть исследование [26].
Несомненно, что для окончательного суждения об эффективности добавления бевацизумаба к ХТ рецидивов РЯ необходимы рандомизированные исследования III фазы. В настоящее время проводится два таких испытания. В исследовании OCEANS первой группе больных была назначена комбинация бевацизумаб + карбоплатин + гемцитабин; второй группе – плацебо + карбоплатин + гемцитабин. В американском исследовании GOG 213 пациентки с рецидивами РЯ были рандомизированы в группы карбоплатин + паклитаксел и карбоплатин + паклитаксел + бевацизумаб. В настоящее время при рецидивах РЯ изучается комбинация карбоплатин + липосомальный доксорубицин + бевацизумаб. Основанием для этого испытания послужили результаты рандомизированного исследования CALYPSO [27], в котором продемонстрировано преимущество по терапевтическому индексу (польза/риск) комбинации карбоплатин + липосомальный доксорубицин в сравнении со стандартным лечением (карбоплатин + паклитаксел) при рецидивах РЯ.
Клиническая эффективность бевацизумаба (даже в монорежиме) при рецидивирующем РЯ, продемонстрированная в проспективных исследованиях II фазы, оказалась значительно выше, чем при КРР (3,0 %) [25] и РМЖ (6,7 %) [24]. Это свидетельствовало в пользу того, что данный препарат может быть потенциально активным в лекарственной терапии 1-й линии диссеминированного РЯ.
С целью изучения эффективности бевацизумаба в первичном лечении диссеминированного РЯ было проведено два рандомизированнных исследования III фазы: GOG0218 и ICON7. GOG218 представляет собой рандомизированное двойное слепое плацебо-контролируемое исследование в 3 группах по оценке бевацизумаба (15 мг/кг) в комбинации с карбоплатином и паклитакселом, а также последующей поддерживающей терапией (см. рисунок). ICON7 – рандомизированное плацебо-контролируемое исследование в двух группах, в котором бевацизумаб использовался в дозе 7,5 мг/кг.
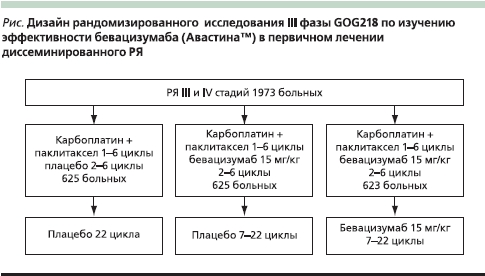
В 2010 г. на Конгрессе ASCO (Американское общество клинических онкологов) были сообщены результаты GOG0218 [28]. В исследование были включены 1973 больных РЯ III и IV стадий после оптимальных и субоптимальных циторедуктивных операций. Зарегистрированная токсичность распределялась по группам следующим образом: артериальная гипертензия III–IV степеней в группе без бевацизумаба (1-я группа) – 1,6 %, в группе с конкурентными курсами бевацизумаба (2-я группа) – 5,4 %, в группе с конкурентными и поддерживающими курсами бевацизумаба (3-я группа) – 10,0 %; желудочно-кишечные осложнения III степени (перфорации, геморрагии и фистулы) в 1-й группе – 0,8 %, во 2-й – 2,6, в 3-й – 2,3 % (табл. 2). Относительный риск прогрессирования или смерти в сравнении с 1-й контрольной группой составил во 2-й группе с конкурентными циклами бевацизумаба 0,908 (р = 0,16), а в 3-й группе с конкурентными и поддерживающими его циклами – 0, 717 (р < 0,0001; табл. 3). По заключению экспертов GOG данное исследование продемонстрировало эффективность антиангиогенной терапии бевацизумабом в лечении больных диссеминированным РЯ в режиме конкурентных циклов к стандартной ХТ 1-й линии с последующими поддерживающими циклами.
Примечание. КП – 6 циклов карбоплатин + паклитаксел; КП + Б – 6 циклов карбоплатин + паклитаксел с 5 конкурентными циклами бевацизумаба; КП + Б → Б – 6 циклов карбоплатин + паклитаксел с 5 конкурентными циклами бевацизумаба и 16 поддерживающими циклами бевацизумаба, p < 0,05.
Таким образом, Авастин™ (бевацизумаб) является первым антиангиогенным препаратом, продемонстрировавшим свою эффективность в клинической онкологической практике. Препарат зарегистрирован для лечения больных диссеминированными формами КРР, РМЖ, рака почки, легкого. Клинические исследования II фазы бевацизумаба в монорежиме при рецидивирующем РЯ показали более высокие результаты, чем при КРР и РМЖ. Назначение бевацизумаба в комбинации с ХТ обеспечило большую эффективность при рецидивах РЯ, чем в монорежиме. Рандомизированное исследование III фазы (GOG218) по использованию бевацизумаба в первичном лечении диссеминированного РЯ показало статистически достоверное увеличение выживаемости без прогрессирования при назначении конкурентных циклов бевацизумаба в комбинации с химиотерапией 1-й линии (паклитаксел + карбоплатин) с последующими поддерживающими циклами бевацизумаба. Представленные в статье результаты клинических исследований по антиангиогенной терапии бевацизумабом (Авастин™) свидетельствуют об эффективности данного препарата в лечении диссеминированного и рецидивирующего РЯ.



