Введение
Термин «минимальный» был впервые предложен H. Gallager и G. Martin в 1971 г. и включил преинвазивную (ca in situ), инвазивную дольковую и протоковые формы рака молочной железы при размере опухолевого образования ≤0,5 см в диаметре. Это было установлено на основании данных анализа огромного количества работ о методах лучевой диагностики и патоморфологической оценки РМЖ. Результатом этого анализа стало понимание того, что РМЖ является больше диффузным процессом, нежели фокальным [1]. В 1981 г. группа исследователей во главе с R. Bedwani et al. предложили относить термин «минимальный» рак к образованиям размером ≤1 см [2].
В настоящее время данный термин означает инвазивный или неинвазивный РМЖ ≤1 см в диаметре в отсутствие региональных и отдаленных поражений (метастатического поражения) (сT1abN0M0) [3].
Использование неоадъювантной системной терапии (НСТ) не только улучшает показатели общей и безрецидивной выживаемости, но и позволяет выполнять менее травматичные органосохраняющие операции, а также осуществлять первичное тестирование лекарственной чувствительности in vivo [4, 5].
Определение наиболее эффективных схем лекарственной терапии является одним из наиболее приоритетных направлений в рамках индивидуализации лечения пациентов с РМЖ [4–7, 11, 12].
При изучении НСТ во многих отечественных и зарубежных исследованиях суррогатной первичной конечной точкой является достижение полного потоморфологического ответа опухоли (рCR), являющегося важным прогностическим фактором. По данным литературы, достижение pCR после НСТ при РМЖ варьируется от 30 до 70% [4–10]. Пациентам, не достигшим pCR, требуется проведение постнеоадъювантного лечения [13].
Целью настоящего исследования является получение данных для повышения эффективности лечения резидуальных минимальных форм (ypT1a-b) РМЖ после НСТ.
Методы
Пациенты
Материалом в ретроспективном когортном исследовании стали данные 602 пациентов с ранним и местнораспространенным РМЖ сT1-3N1-3M0 I–IIIC-стадий, которым проводилось комплексное или комбинированное лечение. В данное исследование включались пациенты, получавшие лечение в НМИЦ онкологии им. Н.Н. Петрова с 2015 по 2021 г.
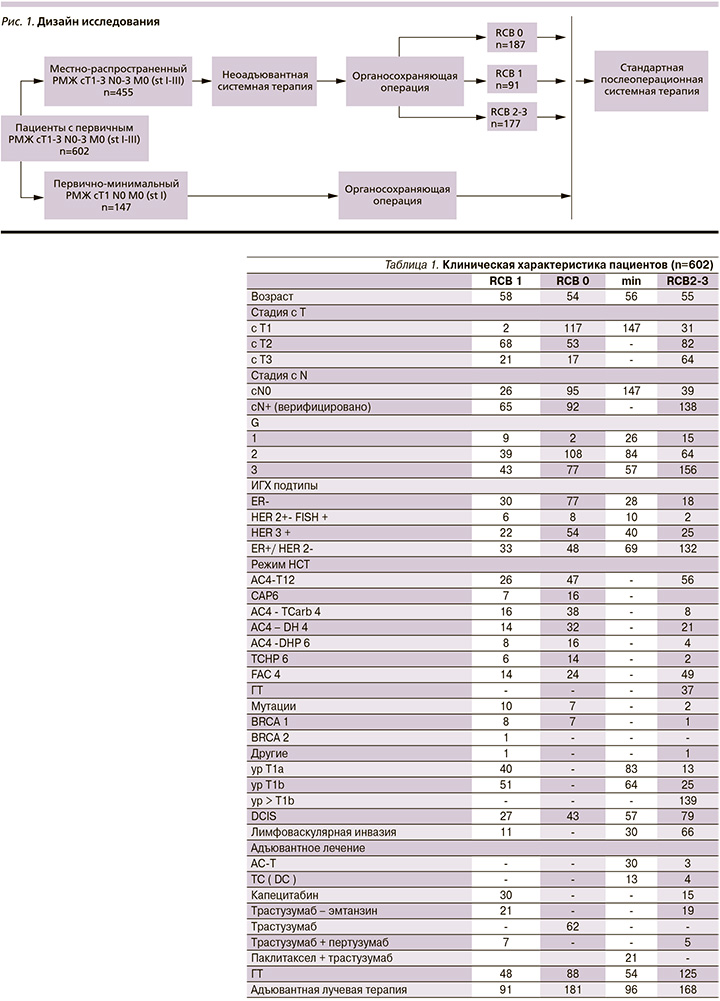
Пациентам всех групп проводилось лечение, согласно действующим рекомендациям МЗ РФ. Патоморфологическая оценка производилась в отделе патоморфологии опухолей НМИЦ онкологи им. Н.Н. Петрова. На рис. 1 представлен дизайн исследования.
В исследовании использовалось определение молекулярно-биологических и суррогатных подтипов РМЖ, основанное на патоморфологической (ИГХ) оценке уровня экспрессии рецепторов стероидных гормонов (ER/PR), HER2, KI-67, гистологической степени злокачественности (G), методами, рекомендованными экспертами St. Gallen, ESMO, исходя из следующих критериев:
1) классификация ВОЗ с указанием категорий ypTypN;
2) система RCB (Residual Cancer Burden; бесплатный онлайн калькулятор доступен на сайте http://www3.mdanderson.org/app/medcalc/index. cfm?pagename =jsconvert3).
В 1-ю группу больных вошли пациенты с минимальной резидуальной опухолью (ypT1ab N0) [RCB1] (n=91). Во 2-ю группу вошли пациенты, достигшие полного патоморфлогического ответа после неоадъювантной системной терапии (pCR или RCB 0) (n=187).
Для сравнительной оценки отдаленных результатов лечения (безрецидивная и общая выживаемость) пациентов с минимальной резидуальной опухолью после НСТ были включены еще две группы пациентов, получавших лечение в те же годы.
Пациенты с первично минимальным инвазивным РМЖ pT1a-bN0 не подвергались неоадъювантной системной терапии (n=147) (группа 3). И в 4-ю группу включались пациенты, не достигшие полного патоморфологического ответа после неоадъюватной терапии (резидуальная опухоль RCB 2–3) (n=177).
Первичная конечная точка: показатели 5-летней безрецидивной выживаемости пациентов в зависимости от стадии, биологического подтипа и степени опухолевого ответа по результатам послеоперационного патоморфологического заключения по шкале RCB.
Вторичные конечные точки: показатели 5-летней общей выживаемости пациентов в зависимости от стадии, биологического подтипа и степени опухолевого ответа по результатам послеоперационного патоморфологического заключения по шкале RCB;
Статический анализ
Для статистического анализа используемый материал внесен в базу данных с использованием программного обеспечения «Microsoft EXCEL». Для статистических расчетов использовали программное обеспечение «IBM SPSS Statistics версия 26.0».
Оценка соответствия распределения данных нормальному распределению Гаусса проводилась с использованием визуальной оценки графиков рассеяния и критерия Колмогорова–Смирнова.
Для оценки взаимосвязи количественных переменных с нормальным распределением рассчитывали коэффициент корреляции Пирсона (r) и проводили оценку его значимости.
Для ответионного анализа влияния множества факторов на биноминальный исход применяли модель множественной логистической ответии. Для каждого фактора, включенного в модель, рассчитывался уровень статистической значимости и отношение рисков (ОР, HR).
Функция выживания оценивалась с помощью метода Каплана–Майера. Выживаемость пациентов в различных подгруппах сравнивалась с использованием логарифмического рангового критерия (log-rank теста) с построением нескольких кривых выживаемости.
Характеристика включенных пациентов
Подробные характеристики пациентов, включенных в исследование, и виды неаодъювантного и постнеоадъювантного лечения, представлены в табл. 1. Медиана времени наблюдения во всех группах составила 60 месяцев.
Результаты
Результаты лечения
В 1-ю группу больных вошли пациенты с минимальной резидуальной опухолью (ypT1ab N0) [RCB1] (n=91). Во вторую группу вошли пациенты, достигшие полного патоморфлогического ответа после НСТ (pCR или RCB 0) (n=187).
Для сравнительной оценки отдаленных результатов лечения (безрецидивная и общая выживаемость) пациентов с минимальной резидуальной опухолью после НСТ включены еще две группы пациентов, получавших лечение в те же годы.
Пациенты с первично минимальным инвазивным РМЖ pT1a-bN0, не подвергавшиеся НСТ (n=147) (группа 3). И в 4-ю группу включались пациенты, не достигшие полного патоморфологического ответа после неоадъюватной терапии (резидуальная опухоль RCB 2–3) (n=177).
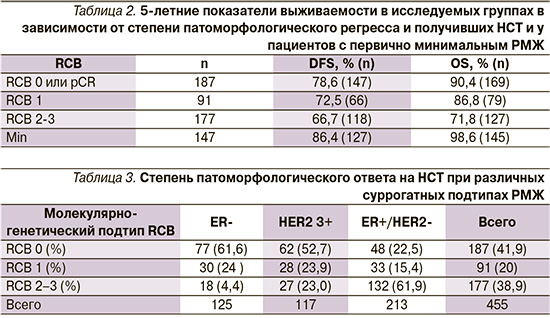
Показатели выживаемости в исследуемых группах (табл. 2) составили:
В группе 2 (RCB0) показатель 5-летней DFS составил 78,6%, 5-летней OS – 90,4%.
В группе (RCB1) показатель 5-летней DFS составил 72,5%, 5-летней OS – 86,8%.
В группе 4 (RCB2-3) показатель 5-летней DFS составил 66,7%, 5-летней OS – 71,8%.
В группе 3 пациентов с первично минимальной карциномой показатель 5-летней DFS составил 86,4%, 5-летней OS – 98,6%.
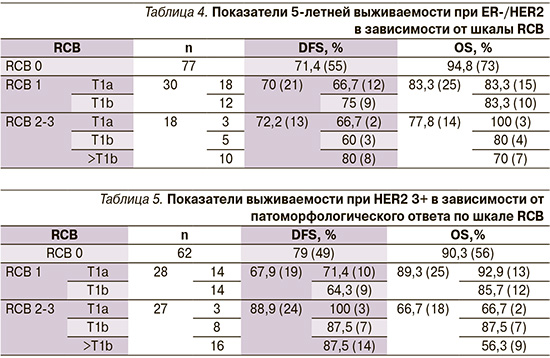
Среди включенных в исследование 455 пациентов (табл. 3), подвергшихся НСТ, полный патоморфологический ответ (pCR и RCB 0) достигнут 187 (41,9%) больными. При этом у пациентов с ER-/HER2- (трижды негативным) РМЖ полный патоморфологический ответ достигнут 77 из 125 (61,6%) больных, пациентов с HER2- позитивным РМЖ 62 из 117 (52,7%) больных, пациентов с ER+/HER2- РМЖ 48 из 213 (22,5%) больных. Таким образом, чаще всего полный патоморфологический ответ достигался при самых агрессивных опухолях (ER-/HER2- в 61,6%) и HER2+ (52,7%) и реже всего при гормонзависимом РМЖ (22,5%) [p=0,048].
Достижение благодаря НСТ, полному патоморфологическому ответу опухоли (RCB 0, pCR) или ypT0/is или достижение минимального резидуального заболевания RCB 1 или ypT1a-b) зарегистрировано у 107 из 125 (85,6%) с ER-/HER2- РМЖ; у 90 из 117 (76,1%) пациентов с HER2+ РМЖ и лишь у 81 из 213 (38,0%) с ER+ РМЖ (p<0,059).
Таким образом, выраженная степень патоморфологического ответа вплоть до RCB 0 или RCB 1 (минимального резидуального заболевания, ypT1ab) чаще достигается при наиболее биологически агрессивных подтипах: ER+ и HER2+ РМЖ.
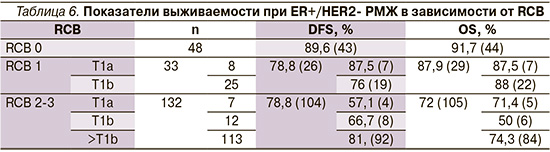
Кроме того, показатели выживаемости оценивались в зависимости от размера резидуальной опухоли, по размеру большей, чем T1a и T1b соответственно, и степени регресса по шкале RCB (табл. 4–6).
Особый интерес представляет изучение отдаленных результатов (5-летней безрецидивной (DFS) и общей выживаемости (OS) в зависимости от степени патоморфологического ответа по сравнению с результатами первично минимального (pT1a-b N0) РМЖ. Даже в группе пациентов, достигших патоморфлогически полный ответ (pCR или RCB 0), показатели выживаемости оказались ниже, чем у пациентов с первично минимальным РМЖ: 5-летняя безрецидивная выживаемости (DFS) равнялась 78,6% при RCB0 против 86,39 в группе с первично минимальным РМЖ (p<0,05); 5-летняя общая выживаемость (OS) равнялась 90,4% при RCB0 против 98,6% в группе первично минимального РМЖ (р<0,05).
Благодаря достижениям НСТ минимального резидуального рака (RCB 1 или ypT1ab N0) у пациентов с исходно местнораспространенным РМЖ достоверно улучшаются показатели безрецидивной и еще в большей мере общей выживаемости по сравнению с также минимальными резидуальными опухолями, но с наличием резидуального метастатического статуса в регионарных лимфоузлах (RCB 2–3) (табл. 2). Показатели 5-летней безрецидивной выживаемости равнялись 72,5% при RCB1 против 66,7% в группе RCB2-3 (p=0,058), показатели общей выживаемости равнялись 86,6% при RCB1 против 71,8% в группе RCB 2–3 (p<0,048).
В целом проведение НСТ приводит к значительному клиническому и патоморфологическому ответу (RCB 0, RCB 1) у 53,8 и 69,9% пациентов с HER2+ или ER-/HER2 РМЖ, что в конечном итоге «транслируется» в высокие показатели 5-летней общей выживаемости (OS – 90,4 и 86,6%). Несмотря на то что эти показатели чуть ниже, чем при первично минимальном РМЖ, все же можно утверждать, что по крайней мере половине пациентов с местнораспространенном РМЖ, получавших НСТ, возможно выполнить безопасную органосохраняющую операцию, включая биопсию сигнальных лимфатических узлов с высокими показателями безрецидивной и общей выживаемости.
Как видно из табл. 2, показатели 5-летней безрецидивной (DFS) и общей выживаемости (OS) статически достоверно выше (р<0,05) у пациентов с первично минимальным (pT1ab N0) РМЖ (DFS – 86,4%; OS – 98,6%) по сравнению с пациентами, которые достигли полного (RCB 0) или частичного ответа (RCB1), означающего минимальный резидуальный рак (ypT1ab ypN0) (DFS – 72,5%, OS – 86,6%), благодаря НСТ. При этом следует отметить что более 30% пациентов с первично минимальным РМЖ (pT1abN0) не подвергались адъювантной химиотерапии.
В долгосрочном плане представляет интерес влияние степени клинического ответа и особенно патоморфологического ответа после НСТ на отдаленные результаты лечения, прежде всего на показатели безрецидивной (DFS) и общей выживаемости (OS). Кроме того, важно знать, насколько совпадают или, наоборот, отличаются от них показатели выживаемости (DFS, OS) у пациентов с первично минимальным РМЖ (cT1abN0), не подвергавшихся неоадъювантной терапии (табл. 2).
При RCB0 показатель 5-летней безрецидивной выживаемости (DFS) равнялся 71,4%, показатель 5-летней общей выживаемости (OS) составил 94,8%.
При RCB 1 ypT1a 5-летняя DFS составила 66,7%, 5-летняя OS – 83,3%.
При RCB 1 ypT1b 5-летняя DFS равнялась 75%, 5-летняя OS – 83,3%.
При RCB 2-3 ypT1a 5-летняя DFS равнялась 66,7%, 5-летняя OS – 100%.
При RCB 2-3 ypT1b 5-летняя DFS составила 60%, 5-летняя OS – 80%.
При RCB 2-3 yp>T1b 5-летняя DFS составила 80%, 5-летняя OS – 70%.
Среди включенных в исследование 602 пациентов с местнораспространенным РМЖ у 125 (20,76%) выявлен ER-/HER2 РМЖ. Известно, что данный подтип, отнесенный к категориям T2N1 и больше, характеризуется особенно неблагоприятным прогнозом.
В нашем исследовании с помощью неоадъювантной химиотерапии удалось достичь патоморфологически полного ответа (pCR или RCB0) от 77 из 125 (61,6%) больных, от 30 (24%) пациентов минимального резидуального размера (ypT1ab ypN0), т.е. выраженный ответ наблюдался у 103 из 125 (82,4%) пациентов. Как видно из табл. 4, при достижении полного патоморфологического ответа (RCB0) показатель 5-летней безрецидивной выживаемости равнялся 71,4%, показатель общей выживаемости достиг 94,8%. Следует отметить, что и при резидуальном минимальном РМЖ показатель безрецидивной выживаемости достоверно не отличался от аналогичных показателей в группе RCB0 (70% –RCB1 против 71,4% – RCB0).
Даже при большем по распространению процессом (RCB2-3) процентные уровни не различались, но из-за малого числа пациентов с RCB2-3 отличие было недостоверным (р> 0,05).
В табл. 5 представлены данные о выживаемости при HER2-позитивном РМЖ в зависимости от патоморфологического ответа на НСТ.
При RCB0 показатель 5-летней безрецидивной выживаемости (DFS) равнялся 79%, а показатель 5-летней общей выживаемости (OS) – 90,3%.
При RCB1 ypT1a 5-летняя DFS составила 71,4%, 5-летняя OS – 92,9%.
При RCB1 ypT1b 5-летняя DFS равнялась 64,3%, 5-летняя OS – 85,7%.
При RCB 2-3 ypT1a 5-летняя DFS равнялась 100%, 5-летняя OS – 66,7%.
При RCB 2-3 ypT1b 5-летняя DFS составила 87,5%, 5-летняя OS – 87,5%.
При RCB 2-3 yp>T1b 5-летняя DFS составила 87,5%, 5-летняя OS – 56,3%.
HER2-позитивный РМЖ выявлен у 117 из 602 (19,4%) пациентов.
Показатели 5-летней безрецидивной и общей выживаемости изучены у 117 пациентов с HER2-позитивным РМЖ II–III стадий, получивших неаодъваювантную анти-HER2-терапию (трастузумаб, у трети пациентов – трастузумаб+пертузумаб) и химиотерапию, включившую антрациклины, таксаны (паклитаксел, наб-паклитаксел) от 4 до 6 курсов.
В результате неоадъювантной терапии полный патоморфологический ответ (pCR, RCB 0) достигнут 62 из 117 (53%) пациентов, минимальной резидуальный HER2+ РМЖ (ypT1ab ypN0) у 28 (24%) пациентов, минимальный резидуальный рак (ypT1ab) в молочной железе, но с наличием одиночных метастазов в подмышечных лимфоузлах ypN+(RCB 2-3) у 27 (23%) пациентов.
Как и следовало ожидать, наиболее высокие показатели 5-летней безрецидивной (79%) и общей выживаемости (90,3%) наблюдались у пациентов с патоморфологическим полным ответом (pCR и RCB0) (табл. 5). У пациентов с минимальной резидуальной опухолью (ypT1a ypN0) также наблюдались высокие показатели безрецидивной (71,4%) и общей выживаемости (92,9%).
При RCB0 показатель 5-летней безрецидивной выживаемости (DFS) равнялся 89,6%, показатель 5-летней общей выживаемости (OS) составил 91,7%.
При RCB1 ypT1a 5-летняя DFS составила 87,5%, 5-летняя OS – 87,5%.
При RCB1 ypT1b 5-летняя DFS равнялась 76%, 5-летняя OS – 88%.
При RCB2-3 ypT1a 5-летняя DFS равнялась 57,1%, 5-летняя OS – 71,4%.
При RCB2-3 ypT1b 5-летняя DFS составила 66,7%, 5-летняя OS – 50%.
При RCB2-3 yp>T1b 5-летняя DFS составила 81,4 %, 5-летняя OS – 74,3%.
ER+-РМЖ (в основном люминальный B) выявлен у 213 из 602 (35,38%) пациентов, подвергшихся неоадъювантной химиотерапии. В отличие от других подтипов относительно редко отвечает на неоадъювантную терапию (как химиотерапию, так и гормонотерапию). В нашем исследовании полный патоморфлогический ответ (RCB 0) достигнут лишь от 48 из 213 (22,5%) пациентов, минимальный резидуальный рак – лишь от 33 из 213 (15,4%). Однако при изучении отдаленных результатов видно (табл. 3), что показатели безрецидивной и общей выживаемости как при достижении патоморфологического полного ответа (RCB 0) (89,6 и 91,7%), так и при резидуальном минимальном раке (RCB 1) (78,8 и 87,5%) не уступают другим подтипам. Наши данные подтверждают другие исследования, указывающие на своеобразное «замедленное» клиническое течение ER+ РМЖ, связанное с низкой пролиферативной активности этих опухолей. Поэтому относительно редкий ответ на неоадъювантную терапию ER+-РМЖ не означает, что прогноз и исход заболевания будут неблагоприятными. Скорее наоборот, даже при значительном местнораспространенном ER+-РМЖ с помощью неоадъювантной эндокринотерапии (люминальном А) и/или химиотерапии (люминальном B) удается добиваться хороших показателей как безрецидивной, так и общей выживаемости (DFS – 89,6%, OS – 91,7%).
Также среди пациентов, не достигших полного патоморфологического ответа (RCB1, 2-3) были оценены общие показатели местного рецидива и отдаленных поражений (табл. 7).

Частота возникновения местного рецидива равнялась 9,5%, частота отдаленных метастазов составила 7,82%.
Как видно из табл. 7, чаще всего местнорегионарный рецидив возникал у пациентов с ER-/HER2- РМЖ (RCB 1–3), т.е. не достигших патоморфологически полного ответа на неаодъювантную химиотерапию.
В той же группе в 2–5 раз чаще по сравнению с другими подтипами выявляются отдаленные метастазы в различные органы и системы.
Реже всего местный и отдаленный рецидивы наблюдались при ER+/HER2 РМЖ.
Интересно сравнить эти данные, касающиеся пациентов с первично местнораспространенным заболеванием II–IIIa стадий и достигших минимального резидуального статуса (RCB1–3) с данными о безрецидивной выживаемости больных первично минимальным РМЖ (pT1ab pN0) (табл. 8).
Большинство этих пациентов прожили 5–7 лет и больше (т.е. почти в 2 раза продолжительнее, чем пациенты после НСТ). Естественно, кумулятивный риск отдаленного метастазирования возрастает при более длительном сроке наблюдения.
Поэтому при сравнении 5-летних результатов лечения пациентов первично минимальным РМЖ и пациентов с минимальным резидуальным РМЖ (RCB1) (как было показано в табл. 2) как 5-летняя безрецидивная, так и общая выживаемость достоверно выше у пациентов, не подвергавшихся НСТ из-за ранней стадии заболевания (cT1N0).
Показатель местного рецидива среди пациентов с ER-РМЖ составил 14,3%, отдаленное метастазирование выявлено у 7,1%.
Показатель местного рецидива среди пациентов с ER+/HER2 РМЖ составил 2,9%, отдаленное метастазирование выявлено у 7,2%.
Показатель местного рецидива среди пациентов с HER2 3+-РМЖ составил 10%, отдаленное метастазирование выявлено у 4%.
Анализ выживаемости
С целью уточнения 5-летней безрецидивной и общей выживаемости составлены кривые Kaplan–Meier. Как видно из рис. 2, 3, среди пациентов, достигших патоморфологического полного ответа на НСТ (pCR или RCB0), наблюдаются более высокие показатели выживаемости с первого года наблюдения и на протяжении последующих лет (5-летняя безрецидивная выживаемость – 76,8% при pCR (RCB0), 72,5% при RCB1 и 66,7% при RCB2-3. При этом они значительно отличаются от отдаленных результатов лечения пациентов с первично минимальным РМЖ, у которых этот показатель достигает 86,4%, т.е. выше, чем при RCB0 (p<0,005).
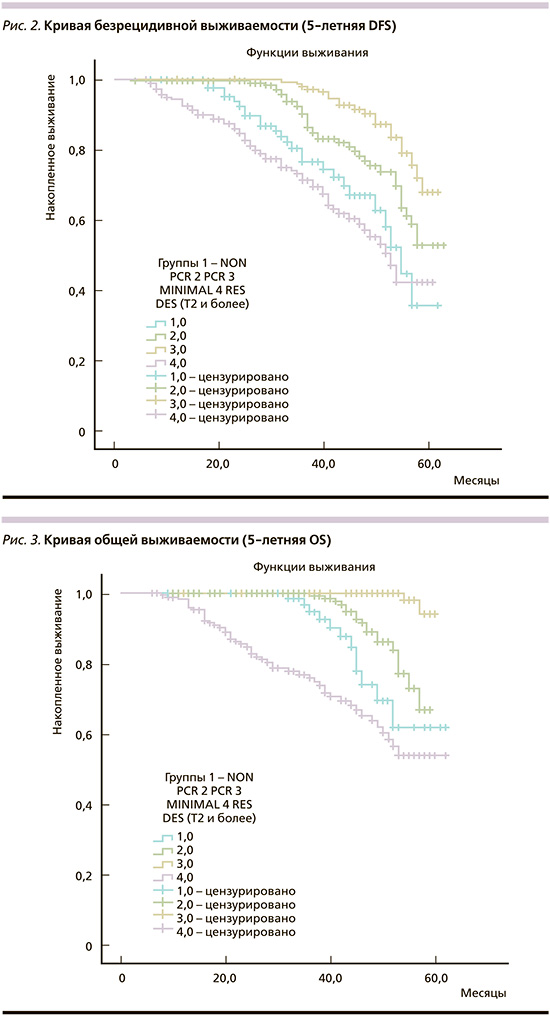
Такая же закономерность видна и при изучении общей выживаемости при наблюдении от 1 до 5 лет (рис. 3).
Кривые 5-ти летней выживаемости (DFS и OS) были построены на основании полученных данных, представленных в таблицах 9-12.
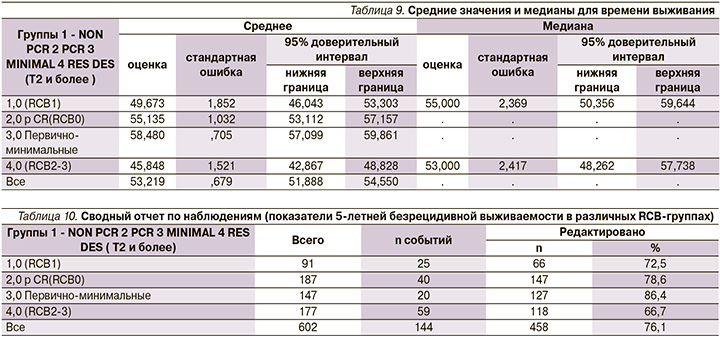
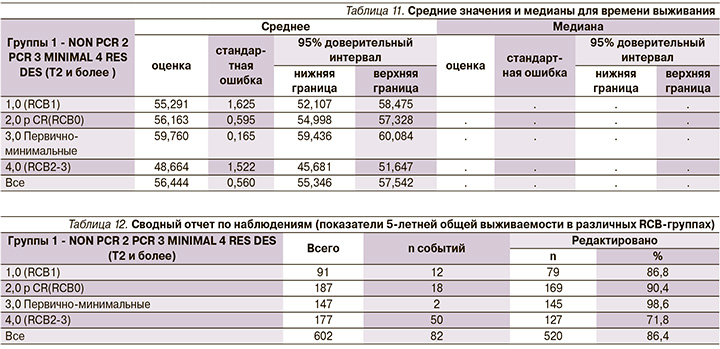
Дополнение к табл. 11. Медиана не достигнута.
Обсуждение
Одним из преимуществ проведения НСТ является снижение стадии заболевания и возможность выполнения органосберегающих операций (секторальной резекции) вместо полного удаления ткани молочной железы (мастэктомии). Благодаря развитию системного лечения растет доля выполнения именно органосохраняющих операций даже при биологически агрессивных подтипах РМЖ.
Данная работа отвечает на вопрос: может ли регрессирование опухолевого узла до размера минимальной карциномы на фоне неоадъювантной системной химиотерапии быть обособленным фактором, влияющим на улучшение показателей выживаемости?
При проведенном нами анализе данных выяснилось, что показатели выживаемости (DFS и OS) у пациентов с минимальной резидуальной опухолью после проведенной НСТ оказались не сопоставимыми с аналогичными показателями в группе пациентов с первично минимальным РМЖ. В нашем исследовании в группе пациентов с первично минимальным инвазивным РМЖ (подтвержденным патоморфологическим исследованием) показатель 5-летней общей выживаемости (OS) составил 90,4%, 5-летней безредицивной выживаемости (DFS) – 78,6%. В группе пациентов с минимальной резидуальной опухолью (ypT1abN0) аналогичные показатели составили 86,8 и 72,5% соответственно.
Дополнительно в нашем исследовании мы провели оценку показателей выживаемости группы пациентов, достигших pСR на фоне НСТ. Показатели выживаемости составили: 5-летняя общая выживаемость – 90,4%, 5-летняя безрецидивная выживаемость – 78,6%.
Также благодаря проведенной оценке показателей выживаемости среди различных ИГХ подтипов РМЖ в зависимости от степени патоморфологического регресса по шкале RCB выявлено, что при ER+-карциноме реже всего происходит достижение pCR. Интересным остается факт, что при изучении отдаленных результатов показатели безрецидивной и общей выживаемости в этой группе при достижении как патоморфологического полного ответа (RCB 0) (89,6 и 91,7%), так и при резидуальном минимальном раке (RCB 1) (78,8 и 87,5%) не уступают другим биологическим подтипам (ТНМРЖ и HER2-позитивному). Безусловно, это остается предметом дальнейшего изучения.
Заключение
Среди 455 пациентов с РМЖ II и III стадий у 91 (20,6%) и 177 (38,4%) пациентов отмечался менее выраженный ответ. У 20% пациентов, достигших частичного клинического ответа (cPR) после проведения НСТ, выявлены минимальные резидуальные опухоли при патоморфологическом исследовании операционных препаратов. И наоборот, у 15% пациентов с полным клиническим ответом при патоморфологическом исследовании выявлено резидуальное заболевание. При достижении патоморфологического полного ответа опухоли на НСТ (RCB 0) показатели 5-летней безрецидивной (DFS) и общей (OS) выживаемости (DFS – 78,5%; OS – 90,4%) уступают показателям выживаемости пациентов с первично минимальным РМЖ (pT1ab N0M0) [DFS – 86,4%; OS – 98,6%].
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы на соискание ученой степени канд. мед. наук: «Эффективность органосохра-няющего лечения минимальных резидуальных опухолей после неоадъювантной терапии рака молочной железы».



