Введение
Респираторно-синцитиальный вирус (РСВ) – наиболее частая причина инфекций нижних дыхательных путей (ИНДП) у детей раннего возраста [1], ведущая причина заболеваемости и смертности в данной популяции по причине вирусной инфекции [2]. К 2-летнему возрасту большинство детей как минимум один раз переносят РСВ инфекцию [3]. Систематический анализ H. Nair (2010) продемонстрировал, что в 2005 г. в мире было зарегистрировано примерно 30 млн случаев заболеваний нижних дыхательных путей, связанных с РСВ, ставших причиной более 2 млн случаев госпитализации и 66 тыс.–199 тыс. смертельных исходов [1]. Ряд факторов риска, таких как недоношенность, бронхолегочная дисплазия (БЛД), врожденные пороки сердца (ВПС) или сопутствующие заболевания, могут приводить к более тяжелому течению РСВ инфекции [4]. На большей части территории земного шара РСВ инфекции обычно носят сезонный характер. В условиях умеренного климата северного полушария эпидемический сезон РСВ инфекции обычно начинается в промежутке между ранней и поздней осенью и заканчивается ранней весной. Тем не менее эпидемические сезоны РСВ инфекции из года в год могут отличаться по времени наступления и окончания, продолжительности и географическому распространению [5, 6].
Лечение детей, болеющих РСВ инфекцией, заключается в первую очередь в поддерживающей терапии, в частности в обеспечении восполнения потери жидкости и поддержании уровня содержания кислорода в крови [7]. Отсутствие одобренной вакцины против РСВ инфекции и случаи повторного инфицирования [8, 9] в дальнейшем ограничивают возможности врачей предупреждать и лечить тяжелые заболевания, ассоциированные с РСВ. В этом аспекте безопасное и эффективное профилактическое применение паливизумаба, гуманизированного моноклонального антитела, специфического к F-протеину РСВ [10], приводящее к снижению частоты госпитализации недоношенных детей с гестационным возрастом (ГВ) ≤35 недель в возрасте ≤6 месяцев и детей с БЛД или ВПС по поводу РСВ инфекции, приобрело неоспоримую ценность [11, 12]. Паливизумаб был одобрен контрольными органами США и Европы в целях предотвращения тяжелых ИНДП, ассоциированных с РСВ у детей с высоким риском развития тяжелого течения этой инфекции [13, 14].
Как и в других странах мира, в Российской Федерации (РФ) РСВ инфекция является серьезной проблемой здравоохранения. В проспективном эпидемиологическом исследовании, проведенном в РФ в эпидемический сезон РСВ инфекции с сентября 2008 по апрель 2009 г. (n=519 детей), 38% детей младше 2 лет, госпитализированных с ИНДП, имели положительную реакцию при тестировании на РСВ, а в период наивысшего подъема заболеваемости РСВ инфекцией (апрель 2009) положительная реакция была у 62% [15]. Недоношенность служила предрасполагающим фактором возникновения тяжелого течения РСВ инфекции у таких детей [16].
Было проведено три клинических многоцентровых исследования по эффективности и безопасности применения препарата паливизумаб, которые проходили либо только на территории РФ, либо с включением российских исследовательских центров в международные многоцентровые исследования. Для обеспечения более полного и тщательного анализа безопасности и эффективности паливизумаба при применении в отношении детей с высоким риском тяжелого течения РСВ инфекции мы объединили и провели совокупный анализ данных о пациентах, принимавших участие в данных исследованиях в РФ.
Материал и методы
Дизайн исследований и популяция пациентов
Три исследования по оценке безопасности и эффективности паливизумаба (MI-CP110, MI-CP124 и W10-664) осуществлялись полностью или частично в РФ в течение одного или более сезонов РСВ [17–19]. Исследования MI-CP110 и MI-CP124 выполнялись «МедИммун, ЛЛС», (Гейтерсберг, Мэрилэнд), а исследование W10-664 осуществлялось «ЭббВи Инк.» (Северный Чикаго, Иллинойс; США). В исследованиях MI-CP110 и MI-CP124 проведено сравнение безопасности и эффективности применения паливизумаба и мотавизумаба (еще одного исследуемого препарата для профилактики РСВ на основе моноклональных антител). В эти исследования (MI-CP110 и MI-CP124) включены также пациенты, находившиеся за пределами РФ; тем не менее в этом анализе использованы данные участников исследований только из РФ, которым профилактически назначали паливизумаб и мотавизумаб. Участники всех трех исследований, которым назначался паливизумаб, получали ежемесячные внутримышечные инъекции (15 мг/кг) каждые 30 дней во время эпидемического сезона РСВ. Участники исследований MI-CP124 и W10-664, перенесшие операцию по поводу врожденного порока сердца, получили дополнительную инъекцию паливизумаба в связи с необходимостью применения искусственного кровообращения во время операции.
Для всех трех исследований к стандартным критериям исключения отнесены госпитализация во время рандомизации (за исключением случаев, когда выписка предполагалась в течение 10–21 дней); исскуственная вентиляция легких или иные методы механической поддержки дыхания; ожидаемая продолжительность жизни <6 месяцев; судорожный синдром или нестабильное неврологическое расстройство (а именно эпилепсия, декомпенсированная гидроцефалия); указания в анамнезе на наличие иммунодефицита, аллергия на препараты иммуноглобулина; прием паливизумаба, поликлональных или моноклональных препаратов для профилактики РСВ или любого другого поликлонального антитела в течение трех месяцев до рандомизации.
Данные исследования выполнены в соответствии с этическими принципами, установленными Хельсинкской декларацией, руководством Международной конференции по гармонизации в соответствии с надлежащей клинической практикой, а также местными этическими комитетами организаций. Во всех исследованиях от родителей участников исследования или их официальных представителей было получено письменное информированное согласие. Далее следует более подробная информация по всем вышеуказанным исследованиям.
Исследование MI-CP110
MI-CP110 (ClinicalTrials.gov, идентификационный № NCT00129766) было рандомизированным двойным слепым паливизумаб-контролируемым многоцентровым международным исследованием фазы III, осуществленным в течение двух сезонов РСВ инфекции в северном полушарии (2004–2005 и 2005–2006) и одного сезона РСВ в южном полушарии (2005) [17]. Каждый из участников принимал участие в исследовании в течение одного сезона РСВ. Детей с риском развития тяжелого течения РСВ инфекции рандомизировали в отношении 1:1 на получение в общей сложности пяти инъекций либо паливизумаба, либо мотавизумаба (15 мг/кг). Подходящие для участия в исследовании пациенты были в возрасте ≤24 месяцев на момент рандомизации и имели диагноз БЛД, требующий медицинского вмешательства/лечения (т.е. получения кислорода, бронходилататоров или диуретиков) в течение 6 месяцев до рандомизации, или имели ГВ при рождении ≤35 недель и были в возрасте ≤6 месяцев при рандомизации.
За исключением стандартных для всех трех исследований критериев исключения, пациенты также исключались в случае, если они страдали РСВ инфекцей в активной фазе, почечной недостаточностью или нарушением функции печени, ВПС или их мать была инфицирована ВИЧ (за исключением случаев, когда было установлено, что ребенок не инфицирован). Детей исключали также в том случае, если они должны были получать паливизумаб или внутривенный иммуноглобулин во время исследования или ранее получали вакцину от РСВ. Дети с неосложненным или осложненным ВПС, но без признаков нарушения гемодинамики могли быть включены в исследование [17].
Исследование MI-CP124
MI-CP124 (ClinicalTrials.gov, идентификационный № NCT00538785) – рандомизированное двойное слепое паливизумаб-контролируемое многоцентровое международное исследование фазы III, осуществленное в северном полушарии во время двух сезонов РСВ (2005–2006 и 2007–2008) [18]. Каждый пациент принимал участие в исследовании в течение одного сезона РСВ инфекции. В исследование включены дети с гемодинамически значимым ВПС. Пациенты были рандомизированы в отношении 1:1 для получения в общей сложности пяти инъекций либо паливизумаба, либо мотавизумаба (15 мг/кг). Пациенты, перенесшие операцию на сердце с сердечно-легочным шунтированием, получали дополнительную дозу исследуемого препарата сразу после операции при условии определения лечащим врачом отсутствия противопоказаний к проведению внутримышечной инъекции.

Для включения в исследование пациенты должны были соответствовать всем следующим критериям:
- возраст ≤24 месяцев при рандомизации;
- документально подтвержденный гемодинамически значимый ВПС;
- неоперированный или частично скорректированный ВПС.
У детей с пороком сердца белого типа должна была быть легочная гипертензия (давление в легочной артерии ≥40 мм рт.ст.) или же они должны были нуждаться в ежедневном приеме препаратов для лечения ВПС. Дети с неосложненными небольшими дефектами межпредсердной или межжелудочковой перегородки или незаращением артериального протока, стенозом аорты, стенозом клапана легочной артерии или изолированным сужением аорты для включения в исследование не подходили.
Помимо критериев исключения, стандартных для всех трех исследований, к критериям исключения также относились нестабильный статус сердечной или дыхательной деятельности, включая тяжелые пороки сердца, при которых не ожидалось продолжительной выживаемости или при которых предполагалось проведение пересадки сердца; предполагаемая операция на сердце в течение двух недель до рандомизации; острое респираторное заболевание или другая острая инфекция или заболевание; инфицирование матери ВИЧ (за исключением случаев, в которых было установлено, что ребенок не инфицирован); участие в другом исследовании в текущий момент.
Исследование W10-664
W10-664 (ClinicalTrials.gov, идентификационный № NCT01006629) – III фазы, проспективное многоцентровое открытое несравнительное исследование безопасности и эффективности профилактического назначения паливизумаба детям с высоким риском развития респираторно-синцитиальной вирусной инфекции в Российской Федерации [19]. Дети включались в исследование в течение одного сезона (2009–2010) в РФ. В зависимости от даты включения пациенты получили от трех до пяти инъекций. Пациенты, которые перенесли операцию на сердце с сердечно-легочным шунтированием во время периода профилактики, получали дополнительные 15 мг/кг паливизумаба посредством внутримышечной инъекции, как только позволяло их состояние. Пациенты, подходившие для включения в исследование, соответствовали как минимум одному из следующих критериев:
- ГВ при рождении ≤35 недель и возраст ≤6 месяцев при включении;
- возраст ≤24 при включении и диагноз БЛД (определяемый как потребность в кислороде при скорректированном ГВ 36 недель), требующий вмешательства/лечения (т.е., назначения дополнительно кислорода, диуретиков, бронходилататоров или кортикостероидов) в любое время в течение 6 месяцев перед включением в исследование;
- возраст ≤24 месяцев при включении, наличие гемодинамически значимого цианотического либо ацианотического ВПС, не оперированного или частично скорректированного.
У детей с ацианотическими пороками сердца должна была быть легочная гипертензия (давление в легочной артерии ≥40мм рт.ст. при ультразвуковом исследовании) или необходимость в ежедневном приеме препаратов для лечения ВПС.
Помимо стандартных для всех исследований критериев исключения к критериям исключения относились респираторное заболевание в активной фазе или другая острая инфекция; почечная или печеночная недостаточность, установленная исследователем, и такие состояния, как гемодинамически незначимые небольшие дефекты перегородки предсердия или желудочка, незаращение артериального протока, стеноз клапана легочной артерии или изолированный стеноз аорты.
Конечные критерии оценки в исследованиях
Первичным показателем эффективности служила частота случаев госпитализации, связанной с РСВ инфекцией, которая идентифицировалась с использованием жидкости, взятой с помощью бронхоальвеолярного лаважа и носоглоточных смывов с применением стандартного метода количественного определения РСВ с помощью полимеразной цепной реакции с обратной транскриптазой в реальном времени (исследования MI-CP110 и MI-CP124) или иммунохроматографического экспресс-метода выявления РСВ QuickStripe (Savyon Diagnositics Ltd, Ashdod, Израиль; исследование W10-664).
Возникшие после начала лечения нежелательные явления (НЯ; классифицировавшиеся по тяжести), включая НЯ, связанные с исследуемым препаратом и приведшие к прекращению приема препарата или смерти, регистрировались в течение 150 дней после получения первой инъекции паливизумаба в исследованиях MI-CP110 и MI-CP124 и в течение 100 дней после последней инъекции паливизумаба в исследовании W10-664. Классификация НЯ проводилась согласно классификации органов и систем и предпочтительной терминологии Медицинского словаря регуляторной деятельности (MedDRA – Medical Dictionary for Regulatory Activities) версии 9.0 (исследование MI-CP110), версии 11.1 (исследование MI-CP124) и версии 13.0 (исследование W10-664). НЯ из исследований MI-CP110 и MI-CP124 для данного анализа регистрировались согласно терминам словаря MedDRA версии 13.0.
Статистический анализ
Данные обобщены описательным способом. Для непрерывных переменных были рассчитаны среднее значение, стандартное отклонение (СО), медиана, минимальное и максимальное значения. Продолжительность воздействия рассчитывалась как общее время с момента первой инъекции исследуемого препарата до момента последней инъекции +100 дней. Для каждого из исследований и для всех трех исследований вместе с использованием метода Клоппера–Пирсона рассчитывался верхний предел двустороннего доверительного интервала (ДИ) 95% для доли пациентов как минимум с одним случаем госпитализации в связи с РСВ.
Результаты
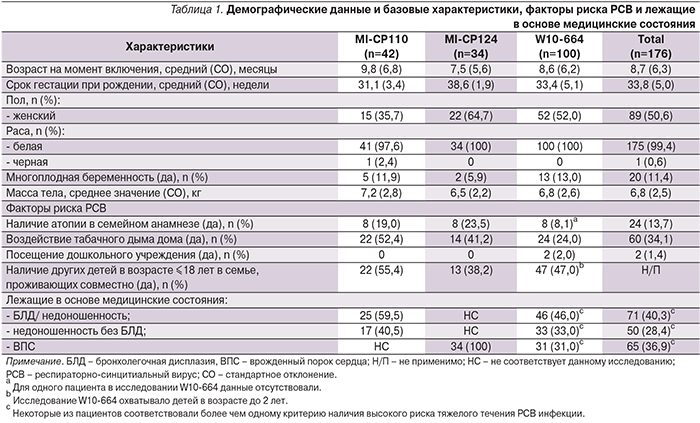
В трех исследованиях по изучению эффективности и безопасности профилактического применения паливизумаба, проведенных в исследовательских центрах РФ, приняли участие 176 пациентов. В двух международных исследованиях из РФ участвовали 42 пациента в исследовании MI-CP110 (сезон 1: ноябрь/декабрь 2004, n=15; сезон 2: ноябрь/декабрь 2005, n=27) и 34 пациента в исследовании MI-CP124 (сезон 1: ноябрь/декабрь 2005, n=17; сезон 2: декабрь 2007, n=17). В российское исследование W10-664 в ноябре/декабре 2009 г. были включены 100 пациентов. Всего 7 (7/176; 4,0%) пациентов прекратили участие в исследованиях. В исследовании MI-CP124 1 пациент (1/34; 2,9%) из РФ умер.
В исследовании W10-664 6 (6/100; 6,0%) пациентов прекратили прием препарата: 1 – в связи с НЯ, 1 – в связи с отказом родителей от участия в исследовании и 4 – в связи с тем, что родители не могли или не хотели осуществлять визиты в исследовательские центры. Демографические данные приведены в табл. 1.
Хотя общее число пациентов женского (89/176; 50,6%) и мужского (87/176; 49,4%) пола было примерно одинаковым, в разных исследованиях наблюдались различия по полу (MI-CP110: 15/42 пациентов женского пола, 35,7%; MI-CP124: 22/34 пациентов женского пола, 64,7%). Восемнадцать (18/42; 42,9 %) пациентов в исследовании MI-CP110, 20 (20/34; 58,8%) в исследовании MI-CP124 и 49 (49/100; 49,0%) пациентов в исследовании W10-664 были в возрасте ≤6 месяцев на момент включения.
В исследовании W10-664 (24/100; 24,0%) воздействию табачного дыма подвергались меньше пациентов, чем в исследованиях MI-CP110 (22/42; 52,4%) и MI-CP124 (14/34; 41,2%). Во всех трех исследованиях средний ГВ пациентов был одинаковым; среднее значение (СО) ГВ в неделях составляло 31,1 (3,4) в исследовании MI-CP110, 38,6 (1,9) в исследовании MI-CP124 и 33,4 (5,1) в исследовании W10-664. Среднее значение (СО) возраста в месяцах при включении в исследование составляло 9,8 (6,8) для исследования MI-CP110, 7,5 (5,6) для исследования MI-CP124 и 8,6 (6,2) для исследования W10-664. В исследовании W10-664 33 (33%) из 100 пациентов были рождены со сроком ≤35 ГВ и на момент включения находились в возрасте ≤6 месяцев. В исследовании MI-CP110 у 25 (59,5%) из 42 пациентов диагностирована БЛД. В исследовании MI-CP124 у всех пациентов был диагностирован ВПС. В исследовании W10-664 у 46 (46,0%) из 100 пациентов диагностировали БЛД и у 31 (31,0%) из 100 пациентов – ВПС.
Прием паливизумаба
При совокупном анализе 138 (78,4%) из 176 пациентов получили 5 доз паливизумаба (табл. 2).
Почти все пациенты, принимавшие участие в исследованиях MI-CP110 (41/42; 97,6%) и MI-CP124 (32/34; 94,1%), получили 5 инъекций.
И напротив, пациенты, принимавшие участие в исследовании W10-664, включенные в исследование в декабре 2009 г., получили только 4 инъекции по протоколу; поэтому только 65 (65,0%) из 100 пациентов в данном исследовании получили 5 инъекций. Два пациента из исследования W10-664 получили дополнительную инъекцию после операции на сердце и, таким образом, в общей сложности получили 6 инъекций. Среднее значение продолжительности воздействия составило 220,3 (9,7) дня по исследованию MI-CP110, 219,9 (11,8) по исследованию MI-CP124 и 204,9 (26,2) дня по исследованию W10-664.
Частота случаев госпитализации в связи с РСВ инфекцией
В исследованиях MI-CP110, MI-CP124 и W10-664 случаев госпитализации в связи с РСВ инфекцией не было. Верхнее значение ДИ 95% составило 8% по исследованию MI-CP110, 10% по исследованию MI-CP124, и 4% по исследованию W10-664.
Безопасность и переносимость
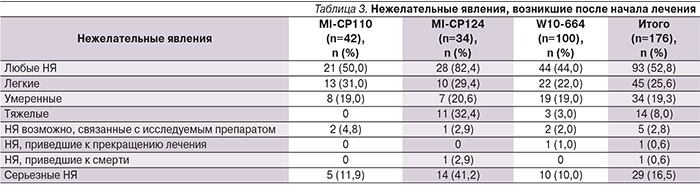
В протоколе было установлено, что у пациентов в данных исследованиях уже наблюдались исходные патологические состояния и поэтому для них был характерен более высокий риск возникновения НЯ во время курса профилактики. Вызванные началом лечения НЯ, зарегистрированные в трех исследованиях, представлены в табл. 3.
В комбинированных результатах трех исследований у 93 (52,8%) из 176 пациентов наблюдались НЯ. Частота НЯ варьировалась от 44,0% (44/100) в исследовании W10-664 до 82,4% (28/34) в исследовании MI-CP124.
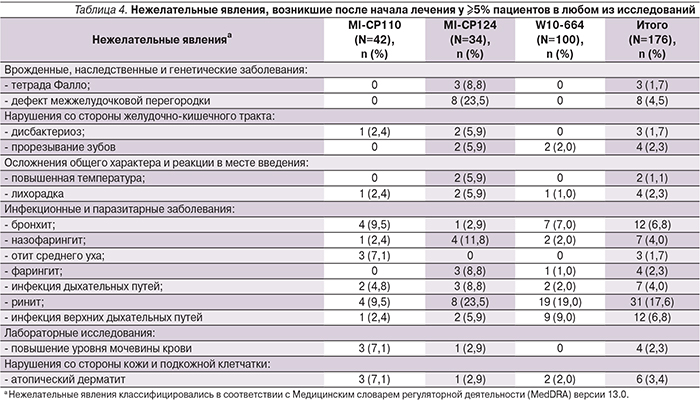
В целом в трех исследованиях наиболее часто регистрируемыми НЯ, возникшими у ≥5% пациентов, были ринит (17,6%; 31/176), инфекции верхних дыхательных путей (6,8%; 12/176) и бронхит (6,8%; 12/176; табл. 4).
Большинство НЯ по степени тяжести были признаны легкими или умеренными. В целом у 14 (8,0%) из 176 пациентов были зарегистрированы тяжелые НЯ; ни у 1 – в исследовании MI-CP110 и 3 – в исследовании W10-664 (аритмия, пневмония, тонзиллит). И наоборот, тяжелые НЯ отмечены у большей доли пациентов исследования MI-CP124 (11/34; 32,4%), возможно, в связи с тем, что у пациентов в данном исследовании были тяжелые гемодинамически значимые ВПС.
В целом в комбинированных результатах исследований только у 5 пациентов были зарегистрированы НЯ, которые были, возможно, минимально связаны с исследуемым препаратом: рвота (MI-CP110), ринит и атопический дерматит (W10-664). Вероятно, связанным с исследуемым препаратом НЯ была лихорадка (MI-CP110) у пациента, у которого также зарегистрировали рвоту и повышение температуры тела (MI-CP124). Единственный случай прекращения лечения в связи с НЯ (атопический дерматит) был зарегистрирован в исследовании W10-664. В общей сложности в комбинированных исследованиях было зафиксировано 29 (16,5%) серьезных НЯ (табл. 3). Наибольший процент пациентов с серьезными НЯ (14/34; 41,2%) наблюдался в исследовании MI-CP124, большинством из которых стали проявления со стороны сердечно-сосудистой системы. Это было связано с тем, что многие из пациентов, включенных в это исследование, страдали ВПС с нарушением гемодинамики. Другими часто встречающимися НЯ являлись бронхит (MI-CP110, n=1; W10-664, n=4) и энтерит (W10-664, n=3). Ни одно из серьезных НЯ не было связано с исследуемым препаратом. Только в одном из проведенных исследований в связи с НЯ умерла одна пациентка с врожденной атрезией клапана легочной артерии, при этом не было выявлено связи с исследуемым препаратом. Данная пациентка женского пола (из исследования MI-CP124) была рождена на 36-й неделе гестации и в момент включения в исследование находилась в возрасте 10,2 месяца. Состояние пациентки ухудшилось после операции, и она умерла в возрасте 12,3 месяца. Она получила 3 инъекции паливизумаба. Вскрытие показало, что причиной смерти стала полиорганная недостаточность.
Обсуждение
В трех клинических исследованиях, частично или целиком проведенных в РФ, не было зарегистрировано ни одного случая госпитализации, связанной с РСВ инфекцией. Эти данные вместе с более низкими по сравнению с ранее опубликованными исследованиями показателями НЯ и серьезных НЯ, возникших в течение лечения [11, 12], доказывают эффективность и безопасность паливизумаба для детей в РФ с высоким риском госпитализации по поводу РСВ инфекции. Сравнительно большая доля пациентов с НЯ в исследовании MI-CP124 может быть связана с предрасположенностью пациентов к НЯ в связи с сердечно-сосудистой патологией и гемодинамически значимыми ВПС. Это выразилось в преобладании тяжелых НЯ со стороны сердца, зарегистрированных в данном исследовании (дефект межпредсердной перегородки, гипоплазия легких, врожденная атрезия трехстворчатого клапана сердца, тетрада Фалло, дефект межжелудочковой перегородки (5 пациентов), а также воспаление желудочно-кишечного тракта, полиорганная недостаточность и инфекция дыхательных путей).
В более ранних базовых предрегистрационных клинических исследованиях паливизумаба, проведенных в Соединенных Штатах Америки и Европейском Союзе, участвовали в основном пациенты из Северной Америки [11, 12]. Тем не менее различия генетических факторов и наследственности пациентов, стандарты доступной медицинской помощи, специфика питания и распространенность разных факторов риска тяжелой РСВ инфекции [20, 21] являются теми причинами, по которым местные органы здравоохранения перед одобрением лекарственного препарата могут потребовать проведения дополнительных исследований с участием местной популяции [22]. Наблюдались некоторые различия в демографических и базовых характеристиках популяции детей, включенных в исследования в РФ, и детей из предыдущих базовых исследований. Пациенты из исследований, проведенных в РФ, были практически на 100% белой расы (по сравнению с 58,4–70,9% пациентов белой расы в базовых исследованиях), а также меньше пациентов посещали детские дошкольные учреждения (2% по сравнению с 6,7–11,9%). Несмотря на данные различия в характеристиках пациентов, данные по безопасности и эффективности паливизумаба в исследованиях, проведенных в РФ, были аналогичными результатам, полученным в исследованиях, проведенных в Северной Америке и Европе [11, 12, 23].
Особую значимость данного анализа определяет то, что безопасность и эффективность паливизумаба в РФ были подтверждены в трех отдельных исследованиях, осуществленных во время различных временны'х периодов. Более того, в исследование W10-664 были включены пациенты из 6 городов географически разных регионов страны [19], что также выступает в поддержку эффективности иммунопрофилактики паливизумабом в большой стране с географически разнородной популяцией пациентов. Ограничивающий факт заключается в следующем: 2 исследования (MI-CP110 и MI-CP124) включали небольшое число пациентов из РФ и недостаточные группы контроля. Число пациентов из РФ, включенных в исследования MI-CP110 и MI-CP124, было небольшим в связи с тем, что последние считались частью крупных международных исследований. Более того, определить абсолютную эффективность паливизумаба в данной популяции было невозможно по этическим соображениям, которые не предполагают прерывания необходимой профилактики у детей с высоким риском тяжелого течения РСВ инфекции.
Паливизумаб был одобрен к применению в РФ в 2010 г. [15]. Представленные данные трех исследований подтверждают вывод о том, что паливизумаб хорошо переносится и высокоэффективен в отношении детей РФ, имеющих высокий риск развития тяжелого течения РСВ инфекции.
Заявление о финансовой поддержке: Это исследование осуществлено при финансовой поддержке AbbVie Inc. Компания AbbVie Inc. была вовлечена в разработку дизайна исследования, сбор и анализ информации, интерпретацию результатов, создание манускрипта, принятие решения о публикации манускрипта.
Конфликты интересов/раскрытие информации: Дизайн, проведение исследования и финансовая поддержка клинического исследования W10-664 осуществлена AbbVie Inc. AbbVie Inc. принимала участие в интерпретации результатов, ревьюировании и одобрении данного манускрипта. ED, GN, GS и NK-D являются сотрудниками компании AbbVie Inc. и могут иметь акции компании. BH – сотрудник компании MedImmune. LN-B, TVT, ESK, IVD и AG не имеют конфликтов интересов и никаких финансовых активов в данных компаниях. Поддержка в написании статьи осуществлена Daniel McCallus, PhD из организации Complete Publication Solutions, LLC, Horsham, PA; эта поддержка финансировалась AbbVie Inc. Статистический анализ для W10-664 был проведен Acromion GmbH, Frechen, Germany под руководством Natalia Kan-Dobrosky, PhD, of AbbVie Inc.
Авторы/уведомления: TVT and GN придумали и разработали дизайн исследования. LNB, TVT, ESK, IVD, и AG принимали участие в сборе данных. Все авторы участвовали в разработке дизайна и ревизии манускрипта, вычитывали и одобряли финальную версию манускрипта. Авторы осуществляли полный редакторский контроль за содержанием манускрипта.
Благодарности
Авторы выражают признательность пациентам и их родителям, а также всем участникам исследований, ставших основой для данного мануск-рипта.



