Введение
Одной из серьезнейших общемировых проблем современной медицины, актуальной для всех стран и социальных групп населения, по-прежнему остается сахарный диабет (СД) [1]. Стремительный рост заболеваемости СД определяется прежде всего увеличением числа пациентов с СД 2 типа (СД2). В последние годы отмечается повышение доли лиц с впервые диагностированным СД2 среди лиц молодого и среднего возраста, для которых максимально быстрое достижение компенсации углеводного обмена и поддержание стойкой нормогликемии на протяжении длительного времени имеет крайне высокую значимость в плане прогноза заболевания.
Спектр терапевтических опций при СД2 в последние годы существенно расширился за счет появления новых классов сахароснижающих препаратов и новых представителей внутри каждого класса. Однако, согласно национальным и международным клиническим рекомендациям, метформин остается препаратом выбора при инициации фармакотерапии у лиц с впервые диагностированным СД2 [2, 3]. Анализ структуры медикаментозной антидиабетической терапии в Российской Федерации позволяет говорить о том, что метформин является наиболее часто назначаемым в варианте монотерапии сахаро-снижающим препаратом (ССП), доля которого составляет 69,5% [4]. Несмотря на столь широкое применение данного лекарственного средства (ЛС), в реальной клинической практике наблюдается значительная вариабельность фармакологического эффекта метформина и с точки зрения его антигипергликемического действия, и при оценке частоты развития побочных эффектов терапии. Так, примерно трети пациентов исходно не удается достичь целевых показателей компенсации углеводного обмена на фоне монотерапии метформином, а у части больных с течением времени наблюдается потеря первично достигнутого гликемического контроля [5].
В то же время 5–10% пациентов требуется полная отмена препарата в связи с развитием выраженных побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ).
Причины наблюдаемой значительной вариабельности ответа на терапию метформином заключаются в сложном взаимодействии многих небиологических и биологических факторов [6]. Среди биологических факторов особый интерес представляют факторы генетические – точечные однонуклео-тидные замены (ОНП – однонуклеотидные полиморфизмы) в определенных генах, определяющие генетически обусловленный вклад в индивидуальный фармакологический ответ [7].
Первоначальные исследования в области фармакогенетики метформина были сфокусированы на генах-кандидатах, кодирующих молекулы белков-переносчиков, определяющих индивидуальную фармакокинетику препарата. В частности, при изучении полиморфизмов генов SLC22A1 (rs622342) и SLC47A1 (rs2289669), кодирующих соответственно транспортер органических катионов OCT1 и транспортер с множественной лекарственной и токсиновой экструзией MATE1, были получены результаты, убедительно свидетельствующие о влиянии данных полиморфных вариантов на восприимчивость к терапии метформином в когортах пациентов с впервые выявленным СД2 [8, 9].
За последние 10 лет применение методологии полногеномного поиска ассоциаций (GWAS – Genome-Wide Association Studies) позволило выявить множественные регионы, ассоциированные с риском развития СД2, клиническими фенотипами и ответом на терапию различными ССП. Полиморфизмы генов KCNJ11 и TCF7L2 привлекают особое внимание исследователей, поскольку было показано, что они имеют принципиальное значение в патогенезе СД2 и могут модифицировать эффекты многих антидиабетических лекарственных средств.
Ген KCNJ11 локализуется на коротком плече 11-й хромосомы (11р15.1.) и кодирует субъединицу Kir6.2 АТФ-зависимых калиевых каналов, опосредующих гомеостаз глюкозы [10]. Полиморфный маркер rs5219 в гене KCNJ11 связан с риском развития СД2 во многих популяциях Европы и Восточной Азии [11]. Исследования в области влияния ОНП rs5219 (С>Т) в гене KCNJ11 на терапевтический эффект метформина долгое время были ограничены рамками работ, посвященных профилактике СД, в ходе которых были подтверждены гипотезы о нарушении секреции инсулина и сниженном профилактическом эффекте метформина при носительстве вариантного аллеля Т [12]. Позднее в исследовании И.А. Лапик и соавт., включившем 120 пациенток с СД2 и ожирением, была выявлена ассоциация между полиморфным генотипом ТТ по локусу rs5219 и достоверно более низким уровнем глюкозы крови, а также более выраженным снижением массы тела после применения 2000 мг метформина [13].
Ген TCF7L2 локализован в регионе 10q25.3 и кодирует транскрипционный фактор 7, подобный второму фактору (ранее известному как Tcf4) сигнального пути Wnt, реализующего передачу сигнала с поверхности клетки в ядерную ДНК. Установлено, что эффекторы сигнального пути Wnt могут опосредовать функцию и экспрессию рецепторов инкретиновых гормонов, контролировать экспрессию гена проглюкагона, регулировать скорость превращения проинсулина в инсулин [14]. Полиморфный маркер rs7903146 (С>Т) в гене TCF7L2 определяет нарушение глюкозо-стимулированной секреции инсулина и является самым сильным генетическим фактором риска, ассоциированным с СД2 в различных этнических группах [15]. Результаты масштабного исследования GoDARTS (2007) позволили установить, что полиморфный аллель Т rs7903146 гена TCF7L2 был связан с повышенным риском неэффективности лечения сульфонилмочевиной, но не оказывал влияния на терапевтический ответ пациентов, получавших метформин [16]. С другой стороны, в работе отечественных авторов анализ результатов терапии метформином 38 детей с метаболическим синдромом и ожирением показал более выраженное снижение массы тела и нормализацию углеводного обмена у пациентов с генотипом СТ по полиморфному локусу rs7903146 гена TCF7L2 [17].
S. Srinivasan et al. в экспериментальном исследовании, посвященном изучению генетики острого ответа на метформин и глипизид у лиц без диабета, обнаружили, что вариант rs7903146 (C>T) в факторе транскрипции TCF7L2 ассоциировался с бόльшим снижением уровня глюкозы натощак после приема метформина [18]. Следующее исследование, предпринятое в 2019 г., выявило позитивное влияние носительства полиморфного варианта rs7903146 гена TCF7L2 на маркеры инсулинорезистентности и гликемического ответа 86 пациентов с недавно диагностированным СД2 в течение первого года лечения метформином [19].
Таким образом, представленные в мировой научной литературе данные свидетельствуют о том, что имеется связь между восприимчивостью к метформину и ОНП генов, кодирующих структурные субъединицы калиевых каналов и транскрипционный фактор TCF7L2. При этом роль полиморфизмов rs5219 гена KCNJ11 и rs7903146 гена TCF7L2 в модуляции эффекта метформина до конца не определена. По всей видимости, дальнейшие исследования по изучению вклада данных генетических вариантов в формирование индивидуального фармакологического ответа на метформин будут способствовать развитию дифференцированного подхода к его назначению при впервые выявленном СД2. Ввиду очевидной актуальности углубленного изучения вопросов фармакогенетики метформина нами было предпринято соответствующее исследование.
Цель исследования: изучить роль полиморфных вариантов rs5219 гена KCNJ11 и rs7903146 гена TCF7L2 в индивидуальном ответе пациентов с впервые выявленным СД2 на терапию метформином.
Методы
Исследование проводилось на базе кафедры эндокринологии им. акад. В.Г. Баранова ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава РФ. В открытое проспективное когортное исследование были включены 77 пациентов (30 мужчин и 47 женщин) в возрасте от 33 до 69 лет с впервые выявленным СД2, имевших избыточную массу тела или ожирение.
В исследование не включались больные, имевшие противопоказания к приему метформина, показания к инсулинотерапии, хронические заболевания в стадии обострения, психические заболевания или иные факторы, влияющие на приверженность терапии. Протокол исследования был рассмотрен и одобрен локальным этическим комитетом ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава РФ. Перед началом любых процедур после разъяснения цели работы, применяемых методов и способов использования полученных данных каждый пациент подписал информированное добровольное согласие на участие в настоящем исследовании.
Для верификации диагноза использовались современные диагностические критерии СД. У всех пациентов – участников исследования до начала фармакотерапии производился тщательных сбор анамнеза и жалоб, антропометрическое обследование по общепринятым методикам с расчетом индекса массы тела (ИМТ) по формуле Quetelet. Для проведения лабораторных исследований использовались образцы сыворотки, полученные при центрифугировании пробирок с цельной венозной кровью со скоростью 1,5 тыс. об/мин в течение 15 минут при комнатной температуре. Наряду с общеклиническим обследованием у больных оценивали уровни глюкозы крови натощак (ГКН) и постпрандиально (ГКП) гексокиназным методом уровень гликированного гемоглобина (HbA1c) иммунотурбидиметрическим методом.
После проведенного первичного обследования всем включенным в исследование пациентам с установленным диагнозом СД2 назначали диету № 9а и метформин в начальной дозе 1500 мг/сут. с последующим динамическим наблюдением. Показатели ИМТ, ГКН, ГКП и HbA1c измеряли исходно, затем через 3 и 6 месяцев после начала лечения метформином. В случае сохраняющейся гипергликемии на фоне стартовой терапии метформином дозу препарата титровали или назначали комбинацию ССП. Результаты терапии оценивались в группах больных, получавших монотерапию метформином и комбинированную сахароснижающую терапию. Через 6 месяцев наблюдения также анализировали частоту и характер побочных эффектов, возникших на фоне приема препарата. При этом проводилось сопоставление полученных данных в группах пациентов с диким и полиморфным вариантами изучаемых генов.
Материалом для молекулярно-генетического тестирования послужила цельная венозная кровь, которую забирали однократно при включении пациента в исследование, замораживали и хранили при температуре -70°С до проведения анализа. Для выделения геномной ДНК применяли сорбентный метод с использованием набора реактивов «Проба-ГС-Генетика» (ДНК-Технология, Россия). Затем методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) выполняли генотипирование по полиморфизмам Glu23Lys (rs5219) гена KCNJ11 и IVS3, C/T (rs7903146) гена TCF7L2 с применением соответствующих наборов реагентов (Синтол, Россия). Регистрация флуоресценции по каналам FAM и HEX позволяла определить три варианта генотипа: гомозигота по основному аллелю, гетерозигота, гомозигота по минорному аллелю. Для детекции продуктов амплификации в режиме реального времени использовали прибор DTlite (ДНК-Технология, Россия).
Анализ полученных данных с учетом небольшого размера выборки осуществлялся с применением методов непараметрической статистики: теста Манна–Уитни для оценки различий исследуемых показателей между двумя независимыми выборками, критерия Вилкоксона для сравнения связанных (зависимых) выборок, χ2-критерия, рассчитывали проценты от общего, точный критерий Фишера использовался для сравнения двух относительных показателей, характеризующих частоту признака. Для оценки динамики клинико-лабораторных показателей: ИМТ, уровня ГКН и ГКП введен показатель ∆%, который вычисляли по формуле ∆%=(X2-X1)/X1*100%, где X1 – исходное значение показателя, X2 – конечное значение показателя. Данный параметр позволяет оценивать динамику показателей независимо от исходного уровня и диапазона колебаний показателя для каждого конкретного пациента. В тексте статьи показатели представлены в виде медианы, нижних и верхних процентилей (Me [25 р; 75 р]). Уровнем статистической значимости различий было принято р<0,05. Статистический анализ проводили с использованием прикладного пакета программ Statistica 10.0 (StatSoft, США).
Результаты
В исследовании приняли участие 77 пациентов (39% мужчин, 61% женщин) с впервые установленным СД2, не получавших ранее какой-либо сахаро-снижающей терапии. Медиана возраста участников исследования составила 55 [50; 61] лет. По результатам первичного обследования все больные имели избыточную массу тела или ожирение – медиана ИМТ составила 32,7 (31,3; 35,2) кг/м2. При оценке исходных лабораторных показателей углеводного метаболизма в исследуемой когорте медиана уровня ГКН составила 9,5 (8,7; 10,3), медиана уровня ГКП – 11,8 (10,6; 13,0) ммоль/л и медиана уровня HbA1c – 9,31 (8,21; 10,23)%. После проведенного обследования в качестве стартовой антидиабетической терапии всем больным был назначен метформин в стандартной начальной дозе 1500 мг/сут.
Наблюдение за пациентами проводилось в течение полугода с оценкой параметров углеводного статуса в контрольных точках 3 и 6 месяцев. На протяжении всего периода исследования в отсутствие стойкой нормогликемии осуществлялась титрация дозы метформина или назначалась комбинация ССП. Так, повышение суточной дозы более 2000 мг потребовалось в общей сложности 21 (27,3%) пациенту, а 20 (25,9%) больным в связи с сохраняющейся гипергликемией на максимальной переносимой дозе препарата к метформину были добавлены ССП из других групп. Через 6 месяцев терапии метформином у всех пациентов установлено достоверное статистически значимое (р<0,01) снижение показателей ИМТ, ГКН, ГКП и HbA1c по сравнению с исходными показателями. По итогам 6-месячного лечения в исследуемой выборке медиана ИМТ составила 31,2 (29,5; 33,9) кг/м2; медиана уровня ГКН – 5,9 (5,7; 6,3) ммоль/л, ГКП – 7,3 (6,8; 7,6) ммоль/л, медиана HbA1c – 6,70 (6,30; 6,89)%.
В целом проводимая фармакотерапия характеризовалась хорошей переносимостью. Основными побочными эффектами, зарегистрированными у пациентов с впервые выявленным СД2 при применении метформина, были побочные эффекты со стороны ЖКТ: у 10 (13%) пациентов наблюдалась диарея, у 9 (11,7%) отмечалась тошнота, у 6 (7,8%) – боли в животе, 8 (10,4%) пациентов предъявляли жалобы на снижение аппетита. Однако ни у одного из участников исследования данные побочные эффекты не послужили поводом для отмены лекарственного препарата.
По результатам генотипирования 77 пациентов с впервые выявленным СД2 по полиморфному маркеру rs5219 гена KCNJ11 (C>T) установлено: носителями генотипа CC являлись 30 (38,9%) больных, генотипа CT – 37 (48,1%) и генотипа TT – 10 (13%) пациентов. Частота минорного аллеля Т полиморфизма rs5219 составила 39%. Частоты генотипов по полиморфному варианту гена TCF7L2 rs7903146 (C>T) в исследуемой выборке распределились следующим образом: СС-генотип имели 44 (57,1%) пациента, СТ-генотип – 28 (36,4%) и ТТ-генотип – 5 (6,5%) больных. Частота минорного аллеля T полиморфизма rs7903146 составила 26%. Распределение частот аллелей и генотипов полиморфных вариантов генов KCNJ11 и TCF7L2 не отличалось от равновесия Харди–Вайнберга при значении р>0,05.
В зависимости от генотипа по каждому из изучаемых полиморфных маркеров было сформировано две группы пациентов: одну составили пациенты с диким типом гена, другую – носители полиморфного аллеля в гетеро- или гомозиготном состоянии. Таким образом, для полиморфного варианта KCNJ11 rs5219 в первую группу вошли 30 пациентов с генотипом СС, вторую группу составили 47 носителей полиморфного аллеля Т (генотипы СТ и ТТ). Для полиморфного варианта TCF7L2 rs7903146 первая группа включила 44 пациента с диким типом гена (СС генотип), вторую составили 33 носителя полиморфизма rs7903146 в гетеро- или гомозиготном состоянии (генотипы СТ и ТТ). Сформированные группы пациентов были сопоставимыми по полу, возрасту, ИМТ, исходным уровням ГКН, ГКП и HbA1c (р>0,05).
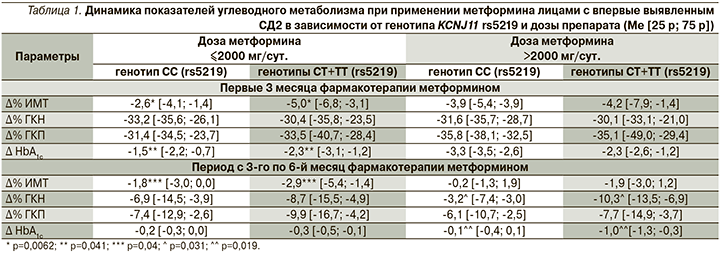
Анализ результатов 6-месячной терапии метформином показал, что число пациентов с целевым уровнем (ЦУ) HbA1c оказалось сопоставимым в группах пациентов с различными аллельными вариантами гена KCNJ11. Вместе с тем обращал на себя внимание тот факт, что доля носителей полиморфного варианта rs5219 гена KCNJ11, имевших ЦУ HbA1с, оказалась больше относительно пациентов с диким генотипом изучаемого гена. Несмотря на то что различия между группами не достигли уровня статистической значимости, данная отчетливая тенденция сохранялась и при оценке результатов монотерапии метформином с учетом применяемой дозы препарата. Так, на фоне лечения метформином в дозе менее 2000 мг/сут индивидуальных целей гликемического контроля достигли 90,9% пациентов в группе носителей полиморфного маркера rs5219 и 85,7% пациентов с генотипом СС (р=0,63). При применении препарата в дозе более 2000 мг/сут ЦУ HbA1c достигли 71,4% носителей минорного аллеля Т и 42,9% с диким типом гена KCNJ11 (р=0,35).
С учетом возможной ассоциации восприимчивости к терапии метформином с носительством полиморфного варианта rs5219 гена KCNJ11 был проведен углубленный анализ динамики показателей ИМТ, ГКН, ГКП и HbA1c в выделенных группах больных. При оценке степени снижения изучаемых показателей в % от исходных значений (∆%) установлены статистически достоверные различия между группами пациентов с диким и полиморфными генотипами KCNJ11, получавших сопоставимые дозы метформина (табл. 1).
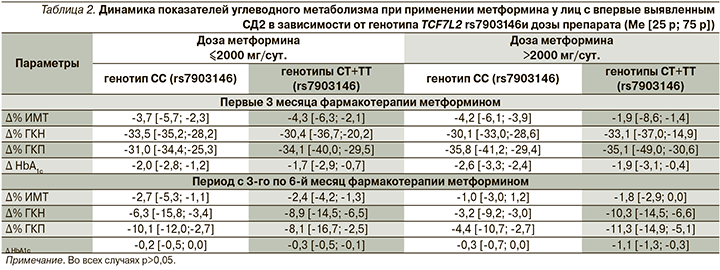
Носительство полиморфизма rs7903146 в гене TCF7L2 статистически значимо не сказалось на числе пациентов, достигших индивидуальных целевых показателей углеводного обмена через 6 месяцев монотерапии метформином. При применении метформина в дозе менее 2000 мг/сут доли носителей полиморфного варианта rs7903146 гена TCF7L2 и пациентов с диким генотипом TCF7L2, имевших ЦУ HbA1с по результатам исследования, составили 88,2 и 89,5% соответственно (р=0,99). На фоне лечения метформином в дозе более 2000 мг/сут ЦУ гликемического контроля достигли 60% носителей полиморфного маркера rs7903146 и 63,6% с генотипом СС (р=0,99).
Отсутствие ассоциации индивидуального ответа на метформин с полиморфным вариантом rs7903146 гена TCF7L2 было подтверждено при детальной оценке динамики основных изучаемых клинико-лабораторных показателей – достоверных различий между группами пациентов с диким и полиморфными генотипами TCF7L2, получавших сопоставимые дозы метформина, выявлено не было (табл. 2).
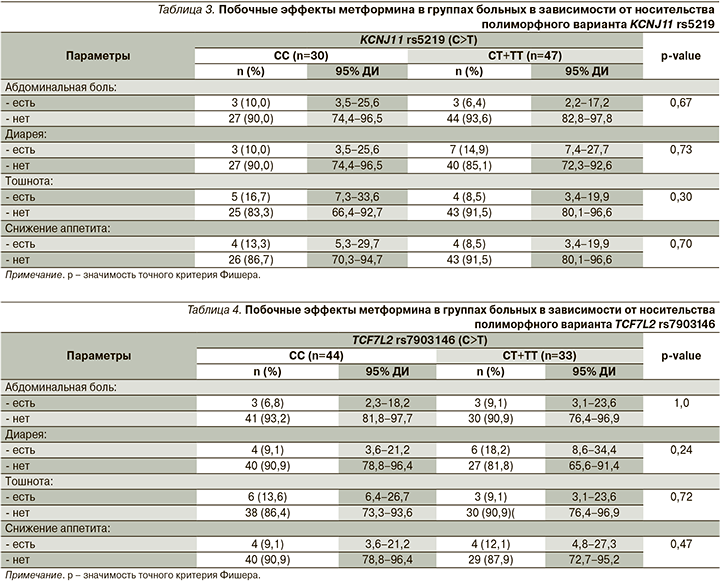
В ходе анализа результатов исследования проводилась оценка взаимосвязи побочных эффектов метформина с полиморфными вариантами KCNJ11 rs5219 и TCF7L2 rs7903146. При сопоставлении групп пациентов с диким генотипом СС и носителей минорного аллеля Т полиморфного маркера rs5219 гена KCNJ11 по частоте и характеру побочных эффектов со стороны ЖКТ, возникших на фоне приема метформина, достоверных клинических и статистически значимых различий выявлено не было (р>0,05). Установлено, что встречаемость побочных эффектов при приеме метформина не зависела также и от носительства полиморфизма rs7903146 гена TCF7L2 (р>0,05) (табл. 3, 4).
Обсуждение результатов
Полученные в результате исследования данные свидетельствуют: на фоне приема метформина удалось достичь выраженного статистически значимого улучшения клинико-лабораторных показателей у всех включенных в исследование пациентов с впервые выявленным СД2 вне зависимости от генотипов KCNJ11 (rs5219) и TCF7L2 (rs7903146). Суммируя результаты проведенного исследования, можно с уверенностью заключить, что носители полиморфизма rs5219 имеют более высокую восприимчивость к терапии метформином, чем пациенты с диким типом гена KCNJ11. По итогам углубленного анализа динамики показателей ИМТ, ГКН, ГКП и HbA1c в группах носителей дикого гомозиготного генотипа СС и полиморфных генотипов СТ+ТТ гена KCNJ11 оказалось, что на фоне монотерапии метформином в сопоставимых дозах пациенты с полиморфным вариантом KCNJ11 rs5219 имели статистически значимо более существенную динамику снижения массы тела (∆ ИМТ), а также статистически значимо более выраженную динамику снижения уровней HbA1c (∆ HbA1c) и ГКН (∆ ГКН) по сравнению с носителями дикого генотипа СС. Причины выявленных в нашем исследовании различий до конца не ясны.
В доступной мировой научной литературе на сегодняшний день отсутствуют публикации по изучению роли полиморфизмов гена KCNJ11 в формировании индивидуального ответа больных СД2 на терапию метформином. Тем не менее имеющиеся сведения о структурно-функциональных особенностях АТФ-зависимых калиевых каналов с измененной аминокислотной последовательностью, позволяют предположить, что они более чувствительны в плане восстановления своей функциональной активности к устранению глюкозо- и липотоксичности при применении метформина по сравнению с К+АТФ-каналами дикого типа [20].
В результате сравнительного анализа показателей в группах пациентов с диким и полиморфными генотипами TCF7L2 было установлено, что наличие полиморфизма rs7903146 не оказывает значимого влияния на выраженность фармакологического ответа на метформин. Полученные нами данные согласуются с результатами исследования GoDARTs, согласно которым полиморфизм rs7903146 гена TCF7L2 вносит свой вклад в формирование индивидуального ответа на терапию препаратами сульфонилмочевины, но не метформином [16]. С другой стороны, в работе T. Dujic et al. (2019) было показано, что изучаемый ОНП ассоциируется с более низким уровнем ГКН и более низким показателем HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) на фоне лечения метформином в течение 12 месяцев у гомозигот по аллелю риска Т [19]. Однако прямое сопоставление полученных нами данных с результатами этого исследования вызывает определенные затруднения ввиду того, что T. Dujic et al. изучали ответ на терапию метформином отдельно в группе гомозигот по дикому аллелю С, в группе гетерозигот СТ и в группе гомозигот по полиморфному аллелю Т. Тогда как в нашем исследовании влияние полиморфизма rs7903146 на индивидуальный ответ при применении метформина оценивали в объединенной группе носителей минорного аллеля Т в гетеро- и гомозиготном состояниях. Также необходимо принять во внимание, что в вышеупомянутой работе наблюдение за пациентами осуществлялось на протяжении более длительного времени, что, возможно, позволило выявить достоверные ассоциации носительства полиморфного варианта TCF7L2 с эффективностью применения метформина. Представляется, что разрешить подобные противоречия помогут более масштабные фармакогенетические исследования.
Известно, что риск развития побочных эффектов при применении лекарственных препаратов также может быть обусловлен индивидуальными генетическими особенностями пациента [21]. В связи с этим представляется важным, что в нашем исследовании не было выявлено достоверной ассоциации полиморфных вариантов rs5219 гена KCNJ11 и rs7903146 гена TCF7L2 с повышенным риском развития побочных эффектов на фоне приема метформина. Следовательно, препарат может успешно применяться как пациентами с диким типом генов, так и носителями изучаемых генетических полиморфизмов.
Заключение
Использование в клинической практике результатов исследований в области фармакогенетики метформина представляется весьма важным с точки зрения повышения эффективности и безопасности применения этого препарата больными СД2. У пациентов с впервые выявленным СД2 носительство полиморфизма rs5219 гена KCNJ11 ассоциировано с высокой чувствительностью к терапии метформином. Таким образом, наличие ОНП rs5219 гена KCNJ11 может служить дополнительным предиктором предпочтительного назначения метформина в качестве стартовой антидиабетической монотерапии. Вместе с тем наличие полиморфизма rs7903146 гена TCF7L2 значимо не влияет на индивидуальных ответ больных с впервые диагностированным СД2 при применении метформина.
В связи с этим рутинное определение данного полиморфного варианта TCF7L2, по всей видимости, не имеет самостоятельного клинического значения при инициации терапии метформином, поскольку препарат одинаково эффективно нормализует гликемию как у пациентов с диким генотипом СС, так и у носителей минорного аллеля Т. Важно отметить, что в ходе исследования не установлено ассоциации полиморфных вариантов rs5219 гена KCNJ11 и rs7903146 гена TCF7L2 с возникновением гастроинтестинальных побочных эффектов при применении метформина в изучаемой когорте пациентов.
Проведение дальнейших исследований, уточняющих роль полиморфизмов генов KCNJ11 и TCF7L2 в индивидуальном ответе на терапию метформином, а также изучение других генетических детерминант действия метформина в перспективе могут способствовать разработке персонифицированных схем антидиабетической фармакотерапии.
Финансирование. Исследование не имело спонсорской поддержки.



