Введение
Почечная анемия является важной проблемой терапии, нефрологии и здравоохранения в целом. Она сопровождается повышением риска осложнений, смертности и частоты госпитализаций, ухудшением физического состояния больного и снижением качества его жизни [1]. Анемия оказывает негативное влияние практически на все основные системы организма, однако наиболее серьезные изменения наблюдаются со стороны сердечно-сосудистой системы. Анемия существенно повышает риск развития инсульта и застойной сердечной недостаточности. Сочетание анемии с хронической болезнью почек (ХБП) и/или застойной сердечной недостаточностью (кардио-ренально-анемический синдром) сопровождается увеличением риска смерти в 1,2–2,2 раза [2].
Анемия, связанная с ХБП и терминальной стадией хронической почечной недостаточности (тХПН), в значительной степени обусловлена снижением выработки эритропоэтина в почках и изменениями объема внеклеточной жидкости [3]. Показано, что анемия является следствием дефицита железа, фолатов и витамина В12, желудочно-кишечных кровотечений, осложнений гиперпаратиреоза, системного воспаления и укорочения времени жизни эритроцитов [4]. В случае снижения синтеза эритропоэтина в почках при тХПН анемия компенсируется с помощью эритропоэзстимулирующих препаратов (ЭСП). Однако в 5–10 % случаев анемия, сопутствующая тХПН, не обусловлена низкой концентрацией эритропоэтина в крови и применение ЭСП не дает никакого эффекта [5].
В настоящее время существует две схожие позиции в отношении терапии анемии при тХПН: американская, изложенная в KDOQI (Kidney Disease Outcomes Quality Initiative), и европейская, рекомендуемая ERBP (European Renal Best Practice). Целевыми значениями гемоглобина считаются 11–12 г/дл, но не выше 13 г/дл. Для достижения целевых значений используют внутривенное или подкожное введение ЭСП “короткого” и пролонгированного действия [6]. В связи с созданием ЭСП появилась возможность безопасной и эффективной регуляции эритропоэза [7]. Как известно, регуляция эритропоэза осуществляется главным образом в почках (85–95 %) и печени посредством гликопротеинового гормона эритропоэтина при участии митохондриальной РНК. Главным фактором, регулирующим продукцию эритропоэтина, является гипоксия. В условиях гипоксии количество циркулирующего в плазме эритропоэтина возрастает примерно в 1000 раз и достигает 5–30 МЕ/мл. В ответ на снижение оксигенации тканей фактор индукции гипоксии (HIF-1a) активирует выработку эритропоэтина. Гипоксия приводит к снижению уровня кислорода в специфических сенсорных клетках почек, что вызывает усиление продукции простагландинов в клубочковых клетках [8]. Другими факторами регуляции являются гемодилюция, кровотечения, уменьшение времени жизни эритроцитов, снижение и/или нарушение их продукции, расстройства метаболизма железа, нутритивная недостаточность, нарушение продукции эритропоэтина [9].
Целью настоящего исследования явилось сравнение динамики концентраций различных ЭСП “короткого” действия, применявшихся для коррекции анемии у больных тХПН.
Материал и методы
Обследованы 50 пациентов (29 мужчин, 21 женщина) в возрасте от 27 до 65 лет. На момент проведения исследования (2010) больные получали лечение гемодиализом в Краевом нефрологическом центре Краснодара продолжительностью от 6 месяцев до 5 лет. Их “сухой” вес составлял от 70 до 90 кг, среднее артериальное давление – 110/80 мм рт. ст., концентрация гемоглобина – 80–120 г/л, альбумина – 36–42 г/л, иммунореактивного паратиреоидного гормона – не выше 90 пмоль/л. В исследование не включались пациенты, страдавшие онкологическими заболеваниями и сахарным диабетом.
Больные были разделены на 3 группы: группа А (9 мужчин, 5 женщин) получала эпоэтин альфа (Эпрекс; Janssen Cilag, Швейцария) в дозе 40 МЕ/кг, группа Б (11 мужчин, 6 женщин) – эпоэтин альфа (Эральфон; Сотекс, Россия) в дозе 40 МЕ/кг, группа В (9 мужчин, 10 женщин) – эпоэтин бета (Рекормон; Ф. Хоффман-Ля Рош Лтд, Швейцария) в дозе 40 МЕ/кг. ЭСП вводились в начале процедуры гемодиализа внутривенно. Для коррекции активных запасов железа на фоне применения ЭСП использовался декстран железа (Космофер) в дозе 100 мг внутривенно перед началом процедуры. У больных регистрировали пульс, артериальное давление, массу тела, объем ультрафильтрации. Для определения концентрации эритропоэтина в сыворотке крови с помощью иммунохимического анализатора ACCESS 2; Beckman Coulter (США), забор крови осуществлялся на 15-й минуте перед началом гемодиафильтрации и введения ЭСП, через 1, 5, 12, 24, 36 и 43 часа.
В ходе исследования использовался глюкозосодержащий концентрат (глюкоза – 5,5 ммоль/л, калий – 2 ммоль/л), бикарбонат в диализирующий раствор поступал через бикарбонатный картридж. Объемную скорость кровотока устанавливали на уровне 300–350 мл/мин, поток диализирующей жидкости – 500 мл/мин. Для проведения процедур использовалась очищенная вода, приготовленная на установках CWR-100 type WRO-104; Gambro (Швеция). Пациенты получали процедуры на диализаторах FX 80, Fresenius (Германия); BK-F1, 6, Toray (Япония); HiFlo 18 и Xevonta Hi18, Braun B. (Германия).
Статистическая обработка полученных данных производилась с использованием программного обеспечения Statsoft Statistica Version 6.0 и Microsoft Exсel. Вычислялись медианы (Ме) и процентили (Р25, Р75). Достоверность различий полученных результатов оценивалась с использованием непараметрических методов статистики. Для определения внутригрупповых изменений применен критерий Уилкоксона, а для сравнения между исследуемыми группами – критерий Крускала–Уоллиса [10].
Результаты и их обсуждение
Нами была исследована концентрация эритропоэтина в динамике у больных тХПН, получавших различные ЭСП “короткого” действия. Полученные данные представлены на рисунке.
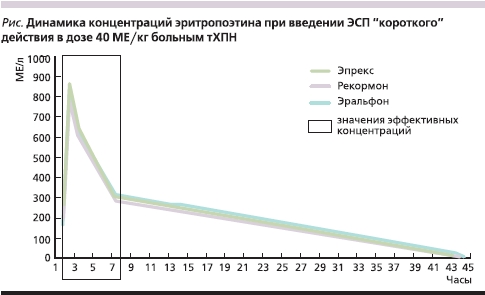
Исходные медианные значения эндогенного эритропоэтина колебались у больных на уровне от 6,4 до 9,2 мМЕ/л. Прямоугольником на рисунке выделен растянутый по оси ординат период времени, соответствующий 5 часам после внутривенного введения ЭСП, что сделано для удобства дальнейших расчетов и более наглядной демонстрации. Концентрация эритропоэтина к 1-й минуте достигала высоких медианных значений, при применении препаратов Эпрекс, Эральфон и Рекормон составивших 865,2, 779,6 и 843,1 мМЕ/л соответственно. К моменту завершения процедуры (к 5-му часу) концентрация эритропоэтина в группах снижались, составив при применении указанных препаратов 304,7, 317,3 и 286,2 мМЕ/л. В дальнейшем концентрация снижалась, приближаясь к исходным значениям, становясь неэффективной к 30–40-му часу после введения ЭСП. Очевидно, что быстрое снижение концентрации эритропоэтина в первые 5 часов после введения ЭСП связано с тремя процессами: распределением по водным секторам, захватом молекул ЭСП рецепторами в условиях “дефицитной” при уремии концентрации эритропоэтина и естественным распадом ЭСП. Дальнейшее же снижение концентрации обусловлено только процессами распада молекул и захватом их рецепторами в условиях отсутствия дефицита.
В ходе исследования нам удалось продемонстрировать сходную биодоступность различных ЭСП “короткого” действия –Эпрекса, Эральфона и Рекормона, применявшихся в сочетании с препаратами железа для коррекции анемии у больных ХПН. Это позволяет говорить об их идентичной эффективности при внутривенном введении больным тХПН.
Выводы
Применение различных ЭСП “короткого” действия в сочетании с препаратами железа является эффективным и безопасным средством коррекции анемии у больных ХПН. ЭСП-терапия является альтернативой гемотрансфузиям, которые могут давать быстрый, но нестойкий эффект.
Результаты проведенного исследования свидетельствуют о сходной фармакокинетике различных ЭСП “короткого действия” – Эпрекса, Эральфона и Рекормона, применявшихся для коррекции анемии у больных тХПН.



