Введение
Проблема нозокомиальных инфекций (НИ) и инфекционного контроля в лечебно-профилактических учреждениях в целом и в отделениях реанимации и интенсивной терапии (ОРИТ) в частности приоритетна в здравоохранении Российской Федерации (РФ). Это обусловлено высокими показателями смертности, вызванными НИ, которые в стационарах выходят на первое место, значительным увеличением стоимости и продолжительности лечения, большим экономическим ущербом, который наносят НИ больному и его семье [1].
Нозокомиальная пневмония (НП) является одной из наиболее часто встречающихся НИ. Это осложнение развивается у 0,5–0,8% госпитализированных больных, а в ОРИТ – в 10–15 раз чаще, оставаясь самой частой инфекционной патологией. Показатели летальности при НП составляют 10–25% вне ОРИТ и 25–70% в ОРИТ [2, 3].
По данным Роспотребнадзора, в России ежегодно переносят НП до 8% пациентов, или 2 млн человек [1]. Эксперты отмечают увеличение удельного веса НП в общей структуре НИ за 8 лет в 4,3 раза (с 3,6% в 2006 г. до 18,5% в 2014 г.) [4]. Так, по данным российского многоцентрового исследования ЭРГИНИ (Экспертная Рабочая Группа по Изучению Нозокомиальных Инфекций), проведенного в 2013 г. в 32 стационарах 18 городов РФ, распространенность НИ в лечебно-профилактических учреждениях составила в среднем 7,61% (95% доверительный интервал [ДИ] – 6,81–8,50%). При этом наиболее частой локализацией (39,6%) были нижние дыхательные пути. В ОРИТ распространенность НИ была наибольшей и составила 27,6%, причем половина случаев обусловлена патологией нижних дыхательных путей [5].
Клинические и экономические последствия НП особенно значимы для больных, находящихся на искусственной вентиляции легких (ИВЛ). Развитие НП-ИВЛ значимо ухудшает исходы лечения. В многочисленных исследованиях показано достоверное увеличение летальности при НП-ИВЛ, которая достигает 70% [2, 6, 7].
Возбудители НП и НП-ИВЛ могут быть эндогенного происхождения (главным образом кишечная микрофлора человека), а также экзогенного в результате переноса от других пациентов, с рук медперсонала, из окружающей среды. Нозокомиальные штаммы микроорганизмов в ОРИТ традиционно характеризуются множественной устойчивостью к антибактериальным препаратам (АБП), что затрудняет выбор адекватного режима терапии. Проблему усугубляет широко распространенная практика профилактического назначения антибиотиков пациентам в ОРИТ, находящимся на ИВЛ, что способствует селекции антибиотикорезистентных штаммов микроорганизмов к большинству антибиотиков.
К началу 2000-х гг. стала остро ощущаться потребность в новых карбапенемах в связи с увеличением количества резистентных грамотрицательных [Гр(-)] микроорганизмов – возбудителей НП [8].
Дорипенем – новый парентеральный 1-β-метил-карбапенем. Он появился на фармацевтическом рынке России в 2008 г. Препарат обладает высокой in vitro и in vivo активностью в отношении широкого спектра грамположительных [Гр(+)] и Гр(-) микроорганизмов – возбудителей НП [9].
Антимикробная активность дорипенема in vitro в отношении основных возбудителей НП
Глобальные исследования активности дорипенема in vitro (2003–2007), проведенные на более чем 130 тыс. штаммах микроорганизмов, включая 80 485 Гр(+)-изолятов, продемонстрировали высокую активность препарата в отношении метициллинчувствительных золотистых стафилококков и пневмококков [10]. Минимальные ингибирующие концентрации (МИК) дорипенема для Гр(+)-кокков были в два–четыре раза ниже таковых меропенема. При этом активность дорипенема (так же как и других карбапенемов) не распространяется на метициллинрезистентные стафилококки.
Антибиотикорезистентность нозокомиальных штаммов Enterobacte-riaceae представляет актуальную проблему для лечебных учреждений нашей страны. Результаты многоцентрового эпидемиологического исследования МАРАФОН в 2011–2012 гг. свидетельствуют о крайне высокой (>80%) частоте резистентности к современным цефалоспоринам у всех видов энтеробактерий, прежде всего у K. pneumoniae (>90%), обусловленной в основном распространением β-лактамаз расширенного спектра (БЛРС) [11]. Аналогичные результаты получены в российском многоцентровом исследовании ЭРГИНИ. Частота встречаемости нечувствительных штаммов Klebsiella spp., по данным этой работы, приближается к 100%, а Escherichia coli и других Enterobacteriaceae стабильно превышает 50%. Также высокий уровень устойчивости энтеробактерий отмечен к ципрофлоксацину и ампициллин/сульбактаму. Неприятной тенденцией, по мнению исследователей, служит снижение чувствительности E. coli и Klebsiella spp. к цефоперазон/сульбактаму, который в течение последних лет рассматривался как надежная альтернатива карбапенемам при эмпирической терапии НП [5].
Дорипенем обладает высокой активностью в отношении Гр(-) микроорганизмов, включая E. coli, Klebsiella spp. и другие энтеробактерии. На материале 36 614 штаммов энтеробактерий, выделенных в 60 медицинских центрах в 2000–2007 гг., чувствительность к дорипенему in vitro составила 98,7%, а среди БЛРС-продуцирующих Klebsiella pneumoniae, E. сoli и Proteus mirabilis – 94,3% [12].
Проблемным возбудителем НП в РФ с точки зрения выбора антибактериальной терапии является Pseudomonas aeruginosa. Результаты многоцентрового эпидемиологического исследования МАРАФОН выявили факт крайне высокой распространенности устойчивости P. aeruginosa к некоторым карбапенемам, которые традиционно рассматривались как препараты выбора для лечения синегнойной инфекции: имипенему (79% резистентых и 9% умеренно-резистентных изолятов) и меропенему (48% резистентых и 18% умеренно-резистентных изолятов). При этом следует отметить, что частота устойчивости к карбапенемам равна или превышает соответствующие показатели для антисинегнойных цефалоспоринов (59–61%) и пиперациллина/тазобактама (67%) [13].
Высокая активность дорипенема в отношении P. aeruginosa подтверждена в многочисленных исследованиях. Так, согласно результатам работы M. Castanheira и соавт., дорипенем в отношении синегнойной палочки был в два раза активнее имипенема: в 77,2% случаев показано воздействие на P. аeruginosa при значениях МИК≤2 мкг/мл [14].
В Бразилии было проведено исследование эффективности карбапенемов in vitro. Его результаты показали высокую частоту резистентности P. аeruginosa к имипенему (53,1%) и меропенему (44,5%). Дорипенем демонстрировал МИК50, равные 16 мкг/мл, в отношении имипенемрезистентных P. аeruginosa и ингибировал большее, чем меропенем (0,0%), число имипенемрезистентных P. аeruginosa (10,5%) при МИК≤4 мкг/мл, т.е. сохранял активность в отношении имипенемрезистентных штаммов P. аeruginosa [15].
В работе S. Mushtaq и соавт. отмечено, что чувствительность имипенем- и меропенемрезистентных штаммов P. aeruginosa (МИК≥8 мкг/мл) к дорипенему при МИК дорипенема ≤4 мкг/мл сохранялась у 32,4 и 48,7% штаммов соответственно [16].
В Японии T. Fujimura и соавт. провели исследование in vitro, в котором продемонстрировали способность дорипенема предотвращать появление резистентных мутантов P. аeruginosa на материале 694 штаммов, выделенных из дыхательных (48,6%) и мочевых (22,5%) путей. Работа проводилась в 23 медицинских учреждениях с 1992 по 2004 г. Частота выделения резистентных штаммов P. аeruginosa в среднем составляла для дорипенема 7,1%, меропенема – 11,7%, имипенема – 19,9%, цефтазидима – 16,7%, цефепима–12,8%, пиперациллина/тазобактама – 13,4%, тобрамицина – 13,8%, амикацина – 5,8% и ципрофлоксацина – 21,2%. При этом частота выделения имипенемрезистентных штаммов P. аeruginosa варьировалась от 8,8 (1992) до 34,4% (2002), меропенемрезистентных штаммов – от 6,9 до 15,6% соответственно. Резистентность P. aeruginosa к дорипенему в течение 12 лет не превышала 10% [17].
Теми же авторами был проведен анализ активности дорипенема в отношении цефтазидимрезистентных (МИК≥32 мкг/мл, n=116) и имипенемрезистентных (МИК≥16 мкг/мл, n=138) штаммов P. aeruginosa. От 44,0 до 50,8% цефтазидимрезистентных штаммов были чувствительны к трем карбапенемам. При этом чувствительность к дорипенему была наибольшей (50,8%). В то же время 44,2–51,4% имипенемрезистентных штаммов были чувствительны к дорипенему, цефтазидиму и цефепиму. К меропенему были чувствительны лишь 25,4% имипенемрезистентных штаммов, что оказалось наихудшим показателем среди протестированных препаратов [17].
Различия в резистентности синегнойной палочки к трем карбапенемам могут быть объяснены пониженной чувствительностью штаммов P. aeruginosa к имипенему и меропенему. К дорипенему штаммы P. aeruginosa могут быть резистентны только при наличии двух факторов: потери порина OprD и нарушении работы эффлюксных помп. Это уменьшает вероятность возникновения резистентности при терапии дорипенемом [16, 18].
Кроме того, есть данные, согласно которым карбапенемы в разной степени способны предотвращать рост карбапенемрезистентных мутантов P. aeruginosa. Так, при добавлении в агар дорипенема в концентрации 1/2 или 1/4 МИК рост мутантных колоний P. aeruginosa был в 10–100 раз ниже, чем при добавлении имипенема и меропенема [18].
За последние десять лет Acinetobacter baumannii стал одним из ведущих возбудителей НП [5, 19]. Результаты исследования оценки чувствительности к АБП 252 изолятов Acinetobacter spp., выделенных в рамках многоцентрового эпидемиологического исследования антибиотикорезистентности возбудителей НИ (МАРАФОН) в 25 стационарах 18 городов России в 2011–2012 гг., свидетельствуют об увеличении роли Acinetobacter spp. в этиологии НИ в РФ и одновременно – о резком нарастании устойчивости изолятов A. baumannii к большинству АБП. Рост устойчивости к препаратам данной группы обусловлен прежде всего быстрым распространением в различных регионах РФ карбапенемазопродуцирующих штаммов A. baumannii, доля которых возросла более чем в 15 раз. Согласно результатам исследования, нечувствительность к карбапенемам (меропенему и имипенему) проявляли соответственно 67,5 и 96,0% изолятов, что на 28,9 и 90,9% выше аналогичных показателей в 2006–2007 гг.
Большинство изолятов были также не чувствительны к фторхинолонам – ципрофлоксацину и левофлоксацину (92,1%), к аминогликозидам – гентамицину (85,3%), амикацину (86,9%) и тобрамицину (64,7%), а также к триметоприму/сульфаметоксазолу (79,4%) [19].
Как и другие карбапенемы, дорипенем обладает лишь умеренной активностью в отношении этого микроорганизма. Так, в исследовании M. Castanheira и соавт. имипенем проявлял более высокую активность по сравнению с меропенемом и дорипенемом (в 64,1% для A. baumannii МИК50 имипенема составлял 1 мкг/мл).
МИК50 для дорипенема и меропенема были эквивалентными и составляли 2 мкг/мл [14]. В то же время в исследовании in vitro, проведенном S.X. Dong и соавт., активность этих трех карбапенемов была одинаковой: чувствительны к дорипенему, имипенему и меропенему были 56, 60 и 60% штаммов соответственно при МИК50 меньше 0,5 мкг/мл [20].
Причиной резистентности к карбапенемам, как правило, является продукция металло-β-лактамаз группы VIM, карбапенемаз групп KPC и OXA [19]. Однако дорипенем может обладать активностью в отношении некоторых полирезистентных штаммов Acinetobacter из-за его относительной стабильности под действием некоторых карбапенемаз.
В частности, в исследовании A.M. Somily и соавт. у полирезистентных штаммов A. baumannii резистентность к дорипенему была наименьшей по сравнению с имипенемом и меропенемом – 77,4 против 90,5 и 90,5% соответственно [21]. А в исследовании S. Marti и соавт. показано, что 19 полирезистентных A. baumannii изолятов, имеющих ген blaOXA-24, были резистентны к этим трем карбапенемам (МИК≥8 мкг/мл), среди 12 изолятов A. baumannii, имеющих ген blaOXA-58 и резистентных к дорипенему, было 33%, а резистентных к имипенему и меропенему – 100% [22].
Клиническая эффективность дорипенема при НП
Эффективность и безопасность дорипенема при НП (включая НП-ИВЛ) были доказаны в крупных многомасштабных рандомизированных исследованиях [23, 24].
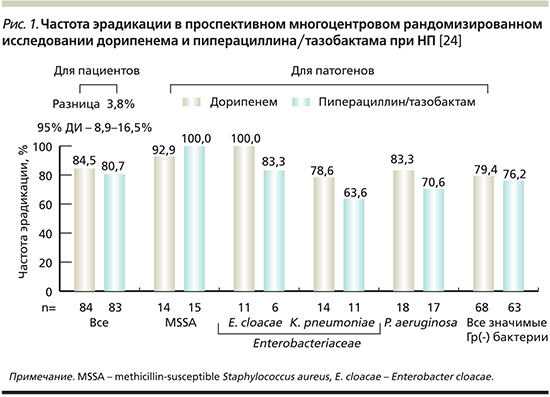
A. Rea-Neto и соавт. в открытом проспективном многоцентровом рандомизированном исследовании III фазы сопоставили эффективность применения дорипенема с пиперациллин/тазобактамом при лечении НП. В исследование были включены 448 взрослых пациентов с диагностированной НП или ранней НП-ИВЛ (развившейся не позднее 5 суток нахождения на ИВЛ). Стратификация пациентов проводилась на основании наличия/отсутствия ИВЛ и тяжести заболевания. Рандомизация предполагала введение дорипенема внутривенно в течение часа в дозе 500 мг каждые 8 часов либо пиперациллина/тазобактама внутривенно в течение 30 минут в дозе 4,5 г каждые 6 часов. В соответствии с протоколом исследования при выделении у больных метициллинрезистентного стафилококка к лечению добавлялся ванкомицин, а при выделении P. аeruginosa – амикацин. По истечении не менее 72 часов терапии парентеральным антибиотиком пациенты могли переводиться на терапию левофлоксацином внутрь в дозе 750 мг/сут. Продолжительность антибактериальной терапии составила от 7 до 14 дней. Критерием эффективности служило клиническое выздоровление, которое оценивалось через 7–14 дней после окончания терапии.
Результаты исследования не выявили статистически значимых различий показателей клинической эффективности в сравниваемых группах, которая составила 81,3% в группе больных, получавших дорипенем, и 79,8% – пиперациллин/тазобактам. Умерли по разным причинам 13,8 и 14,6% больных соответственно.
Частота микробиологического выздоровления в отношении Гр(-) возбудителей была выше в группе дорипенема, однако различия не были статистически значимыми (рис. 1). При этом резистентность возбудителей к дорипенему отмечалась реже, чем к пиперациллину/тазобактаму. Так, у P. aeruginosa она составила 7,7 и 27% соответственно, у K. рneumoniae – 0 и 44 % соответственно. Оба препарата характеризовались хорошей переносимостью.
Частота побочных эффектов составила 16,1% в группе дорипенема и 17,6% в группе пиперациллина/тазобактама.
Ограничениями этого исследования эксперты считают открытый дизайн, низкую частоту монотерапии (частое назначение комбинации препарата исследования с аминогликозидом) и исключение пациентов, находящихся в критическом состоянии, а также пациентов с тяжелыми нарушениями иммунитета [23].
Таким образом, результаты данного исследования доказали клиническую и микробиологическую эффективность дорипенема в лечении НП и ранней ПН-ИВЛ [23, 24].
В другом рандомизированном многоцентровом исследовании III фазы J. Chastre и соавт. провели сравнение эффективности и безопасности дорипенема и имипенема/циластатина в лечении НП-ИВЛ [25]. В исследование был включен 531 пациент, находившийся в ОРИТ с установленным диагнозом НП-ИВЛ. Пациенты были стратифицированы в соответствии с длительностью ИВЛ и тяжестью состояния по шкале APACHE II (Acute Physiology And Chronic Health Evaluation). В исследуемой группе пациенты получали дорипенем в дозе 500 мг каждые 8 часов в виде продленной 4-часовой инфузии. В группе сравнения больным назначали имипенем по 500–1000 мг каждые 8 часов в виде 30- или 60-минутной инфузии. Продолжительность лечения составила 7–14 дней. На протяжении исследования не разрешалось использование других АБП.
Показатель клинической эффективности к концу лечения составил 68,3% в группе больных, получавших дорипенем, и 64,2 % – имипенем/циластатин. Частота выздоровления была выше в группе дорипенема у пациентов, находившихся в более тяжелом состоянии, оцененном по шкале APACHE II, а также у более пожилых больных. Важно отметить, что у пациентов с НП, обусловленной P. aeruginosa, показатель клинического выздоровления составил 80% в группе дорипенема и 42,9% – в группе имипенема.
Показатель микробиологического выздоровления (эрадикация возбудителя) составил 65% для дорипенема и 35,7% для имипенема/циластатина (все различия статистически недостоверны). Как и в исследовании A. Rea-Neto и соавт. Резистентность P. aeruginosa к дорипенему отмечалась значительно реже, чем к препарату сравнения. Среди P. aeruginosa были исходно устойчивыми к дорипенему или приобрели резистентность во время лечения (МПК>8 мг) 5 из 28 (18%) штаммов возбудителей. Показатель устойчивости среди P. aeruginosa к имипенему/циластатину составил 64%. Резистентными к препарату были 16 из 25 штаммов (p=0,001). Не было отмечено статистически значимых различий в уровне смертности в обеих группах лечения [25].
Результаты исследования показали, что дорипенем не менее эффективен, чем имипенем, в лечении НП-ИВЛ, при этом резистентность P. аeruginosa статистически значимо ниже к дорипенему.
Таким образом, два крупных рандомизированных клинических исследования госпитальной пневмонии (включая НП-ИВЛ) продемонстрировали эффективность применения дорипенема, не уступающую препарату сравнения.
Позднее было проведено несколько исследований дорипенема, включивших в т.ч. больных НП. Так, в исследовании PROUD (Prospective study on the Usage patterns of Doripenem in the Asia-Pacific region – проспективном исследовании по особенностям применения дорипенема в Азиатско-Тихоокеанском регионе) 216 больных НП, включая НП-ИВЛ, а также осложненные антраабдоминальные инфекции и осложненные инфекции мочеполовых путей, получали дорипенем. У 39 (27,7%) больных исходно была диагностирована бактериемия. Основными возбудителями были A. baumannii (30,5%), E. сoli (21,3%), K. рneumoniae (21,3%), P. аeruginosa (20,6%). У некоторых больных было идентифицировано более одного возбудителя. В 86,6% случаев дорипенем использовался в монотерапии. В 62% случаев дорипенем являлся второй линией лечения. Средняя продолжительность лечения дорипенемом составила 7,9 дня. Клиническое излечение отмечено у 86,7 из 165 оцениваемых больных. Эффект был наилучшим при антраабдоминальных инфекциях (93,9%) и наихудшим – при НП-ИВЛ (79,6%). Смертность от разных причин составила 22,7% [26].
В связи с высокой актуальностью Pseudomonas aeruginosa – патогена, трудно поддающегося терапии пациентов с тяжелыми НИ, S.G. Jenkins и соавт. провели мета-анализ в подгруппе больных, участвовавших в 4 рандомизированных клинических исследованиях дорипенема III фазы. Целью данного анализа являлось уточнение клинической и микробиологической эффективности дорипенема при лечении разнообразных НИ (осложненных интраабдоминальных инфекций, НП, в т.ч. НП-ИВЛ), обусловленных P. aeruginosa [27].
Клиническая эффективность дорипенема при лечении НП, вызванных P. aeruginosa, составила 59,6% (31/52) по сравнению с 32,8% (19/58) у препаратов сравнения (p<0,05). Частота микробиологической эрадикации также была выше при использовании дорипенема, однако различия не достигли статистической значимости. Взвешенные различия в частоте достижения клинического эффекта среди всех больных были в пользу дорипенема и составили 16% (95% ДИ – 3,1–29). Таким образом, показатели частоты клинически успешного лечения осложненных интраабдоминальных инфекций и НП (в т.ч. НП-ИВЛ), обусловленных P. aeruginosa, свидетельствовали в пользу дорипенема.
Число пациентов, у которых в результате лечения развились один и более побочных эффектов или серьезные нежелательные явления, оказалось сопоставимым при терапии дорипенемом и препаратами сравнения.
Результаты данного мета-анализа с высоким уровнем доказательности (I A) свидетельствуют о преимуществах дорипенема при лечении инфекции, обусловленной P. aeruginosa.
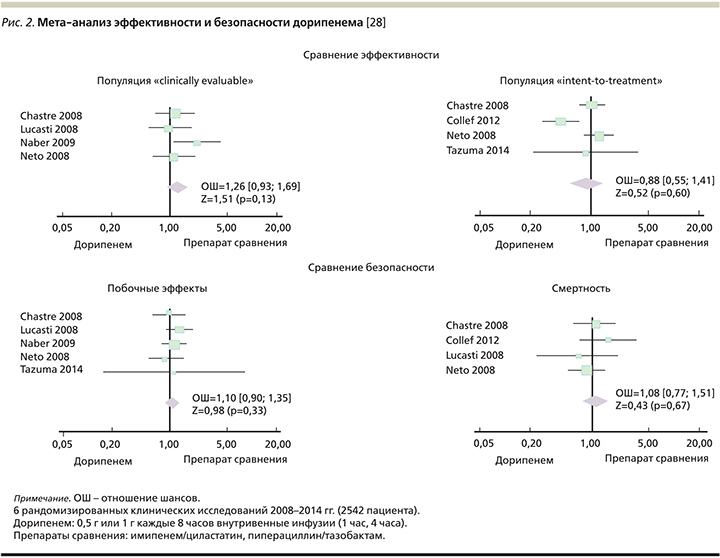
В 2015 г. опубликован мета-анализ, обобщивший результаты основных исследований применения дорипенема при НП, осложненных интраабдоминальных инфекциях и осложненных инфекциях мочевыделительной системы (рис. 2). Целью работы стало сравнение эффективности и безопасности дорипенема при лечении бактериальных инфекций. Анализу подверглись 2542 случая различных инфекционных заболеваний за 2008–2014 гг. [28]. При сравнении с различными АБП (имипенем/циластатин, меропенем, левофлоксацин, пиперациллин/тазобактам) исследователи оценивали клиническую эффективность дорипенема, частоту успешного микробиологического ответа, а также побочные эффекты и смертность от всех причин.
Проведенный мета-анализ выявил следующие закономерности. При сравнении с различными АБП, используемыми при эмпирической терапии НИ, применение дорипенема характеризовалось аналогичной частотой положительного клинического и микробиологического ответа: отношение шансов (ОШ) составило 1,26 (95% ДИ – 0,93–1,69; p=0,13).
Для анализа безопасности лечения было выполнено сравнение частоты побочных эффектов и смертности от всех причин. Дорипенем демонстрировал аналогичную препаратам сравнения частоту побочных эффектов и показатели смертности от всех причин (для частоты побочных эффектов ОШ=1,10, 95% ДИ – 0,90–1,35; p=0,33; для смертности от всех причин ОШ=1,08, 95% ДИ – 0,77–1,51; p=0,67). Дорипенем был не менее эффективен и не менее безопасен по сравнению с другими препаратами при лечении НП и НП-ИВЛ [28].
Заключением мета-анализа, имеющим уровень доказательности IA, является вывод о том, что дорипенем – это эффективный и хорошо переносимый препарат при сравнении с АБП при лечении НП, а также интраабдоминальных инфекций и осложненных инфекций мочевыводящих путей.
Фармакоэкономические преимущества дорипенема при лечении НП
На сегодняшний день выполнено несколько исследований по оценке фармакоэкономической эффективности дорипенема, в т.ч. и при НП.
В исследовании S. Merchant и соавт. [29] изучали затраты на лечение НП-ИВЛ при использовании дорипенема и имипенема/циластатина. Сравнивали длительность стационарного лечения, нахождения в ОРИТ и необходимость проведения ИВЛ. Медиана длительности стационарного лечения была меньше в группе дорипенема (22 дня), чем в группе имипенема/циластатина (27 дней; p=0,010). Медиана длительности ИВЛ было значительно ниже для дорипенема (7 против 10 дней; р=0,034). Медиана нахождения в ОРИТ не различалась между группами (12 против 13 дней). Уровни клинического выздоровления и смертности между группами не различались. Сходные данные получены в исследовании L.J. McGarry [30].
На основании совокупного анализа двух проспективных рандомизированных многоцентровых исследований дорипенема у пациентов с НП-ИВЛ T. Kongnakorn и соавт. разработали фармакоэкономическую модель из расчета на 10 тыс. пациентов. Оценивали ответ на терапию, смертность, длительность стационарного лечения и нахождения в ОРИТ, длительность ИВЛ, частоту развития устойчивости P. aeruginosa. В группе дорипенема затраты были меньше в среднем на 7000 долл. США на пациента по сравнению с имипенемом/циластатином. Эти различия на 95% были обусловлены сокращением длительности стационарного лечения. Кроме того, частота развития устойчивости P. aeruginosa к дорипенему отмечалась на 52% реже. Эти результаты показывают, что применение дорипенема имеет фармакоэкономические преимущества перед имипенемом/циластатином при лечении НП и НП-ИВЛ [31].
В российском фармакоэкономическом исследовании сравнивали дорипенем с имипенемом/циластатином и меропенемом в лечении НП-ИВЛ [32]. Фармакоэкономический анализ был проведен с использованием метода минимизации затрат. Было выявлено, что суммарные затраты на лечение в группе дорипенема были в 1,2–1,4 раза ниже, чем таковые на лечение в группе меропенема. Экономия составляет от 1,7 до 3,5 млн руб. на 100 пролеченных пациентов независимо от стоимости меропенема в регионах.
Заключение
В клинических исследованиях при НП, включая НП-ИВЛ, дорипенем продемонстрировал эффективность и безопасность. Препарат обладает высокой активностью в отношении Гр(+) и большинства Гр(-) возбудителей НП, низким потенциалом селекции резистентных микроорганизмов, хорошей переносимостью. На сегодняшний день доказаны фармакоэкономические преимущества применения дорипенема. На основании полученных данных во многих странах, в т.ч. в РФ, дорипенем включен в национальные руководства по лечению НП, в т.ч. НП-ИВЛ.



