В Российской Федерации за период с 2007 по 2012 г. заболеваемость меланомой кожи среди мужчин выросла на 8,6% и занимает третье место по темпу прироста заболеваемости среди всех злокачественных новообразований. Смертность за 5 лет среди мужчин выросла на 5,6% – это третье место по темпу увеличения смертности [1]; 69% случаев смерти от злокачественных новообразований кожи приходятся на меланому [2]. На фоне стандартного химиотерапевтического лечения медиана общей выживаемости при диссеминированной меланоме кожи составляет лишь 6–9 месяцев, а трехлетняя выживаемость не превышает 10–15% [3].
На протяжении многих лет диссеминированная меланома оставалась резистентной ко многим видам системной терапии. Объективный эффект химиотерапии на основе дакарбазина или темозоломида не превышал 1–20% [4]. Использование высоких доз интерферона или интерлейкина-2 определенной категорией больных увеличивало медиану выживаемости до прогрессирования и эффективность лечения [4]. Однако данные мета-анализа 18 исследований не показали увеличения общей выживаемости по сравнению с химиотерапией [5].
Достижения молекулярной биологии в области полиногеномного секвенирования и молекулярного профилирования позволили оценивать мутационную нагрузку тех или иных опухолей. Было показано, что меланома обладает наибольшей мутационной нагрузкой [6]. Мутации, связанные с сигнальным путем MAP, отвечают за метаболизм, транскрипцию генов, пролиферацию и апоптоз опухолевой клетки. Центральное место в сигнальном пути занимает мутация BRAF, которая присутствует в 50–70% меланом. До 90% всех мутаций BRAF V600E обнаруживаются у молодых пациентов [7]. Данная мутация ведет к активации протеинкиназ и как следствие – приводит к неконтролируемой пролиферации опухолевых клеток. Большинство мутаций происходит в 15-й экзоне, в кодоне 600 (BRAF V600), среди них наиболее часто – 75% случаев) встречается мутация BRAF V600E, менее часто – BRAFV600К (в 10–30% случаев), остальные мутации встречаются редко – около 1% случаев [8].
В 2011 г. FDA (Food and Drug Administration) был зарегистрирован первый BRAF-ингибитор для лечения диссеминированной, или нерезектабельной, меланомы кожи (III и IV стадий), имеющей мутацию BRAFV600E – вемурафениб, в 2013 г. был зарегистрирован второй ингибитор BRAFV600E – дабрафениб. В 2014 г. была зарегистрирована комбинация BRAF-ингибитора дабрафениба в сочетании с MEK-ингибитором траметинибом, которая показала значительные преимущества перед монотерапией.
В 2010 г. были представлены результаты I фазы исследования препарата дабрафениба – BREAK-1. В исследование были включены 156 пациентов с диссеминированной меланомой кожи. Большинство из них (131 пациент) имели мутацию BRAFV600E, остальные – BRAFV600K, BRAFK601E, BRAFV600_K601E, BRAFwt. Рекомендуемая доза препарата для фазы II составила 150 мг 2 раза в сутки [9].
На основании результатов I фазы было инициировано исследование II фазы дабрафениба в монотерапии BREAK-2. В исследование были включены 92 пациента с мутацией BRAF (76 BRAFV600E, 16 BRAFV600K). Пациенты ранее не получали терапию MAPK-нгибиторами и не имели метастазов в головной мозг. Побочные эффекты были такие же, как и в исследовании BREAK-1. Наиболее часто отмечались артралгия, кожная токсичность, гипертермия и слабость. В связи с развившимися осложнениями 22% пациентов потребовалась редукция дозы. Эффективность лечения пациентов с мутацией BRAFV600E составила 52%, а пациентов с мутацией BRAFV600K оказалась значительно ниже – только 13%. Медиана выживаемости без прогрессирования в группе пациентов с мутацией BRAFV600E составила 6,3 месяца и только 4,5 месяца в группе пациентов с мутацией BRAFV600K. Медиана общей выживаемости – 13,1 и 12,9 месяца соответственно. Полученные результаты значительно превосходили эффективность стандартной химиотерапии. При дополнительном анализе было показано, что пациенты с распространенностью болезни М1a/b имели более высокую эффективность лечения и лучшее время до прогрессирования по сравнению с пациентами с М1c [10].
Прогностически важным показателем является уровень лактатдегидрогеназы (ЛДГ). В обеих группах высокий уровень ЛДГ сопровождался меньшей эффективностью лечения, медианой выживаемости без прогрессирования и общей выживаемостью.
На основании данных I и II фаз исследований было инициировано одно из ключевых исследований III фазы BREAK-3 по сравнению эффективности дабрафениба с дакарбазином (NCT01227889) [12]. В исследование включались пациенты с меланомой IIIC/IV стадий, ранее не получавшие терапию по поводу диссеминированной меланомы (за исключением интерлейкина-2), имеющие функциональный статус по ECOG (Eastern Cooperative Oncology Group) 0–1. Пациенты были рандомизированы в соотношении 3:1, обе группы были сопоставимыми по основным характеристикам. Первая группа (n=187) получала дабрафениб 150 мг дважды в сутки внутрь, вторая (n=63) – дакарбазин 1000 мг/м2 внутривенно каждые 3 недели. Пациенты, у которых было зарегистрировано прогрессирование заболевания на терапии дакарбазином, могли в дальнейшем получать терапию дабрафенибом.
Обновленные данные по исследованию опубликованы в сентябре 2015 г.
Медиана выживаемости без прогрессирования в группе дабрафениба составила 6,9 месяца, тогда как в группе дакарбазина – только 2,7. Общая выживаемость в группе с дакарбазином составила 15,6 месяца, а с дабрафенибом – 18,2. Эффективность лечения в группе дабрафениба составила 59% (9% полных ответов и 50% частичного регресса), в группе дакарбазина – 23% (6% полных ответов и 17% частичного регресса). Лучшие результаты по выживаемости в группе дакарбазина в этом исследовании можно объяснить переводом пациентов на лечение дабрафенибом (59%) или лечение вемурафенибом (10%) после прогрессирования.
Побочные эффекты дабрафениба были зарегистрированы у 53% пациентов. Самыми частыми побочными эффектами при использовании дабрафениба были сыпь – 30% (1–2-й степеней тяжести), кератоакантомы – 10% (2-й степени, 4% – 3–4-й степеней), гиперкератоз –12% (1% – 3–4-й степеней), ладонно-подошвенный гиперкератоз – 6% (2% – 3–4-й степеней), гипертермия – 16% (3% – 3-й степени), слабость – 18% (1% – 3-й степени) и артралгия – 19% (1% – 3=й степени). Редукция дозы потребовалась 28% пациентов, а 3% пациентов вынуждены были прекратить прием препарата в связи с токсичностью.
Дополнительно был проведен анализ качества жизни пациентов в обеих группах. Показано, что качество жизни в группе дабрафениба было значительно лучше, кроме того, улучшился эмоциональный статус пациентов.
Важным звеном сигнального пути RAS/RAF/MEK/ERK является киназа MEK. При BRAF-мутациях отмечено ее влияние на активацию сигнального пути.
В исследование I фазы по изучению МЕК-ингибитора траметиниба были включены 206 пациентов, 96 из которых имели диссеминированную меланому. Титрование дозы начиналось с 0,125 мг и продолжалось до 3–4 мг, когда начала наблюдаться дозолимитирующая токсичность. Эффективная доза, имевшая удовлетворительный спектр токсичности, составила 2 мг. Самыми частыми наблюдаемыми побочными эффектами были угреподобная сыпь (88%), диарея, периферические отеки и слабость. Офтальмологическая токсичность возникла у 15% пациентов, включая обратимую центральную ретинопатию (1,5%) и необратимую центральную ретинопатию (<1%). Левожелудочковая недостаточность была отмечена у 8% пациентов. Редукция дозы потребовалась 12% пациентов в связи с кожной токсичностью [14].
K.B. Кim и соавт. в 2011 г. были опубликованы результаты II фазы исследования траметиниба (GSK1120212) в монотерапии пациентов с диссеминированной меланомой кожи [15].
В исследование были включены 97 пациентов (оценены по эффективности 93 пациента) с мутацией BRAFV600E/K. Ранее не получали лечения BRAF-ингибиторами 57 пациентов, а 36 пациентов ранее получили лечение BRAF-ингибиторами. Общая эффективность лечения составила 25 и 0% соответственно. Медиана времени до прогрессирования в группе пациентов, ранее не получавших лечения, составила 4 месяца и только 1,8 месяца в группе пациентов, ранее получавших BRAF-ингибиторы, так же как и медиана общей выживаемости – 14,2 и 5,8 месяца соответственно. Авторами был сделан вывод о неэффективности использования траметиниба пациентами, ранее получавшими BRAF-ингибиторы. Так же как и в исследовании I фазы побочные эффекты были не выражены и наиболее часто отмечались кожная токсичность, диарея, а также периферические отеки, у 2% пациентов отмечалась обратимая центральная ретинопатия, случаев развития окклюзии вен сетчатки не отмечено, у 3% пациентов имело место обратимое снижение функции левого желудочка.
В 2012 г. были опубликованы результаты исследования III фазы траметиниба METRIC (MEK114267). В рандомизированном многоцентровом исследовании [16] изучалось влияние траметиниба на выживаемость пациентов с диссеминированной меланомой кожи с мутацией BRAF. Все пациенты были старше 18 лет, имели функциональный статус 0–1 баллов по ECOG.
С декабря 2010 по июль 2011 г. в исследование были включены 322 пациента. Рандомизация была произведена в соотношении 2:1. Первая группа получала траметиниб 2 мг один раз в сутки, вторая – химиотерапию на усмотрение исследователя: дакарбазин 1000 мг/м2 или паклитаксел 175 мг/м2 один раз в три недели. Группы были сбалансированы, за исключением пациентов с отдаленными метастазами M1c – они преобладали в группе траметиниба. Стратификация была произведена в зависимости от уровня ЛДГ (нормальный или повышенный) и наличия предшествовавшей линии химиотерапии. Медиана выживаемости без прогрессирования в группе траметиниба составила 4,8 месяца, в группе химиотерапии – только 1,5. Шестимесячная общая выживаемость в группе траметиниба составила 81%, в группе дакарбазина/паклитаксела – 67%. Общая эффективность терапии составила 22% в группе траметиниба (2% полный и 20% частичный ответы), 8% в группе химиотерапии (полного регресса не зарегистрировано).
В группе траметиниба чаще регистрировались такие побочные эффекты, как сыпь, диарея, слабость, периферические отеки, дерматит. Чаще других возникала сыпь (57%), в 8% случаев – 3-й или 4-й степени. У 7% пациентов наблюдалось снижение фракции выброса или левожелудочковая дисфункция, 1% пациентов потребовалось отменить терапию в связи с кардиологическими побочными эффектами.
У 9% были зарегистрированы офтальмологические побочные эффекты преимущественно 1-й и 2-й степеней (у 4% пациентов – снижение четкости зрения, у 1% – хориоретинопатия). Из-за побочных эффектов редукция дозы потребовалась 27% пациентов.
В группе химиотерапии редукция дозы потребовалась 10% пациентов. На основании анализа полученных данных было показано, что использование траметиниба снижает риск прогрессирования заболевания на 55% и риск смерти на 56% по сравнению с химиотерапией.
Важной проблемой терапии диссеминированной меланомы кожи остается метастазирование в головной мозг. Общая выживаемость пациентов не превышает 17–22 недель [11].
В многоцентровом исследовании II фазы BREAK-MB (NCT01266967) была показана эффективность дабрафениба при метастазах в головной мозг [11]. С февраля по август 2011 г. в исследование были включены 172 пациента с диссеминированной меланомой кожи старше 18 лет, с мутацией BRAF V600E/K, имевшие по крайней мере один измеряемый очаг от 0,5 до 4,0 см, а также функциональный статус по шкале ECOG от 0 до 1. Пациенты были разделены на 2 когорты: когорта А включала пациентов, ранее не получавших локального лечения по поводу метастазов в головной мозг, в когорте B были пациенты, которые до этого получили один из видов локального лечения: хирургическое вмешательство или лучевую терапию. Все пациенты получали дабрафениб 150 мг 2 раза в сутки внутрь.
Частичный ответ был достигнут у 39,2% пациентов в когорте А и у 30,8% пациентов в когорте В, имевших мутацию BRAFV600E. Те же показатели у пациентов с мутацией BRAFV600K оказались ниже в обеих группах: 7 и 22% соответственно. Контроль заболевания был достигнут у 80–90% пациентов с мутацией BRAFV600E и у 50% с мутацией BRAFV600K. У двоих пациентов в когорте А удалось добиться полного ответа. Общая выживаемость была выше у пациентов с мутацией V600E (33,1 против 16,3 недели в когорте А и 31,1 против 21,9 недели в когорте В). Такая же тенденция сохранялась и при анализе выживаемости без прогрессирования: 16,1 против 8,1 недели в когорте А и 16,6 против 15,9 в когорте В. Частота возникновения побочных эффектов была одинаковой в обеих группах. Редукции дозы или прекращения введения препарата потребовалось 37% пациентов в когорте А и 55% пациентов в когорте В.
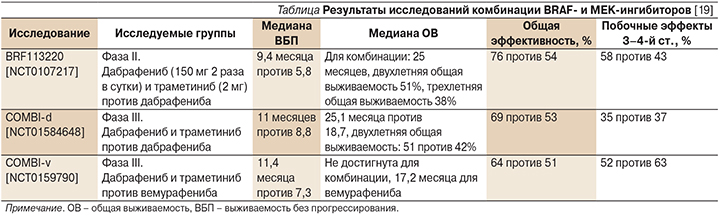
В 2014 г. G.V. Long и соавт. опубликовали результаты большого ключевого рандомизированного двойного слепого исследования III фазы COMBI-d: сравнение комбинации дабрафениба и траметиниба с дабрафенибом в монотерапии [17]. В исследование включались пациенты IIIC–V стадий меланомы кожи с мутацией в гене BRAF, ранее не получавшие системной терапии и имевшие функциональный статус 0 или 1 по ECOG. Допускалось участие в исследовании пациентов с метастазами в головном мозге, которым ранее было проведено локальное лечение. В исследование были включены 423 пациента, которые были рандомизированы в 2 группы в соотношении 1:1. Одна группа получала траметиниб 2 мг 1 раз в сутки в сочетании с дабрафенибом 150 мг 2 раза в сутки, вторая группа получала дабрафениб в той же дозировке и плацебо. В каждой группе были выделены подгруппы в зависимости от типа мутации BRAF (V600E или V600K) и уровня лактатдегидрогеназы. Группы были хорошо сбалансированы. Медиана времени без прогрессирования в исследуемой группе составила 9,3 месяца, в контрольной – 8,8 месяца. При дополнительном анализе групп пациентов с повышенным уровнем ЛДГ было отмечено, что медиана времени без прогрессирования в исследуемой группе составила 7,1 месяца, в контрольной – 3,8, общая выживаемость составила 13,7 и 8,9 месяца соответственно. Шестимесячная безрецидивная выживаемость составила 70% в группе комбинированной терапии и 57% в группе дабрафениба и плацебо. Общая выживаемость к концу того же периода составила 93 и 85% соответственно. Общая эффективность в группе комбинации дабрафениба и траметиниба составила 67% (10% полных ответов, 56% частичных ответов), в группе дабрафениба и плацебо – 51% (9% полных ответов, 43% частичных ответов). Было отмечено значительное снижение риска прогрессирования (на 25%) и риска смерти (на 37%) при использовании комбинации дабрафениба и траметиниба.
Побочные эффекты всех степеней тяжести встречались в двух группах с одинаковой частотой (95–96%). Наиболее частыми побочными эффектами в исследовании были гипертермия, слабость, тошнота, озноб, головная боль, артралгия, сыпь и гипертензия. Однако следует отметить, что частота развития плоскоклеточного рака кожи в группе комбинированной терапии была значительно ниже (2 против 9%). Также при применении комбинации дабрафениба и траметиниба существенно реже возникали гиперкератоз кожи (3 против 32%), папилломы, алопеция и ладонно-подошвенный синдром. Но в группе комбинации препаратов чаще наблюдали гипертермию (5 против 28%), диарею и гипертензию.
В последующем было проведено крупное ключевое рандомизированное исследование III фазы по сравнению эффективности комбинации дабрафениба и траметиниба с монотерапией вемурафенибом – COMBI-v [18]. В исследование были включены 704 пациента, которые были рандомизированы в 2 группы 1:1. Пациенты в исследуемой группе получали дабрафениб 150 мг 2 раза в сутки внутрь и траметиниб 2 мг 1 раз в сутки внутрь, в контрольной группе – вемурафениб 960 мг 2 раза в сутки внутрь. Составы обеих групп были сравнимыми по всем основным характеристикам. Медиана общей выживаемости в группе вемурафениба составила 17,2 месяца, а медиана в группе комбинации не была достигнута. Одногодичная общая выживаемость в группе комбинации составила 72%, в группе вемурафениба – только 65%. Разница в медиане выживаемости без прогрессирования составила более 4 месяцев: 7,3 месяца в группе вемурафениба и 11,4 – в группе комбинации. Частота объективного ответа составила 64% (13% полных ответов, 51% частичных) и 51% (8% полных ответов, 44% частичных) соответственно, а длительность объективного ответа – 13,8 и 7,5 месяца соответственно. Полный ответ был достигнут у 13% пациентов в группе комбинированной терапии и у 8% в группе монотерапии вемурафенибом. Побочные эффекты были отмечены у 91% пациентов в группе комбинированной терапии и у 98% пациентов в группе вемурафениба.
Самыми частыми побочными эффектами в группе комбинированного лечения были гипертермия (53%), тошнота (35%), диарея (32%), озноб (31%), слабость (29%), головная боль (29%) и рвота (29%). В группе вемурафениба чаще регистрировали артралгию (51%), сыпь (43%), алопецию (39%), диарею (38%), тошноту (36%) и слабость (33%). Кожная токсичность чаще встречалась при лечении вемурафенибом: сыпь (43 против 22%), фотосенсибилизация (22 против 4%), ладонно-подошвенный синдром (25 против 4%), папилломы (23 против 2%). Плоскоклеточный рак и кератоакантомы значительно реже встречались в группе комбинированной терапии (18 против 1%), так же как и гиперкератоз (25 против 4%). У 13% пациентов в группе комбинированной терапии и у 12% в группе вемурафениба побочные эффекты послужили причиной прекращения терапии.
В исследуемой группе это было связано с гипертермией (3%) и снижением фракции выброса левого желудочка (3%), в контрольной группе – с артралгией (2%). Побочные эффекты 3–4-й степеней были зарегистрированы у 52% пациентов в исследуемой группе и у 63% пациентов в группе сравнения. Было показано, что использование комбинации дабрафениба с траметинибом привело к снижению риска смерти на 31% и на 44% снизило вероятность прогрессирования заболевания по сравнению с группой пациентов, получавших только вемурафениб. Была показана высокая эффективность комбинированной терапии BRAF- и MEK-ингибиторами, а также снижение частоты и выраженности побочных эффектов по сравнению с монотерапией только BRAF-ингибиторами.
Ниже представлены результаты по эффективности лечения комбинаций BRAF- и MEK-ингибиторов в различных клинических исследованиях (см. таблицу).
Гипертермия является наиболее частым побочным эффектом при использовании BRAF- и MEK-ингибиторов, точная этиология этого побочного эффекта на данный момент пока не установлена. В исследовании, посвященном изучению гипертермии при использовании комбинации дабрафениба и траметиниба, она встречалась у 59% всех пациентов. Из них 24% испытывали такие симптомы, как озноб, ночная потливость, гипотензия без повышения температуры тела. Гипертермия в среднем возникала на 19-й день после начала терапии и длилась около 9 дней. Наиболее эффективной стратегией является временное прекращение приема препарата, что сопровождается разрешением гипертермии в течение 24 часов, после чего прием препарата может быть возобновлен. Также может быть рассмотрен прием парацетамола или нестероидных противовоспалительных средств в качестве симптоматической терапии [20].
Интересные данные были представлены на конгрессе Европейской ассоциации дерматоонкологов в 2015 г.
В исследовании были проанализированы данные 80 пациентов с местнораспространенной и диссеминированной меланомой с мутацией BRAF.
У этих пациентов был определен уровень D-димера до начала лечения, а также через 2 и 4 недели после начала лечения. Было показано, что общая выживаемость и время без прогрессирования в группе с исходно низким уровнем D-димера оказались значительно лучше [13].
Сегодня проводится большое количество клинических исследований новых препаратов для лечения диссеминированной меланомы кожи. Изучаются новые комбинации ингибиторов BRAF и MEK в сочетании с иммунотерапией, а именно блокаторами контрольных точек иммунного ответа (PD-1\PDL-1, CTLА-4).
Использование новейших препаратов в лечении диссеминированной меланомы кожи ведет к повышению эффективности терапии. Вместе с прогнозом улучшается и качество жизни пациентов. Многочисленные исследования, которые проводятся на сегодняшний день, дают основание предполагать, что и эти результаты в перспективе могут быть улучшены. Хочется верить, что в связи с результатами новейших исследований диссеминированная меланома кожи в скором времени перестанет быть одной из наиболее агрессивных форм злокачественных опухолей.



