Введение
Итоги диспансеризации взрослого населения Российской Федерации 2013 и 2014 гг. показали, что эндокринные заболевания занимают третье место по частоте выявления после артериальной гипертензии и ишемической болезни сердца с нарастанием в динамике с 47,8 до 50,8 человека на 1000 обследованных. Основными заболеваниями этой группы стали сахарный диабет, заболевания щитовидной железы (ЩЖ), избыточная масса тела и ожирение [1].
Болезни ЩЖ с повышением ее функции, и особенно диффузный токсический зоб (ДТЗ), занимают значимое место не только в ряду группы эндокринных проблем, но и в аспекте поражения сердечно-сосудистой системы (ССС). Согласно эпидемиологическим данным, частота тиреотоксикоза в популяции имеет значительные колебания – от 0,6 до 16,0% [2–4], и зависит от используемых критериев, гендерных и возрастных особенностей, наследственной предрасположенности, стрессорных и инфекционных воздействий, инсоляции, что было показано на взрослой американской популяции (NHANES III) [5, 6]. В настоящее время большое значение в развитии ДТЗ придают органоспецифическому стимулирующему эффекту аутоантител, синтезируемых в ответ на наличие патологического дефекта Т-лимфоцитов-супрессоров, экспрессирующих DR-антигены на поверхности тиреоцитов у предрасположенных лиц – носителей генов гистосовместимости HLA B8, HLA-Dw3 и HLA DR3, причем последние 2 гена увеличивают риск заболевания в 3,86 и 5,9 раза соответственно по сравнению с HLA-B8 [7].
Клинические проявления гипертиреоза ассоциированы не только с традиционными специфическими эффектами тиреотропных гормонов (эндокринная офтальмопатия, претибиальная микседема, катаболические проявления), но и с повреждением ССС. Имеются клинические и экспериментальные доказательства повышения как общей, так и кардиоваскулярной смертности среди пациентов с клинически значимым и субклиническим гипертиреозом [8–10].
В настоящее время оценивают краткосрочные и отсроченные кардиоваскулярные поражения, связанные с токсическим действием тиреоидных гормонов. Среди быстрых эффектов гипертиреоидизма выделяют гипердинамический вариант функционирования ССС, проявляющийся в повышении сердечного выброса, снижении периферического сопротивления и в развитии тахикардии [11–13]. К отсроченным эффектам гипертиреоза относят гипертрофию кардиомиоцитов вследствие гиперфункции и активации межклеточных сигнальных взаимодействий, прогрессирование сердечной недостаточности, нарушения ритма [14–20].
Однако, несмотря на известные кардиотоксические влияния тиреоидных гормонов, коррекция поражений ССС у данной когорты больных не имеет четких рекомендаций. Так, в настоящее время для лечения ДТЗ (гипертиреоза) применяется три подхода: консервативная медикаментозная терапия, хирургическое лечение и применение радиоактивного йода. Безусловно, медикаментозная терапия рассматривается как наиболее физиологичная и, согласно современным рекомендациям [21], включает использование тиамазола в дозе 20–40 мг/сут (или пропицила 200–400 мг/сут) до достижения эутиреоза (данный этап занимает около 8 недель) с последующим постепенным снижением дозы тиамазола на 5 мг (пропицила на 50 мг) в течение 5–7 дней до поддерживающей дозы 5–10 мг тиамазола (пропицила 50–100 мг). При достижении эутиреоза добавляется небольшая доза левотироксина 50–100 мкг (схема «блокируй и замещай») для предотвращения развития медикаментозного гипотиреоза и струмогенного эффекта тиреостатиков. Продолжительность лечения составляет 12–18 месяцев (если нет показаний к оперативному вмешательству). В качестве симптоматической терапии рассматривается использование β-адреноблокаторов в дозах, нормализующих частоту сердечных сокращений (ЧСС), устраняющих тремор, потливость, тревожность до достижения эффекта, и с постепенным ее снижением до их полной отмены [22].
Вместе с тем в рекомендациях ни по коррекции тиреотоксикоза [21, 23, 24], ни по профилактике сердечно-сосудистой патологии [25] нет четких указаний на возможность дополнительной кардиотропной поддержки в терапии гипертиреоза, что и явилось основанием нашего исследования.
Цель настоящего исследования: сравнительная оценка кардиотропных эффектов стандартной терапии тиамазолом в сочетании с метопрололом тартратом против комплексной терапии с дополнительным использованием фозиноприла и этилметилгидроксипиридина сукцината пациентов с гипертиреозом на фоне диффузного токсического зоба.
Материал и методы
В наблюдение включены 57 пациентов с диффузным токсическим зобом в возрасте 40,32±4,64 года. Диагноз установлен в условиях эндокринологического отделения НИИ-ККБ № 1 им. проф. С.В. Очаповского. Средняя продолжительность заболевания до установления диагноза и начала лечения составила 1,8±1,1 года (от 0,3 до 3,0 лет) и определялась временем обращения больных за медицинской помощью. Диагноз устанавливался на основании полного клинического обследования больных, определения уровня тиреотропных гормонов в сыворотке крови и общетрадиционном дифференциально диагностическом исследовании. При включении пациентов в исследование методом конвертов образовано две группы с разным объемом терапии. Пациенты 1-й группы (37 человек) получали стандартную терапию, включавшую антитиреоидный препарат тиамазол (Тирозол, Merck KGaA, Германия) в суточной дозе 29,48±4,7 мг и β-адреноблокатор метопролола тартрат (Эгилок, EGIS Pharmaceuticals PLC) в суточной дозе 37,5±25,22 мг. Пациенты 2-й группы (20 человек) получали сочетанную терапию, к поддерживающей (стандартной терапии тиамазолом и метопролола тартрат) добавляли ингибитор ангиотензинпревращающего фермента (иАПФ) фозиноприл (Фозикард, Актавис, Швейцария) в суточной дозе 10,34±6,22 мг и этилметилгидроксипиридина сукцинат (Мексидол, ЗАО «АЛСИ-Фарма», ЗАО «АЛСИ Фарма» по 250 мг 3 раза в сутки) 598,45±138,40 мг/сут. До лечения сравниваемые группы больных тиреотоксикозом статистически не различались (табл. 1). В группу контроля включили 30 практически здоровых лиц без патологии ЩЖ сравнимого возраста. В исследование не включили пациентов с ишемической болезнью сердца, сердечной недостаточностью выше второго функционального класса, пороками сердца, тяжелыми нарушениями ритма и проводимости, сахарным диабетом 1 и 2 типов, другими состояниями, сопровождающимися тиреотоксикозом без гипертиреоидизма, или с низким поглощением радиоактивного йода (подострый тиреоидит, ятрогенный тиреотоксикоз в результате избыточного приема тиреоидных гормонов), раком ЩЖ, по данным пункционной биопсии, злоупотреблением алкоголем, непереносимостью используемых в исследовании лекарственных препаратов.
Оценивали клинические показатели сердечной деятельности (артериальное давление – АД, ЧСС, самочувствие больных) и морфометрические показатели сердечной мышцы методом эхокардиографии (ЭхоКГ). Ультразвуковое исследование ЩЖ и ЭхоКГ проводили на ультразвуковом сканере ACUSON S2000 по стандартной методике. Размеры ЩЖ определяли в соответствии с рекомендациями Всемирной организации здравоохранения: стандартный объем ЩЖ у мужчин – 7,7–25 мл (см3), у женщин – 4,4–18 мл (см3). При оценке степени хронической сердечной недостаточности (ХСН) использовалась классификация сердечной недостаточности Нью-Йоркской ассоциации сердца (NYHA – New York Heart Association).
Сывороточный уровень тиреотропного гормона (ТТГ), свободных трийодтиронина (св. Т3) и тироксина (св. Т4) определяли с помощью иммуноферментного анализатора Statfax 2100. Использовались готовые тест-наборы для иммуноферментного анализа (ИФА) ЗАО «Вектор-Бест» (Российская Федерация). Определение указанных факторов в сыворотке крови проведено строго по прилагаемым протоколам производителей. За нормальные значения принимали следующие референсные показатели: св. Т4 – 10–27 пмоль/мл, св. ТЗ – 2,2–6,4 пмоль/мл, ТТГ – 0,32–5,0 МкМЕ/мл, определение антител к тиреоидной пероксидазе (АТ-ТПО, норма меньше 50 ЕД/л) как «маркер» аутоиммунных нарушений ЩЖ.
Первоначальное обследование и назначение лечения проведены в условиях стационара, последующая эффективность лечения оценивалась каждые 2 месяца с определением приверженности терапии, уровня тиреоидных гормонов и ТТГ с коррекцией дозы тиамазола и β-адреноблокатора. При нормализации уровня ТТГ добавляли малые дозы L-тироксина. Этилметилгидроксипиридина сукцинат (Мексидол) рекомендовали применять в течение 2 месяцев с 2-месячным перерывом. Дозы метопролола и фозиноприла контролировали с учетом значений АД и ЧСС.
Качество жизни оценивали по визуальной аналоговой шкале (ВАШ) с обозначением от 0 (минимальное) до 100 мм (максимальное значение).
Статистическую обработку полученных данных выполняли на персональном компьютере Acer с использованием пакета лицензионных статистических программ Statistica 10 (Statsoft Inc., USA). Для правильного определения возможностей использования определенных статистических критериев оценивали распределение всех изученных параметров. Установлено наличие нормального распределения, в связи с чем использовали критерий Стьюдента с поправкой Бонферрони. Данные представлены в виде среднего арифметического и стандартного отклонений (М±SD, p<0,05).
Результаты и обсуждение
Клинические и основные лабораторные показатели обследованных пациентов представлены в табл. 1. В начале исследования сравниваемые группы пациентов были сопоставимыми по возрастным, клиническим и лабораторным показателям.
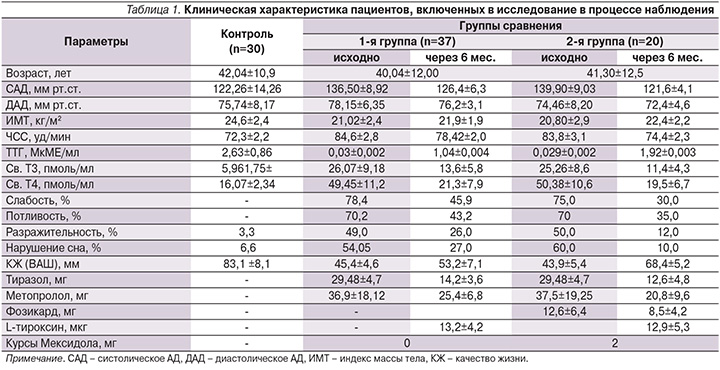
У обследованных нами больных тиреотоксикозом исходно повышенная фракция выброса (ФВ) снижалась в обеих группах. При этом в 1-й группе отмечено снижение данного показателя на 3,27% с сохранением статистически значимых различий с показателем группы контроля (p<0,001). У пациентов 2-й группы ФВ снизилась на 8,40% и достигла значений, достоверно не отличающихся от таковых у здоровых.
Более выраженным во 2-й группе было уменьшение размеров левого предсердия (ЛП1 и ЛП2), которое в 1-й группе составило 2,24 и 3,5%, тогда как у пациентов 2-й группы эти размеры уменьшились на 5,64 и 9,69% соответственно. В группе комплексной терапии определено также более значимое уменьшение размеров правого предсердия – на 11,75 и 8,11% против 2,77 и 3,03% соответственно в 1-й группе традиционного лечения. Определено также в 3,5 раза более выраженное уменьшение размера правого желудочка во 2-й группе, что сопровождалось снижением систолического АД в легочной артерии на 16,2 и 22,35% соответственно в 1-й и 2-й группах пациентов, участвовавших в исследовании.
Положительную направленность имели и показатели, отражающие наличие гиперфункции сердечной мышцы, такие как толщина задней стенки левого желудочка (ЛЖ), с более чем в 2 раза выраженным эффектом во 2-й группе лечения (уменьшение на 16,98 по сравнению с 7,21% у больных 1-й группы). Аналогичные данные получены в отношении толщины межжелудочковой перегородки (соответственно уменьшение на 7,69 и 20,88% в 1-й и 2-й группах) и индекс конечного диастолического размера ЛЖ (снижение на 7,16 и 19,48% соответственно) с более значимой коррекцией диастолической функции ЛЖ (табл. 2). Отражением указанных положительных сдвигов проводимой терапии стало ее влияние на долгосрочные нарушения, к которым относят массу миокарда. Так, индекс массы миокарда ЛЖ (иММЛЖ) уменьшился на 18,84% в 1-й группе и на 31,81% у пациентов 2-й группы. И несмотря на то что этот показатель во 2-й группе не достиг значений здоровых пациентов, различие со здоровыми во 2-й группе составило 27,2 против 51,5% со значениями этого показателя у пациентов 1-й группы.
Интерес к проблеме адекватной терапии ДТЗ определяется его высокой распространенностью в популяции населения развитых стран (1–3%), гендерными аспектами (соотношение мужчин и женщин 1:5–1:7), ежегодным нарастанием заболеваемости (от 5–6 до 23 случаев на 100 тыс. населения) [26, 27].
Эффективность сочетанного применения тиамазола и β-адреноблокаторов в настоящее время считается доказанной, определена Рекомендациями Американской тиреоидной ассоциации и Американской ассоциации клинических эндокринологов по диагностике и лечению тиреотоксикоза [23] и поддерживается российскими эндокринологами [21].
К настоящему времени четко разработана тактика диагностики и ведения пациентов с признаками тиреотоксикоза на фоне ДТЗ, однако такое серьезное осложнение заболевания, как поражение ССС, еще не нашло значимого места в рекомендациях эндокринологов. Между тем немногочисленные исследования показывают, что поражение ССС наблюдается у подавляющего большинства пациентов [28]. Чаще всего описывается наличие таких клинических проявлений, как постоянная синусовая тахикардия, артериальная гипертензия, формирование тиреотоксической кардиомиопатии с фибрилляцией предсердий и ХСН [29–31]. Установлено, что именно поражение ССС при тиреотоксикозе определяет качество жизни, тяжесть и прогноз заболевания, сохранность трудоспособности [32].
Наряду с традиционными данными о прямом влиянии тиреоидных гормонов на миокард [33] в последние годы появляются работы, подтверждающие иммунные нарушения при ДТЗ и важную роль активации цитокиновой системы при формировании заболевания, а также участие этих механизмов в поражении ССС, что объясняет прогрессирование кардиальной патологии на фоне адекватной коррекции гормонального статуса [34–37].
Особое значение в поражении ССС, непосредственно миокардиальных повреждений, и в формировании ХСН придают патогенетической роли активации таких цитокинов, как фактор некроза опухоли α (ФНО-α), интерлейкин-6 (ИЛ-6) и др. [38–43]. В эксперименте показано, что ИЛ-1β и ФНО-α подавляют сократительную способность миокарда in vivo при введении интактным животным и in vitro – на моделях изолированного сердца, изолированных папиллярных мышц и в культуре кардиомиоцитов, способствуют ремоделированию ЛЖ и индуцируют апоптоз [44–47].
Существуют данные и о влиянии отдельных цитокинов непосредственно на клетки ЩЖ – показана способность ИЛ-1 и ФНО-α ингибировать тиреоидный метаболизм. Некоторые авторы на основании анализа многочисленных данных высказывают предположение, будто выброс цитокинов, особенно ФНО-α, стимулируется тиреоидными гормонами, причем как напрямую, так и через активацию ренин-ангиотензин-альдостероновой системы. При этом развиваются процессы апоптоза кардиомиоцитов и формируется ремоделирование миокарда ЛЖ с его диастолической дисфункцией и снижением вариабельности ритма сердца [48]. Эти данные позволяют ожидать дополнительного положительного влияния иАПФ при лечении пациентов с ДТЗ. ИАПФ доказали свою эффективность в коррекции АД при артериальной гипертензии, профилактике сердечной недостаточности, увеличении продолжительности жизни пациентов с сердечно-сосудистой патологией [49, 50]. Доказано, что иАПФ являются патогенетически обоснованным средством в лечении больных хроническим легочным сердцем [51, 52]. Наиболее важна способность иАПФ уменьшать процессы неспецифического воспаления и интенсивность оксидативного стресса [53], включая коррекцию эндотелиальной дисфункции сосудистой стенки. Представленные данные позволяют предположить, что дополнительное применение иАПФ будет иметь ряд преимуществ в коррекции кардиоваскулярных нарушений у пациентов с гипертиреозом.
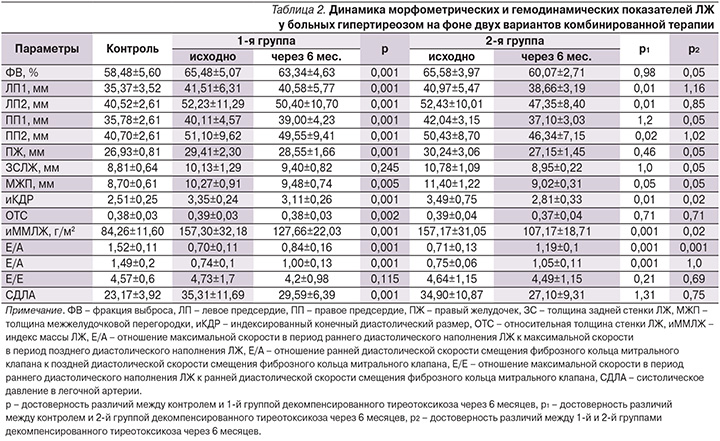
Полученные в нашем исследовании более выраженные положительные сдвиги морфометрических параметров в группе пациентов с дополнительным применением фозиноприла можно объяснить доказанным влиянием фозиноприла на рестриктивные свойства миокарда, способностью снижать чувствительность миокардиоцитов к воздействию катехоламинов, уменьшать гипертрофию сердечной мышцы [54, 55] и снижать активность эндотелина, рассматриваемого в качестве предиктора неблагоприятного прогноза в отношении сердечно-сосудистых осложнений.
В развитии повреждений миокарда у больных тиреотоксикозом большое значение придают оксидативным нарушениям [56], что определяет возможные дополнительные эффекты для использования Мексидола, который содержит сукцинат и обладает выраженными антигипоксантными и противоишемическими свойствами [57, 58]. Наряду с выраженным антигипоксическим действием Мексидол блокирует перекисные радикалы белков и липидов, модулирует активность мембраносвязанных ферментов, блокирует синтез некоторых простагландинов, тромбоксана и лейкотриенов, оптимизирует энергосинтезирующие функции митохондрий при гипоксии, улучшает синаптическую передачу, улучшает реологические свойства крови, подавляет агрегацию тромбоцитов.
Показана эффективность Мексидола при ишемических повреждениях: острых и хронических нарушениях мозгового кровообращения, вегетососудистой дистонии и других состояниях [59–61].
Необходимо отметить, что ранее исследователями демонстрировались положительные кардио- и вазопротективные эффекты сочетанного применения фозиноприла и Мексидола пациентами с эссенциальной гипертензией [62, 63]. В то же время исследований эффективности этих препаратов для пациентов с диффузным токсическим зобом на фоне применения антитиреоидной терапии в сочетании с β-блокаторами явно недостаточно.
Заключение
Понимая ограниченный характер нашего исследования и с учетом небольшого числа включенных в него пациентов, следует отметить, что пролонгированная 6-месячная стандартная терапия пациентов с ДТЗ, дополненная иАПФ и этилметилгидроксипиридина сукцинатом оказывает более выраженное положительное влияние на морфометрические и гемодинамические показатели функционирования ССС. Нам также хотелось бы привлечь внимание к проблеме недостаточной коррекции кардиоваскулярных повреждений у больных тиреотоксикозом на фоне ДТЗ при адекватной тиреостатической терапии. При этом, согласно принятым в настоящее время стандартам оказания медицинской помощи пациентам с признаками тиреотоксикоза, при диагностике заболевания консультация кардиолога предусмотрена только в 60% случаев 1 раз, исследование ЭхоКГ рекомендуется однократно 30%, а оценка электрокардиограммы однократно 90% пациентов. При наблюдении в процессе лечения консультация кардиолога обосновывается только в отношении 30% пациентов однократно, а запись электрокардиограммы – 1 раз для 40% больных [64]. В то же время фармакоэкономический анализ позволил установить, что при переходе тиреотоксикоза в осложненную форму лекарственные затраты увеличиваются на 7590 руб. на человека на 18 месяцев лечения [65]. Приведенные данные оправдывают проведение более углубленных исследований для уточнения возможности и необходимости дополнительного кардиотропного воздействия в дополнение к традиционной тиреотропной терапии пациентов с гипертиреозом.



