Введение
Проблемы репродуктивного старения женщин, необходимость поддержания и улучшения качества жизни и здоровья женщины в период возрастных изменений остаются актуальной задачей современной медицины, особенно в свете существующих демографических тенденций. Менопауза и постменопауза в наши дни не являются синонимом окончания социальной жизни и сексуальной активности, т.к., по усредненным данным, современная женщина около трети своей жизни проводит в этих периодах [1].
Процессы, происходящие в организме женщины в период менопаузы, зачастую сопровождаются осложнениями и симптомами, негативно влияющими на качество жизни и здоровье в целом. Вульвовагинальная атрофия (ВВА) – одно из наиболее характерных осложнений процесса репродуктивного старения. Дефицит эстрогенов, возникающий в менопаузальном периоде, может приводить к уменьшению и потере эластичности влагалищной стенки вместе с уменьшением выделений и истончением вагинального эпителия [2]. Урогенитальные симптомы – сухость влагалища, зуд, раздражение, жжение, усугубляются по мере снижения уровня эстрогенов. ВВА сопровождается болезненными половыми контактами и провоцирует такие симптомы, как недержание мочи, гиперактивный мочевой пузырь, атрофический цистоуретрит, сердечно-сосудистые заболевания и остеопороз [3].
Однако, сегодня медицинские специалисты всего мира сходятся в том, что ВВА является лишь частью более широкого комплекса вагинальных, урологических и других симптомов, который был назван генитоуринарным менопаузальным синдромом (ГУМС). Наиболее точное и современное определение ГУМС сформулировано следующим образом: это симптомокомплекс, возникающий у женщин на фоне дефицита эстрогенов и других половых стероидов, включающий физиологические и анатомические изменения во влагалище, уретре, мочевом пузыре, наружных половых органах (НПО) и промежности. Такое определение было одобрено в 2013–2014 гг. исполнительными комитетами профессиональных сообществ: Международным обществом специалистов по изучению сексуального здоровья женщин ISSWSH (International Society for the Study of Women’s Sexual Health) и Североамериканским обществом специалистов по менопаузе NAMS (North American Menopause Society), для более корректного обозначения менопаузальных изменений, негативно отражающихся на качестве жизни и здоровье женщины [4]. ГУМС проявляется у 27–84% женщин в постменопаузе [5], по другим оценкам, не менее половины женщин в менопаузе и постменопаузе так или иначе испытывают симптомы ГУМС [6].
Склерозирующий лихен (СЛ) – хронический воспалительный дерматоз, характеризующийся очаговой дистрофией кожи и слизистых оболочек. Основную этиологическую роль в развитии заболевания отводят аутоимунным нарушениям, наблюдается увеличение числа случаев обнаружения у больных аутоантител к внеклеточному матриксному белку 1 (ECM1). Роль последнего заключается в регуляции дифференцировки кератиноцитов, участии в организации коллагена, стимуляции ангиогенеза. Прослеживается генетическая предрасположенность к СЛ (в 5,4–12,0% случаев), однако большое внимание отводят фактором риска, вызывающим продолжительное раздражение, воспаление и/или ишемию кожи и слизистых оболочек, среди них:
- воздействие раздражающих веществ, аллергенов;
- хроническая травма тканей;
- нарушение местного кровообращения, функции микроциркуляторного русла;
- вирусные инфекции гениталий [7].
Распространенность СЛ составляет до 3%, причем у женщин заболеваемость в 3 раза выше, нежели у мужчин. Манифестирует СЛ чаще в пубертатный период и в постменопаузе, сочетаясь в этом случае с симптомами ГУМС и ухудшая самочувствие женщины и качество ее жизни.
Основным методом коррекции симптомов ГУМС (в т.ч. и в сочетании с СЛ) является терапия эстрогенсодержащими препаратами, которые могут применяться как местно (кремы, суппозитории, вагинальные таблетки и кольца), так и системно, если существует необходимость коррекции вазомоторных симптомов климакса. Локальная терапия эстрогенами достаточно безопасна и эффективна в коррекции не только вагинальных (сухость, зуд, диспареуния), но и мочевых симптомов ГУМС (дизурия, стрессовое недержание мочи, гиперактивный мочевой пузырь), однако существует ряд значимых ограничений для ее применения. Прежде всего такая терапия не показана ряду категорий пациенток, как, например, пациенткам с гормончувствительным раком (в т.ч. в анамнезе), пациенткам с нормальным уровнем эстрогенов, высоким уровнем риска тромбозов, острой или хронической печеночной дисфункцией, инфарктом миокарда в анамнезе, и ряду других [8]. В 1980-е гг. среди медицинских специалистов широко обсуждалось, способна ли гормональная терапия спровоцировать рак груди и/или эндометрия [9, 10], при этом даже более поздние исследования не дают однозначного ответа на этот вопрос. Так, в 2002 г. в США была приостановлена наблюдательная программа, в которой участвовали 16 608 женщин в постменопаузе, принимавших гормональные препараты, поскольку наблюдаемый риск развития рака груди и сердечно-сосудистых заболеваний был сочтен неприемлемым [11]. Таким образом, в сознании многих пациенток установилась ассоциация между гормональной терапией и риском онкологических заболеваний, поэтому многие женщины отказываются от приема гормональных препаратов. Кроме того, приверженность подобному лечению среди пациенток довольно низка по ряду причин – от вышеуказанной боязни рака и побочных эффектов до обычной забывчивости и пропуска приема препарата [12].
В качестве негормональной терапии вагинальных симптомов ГУМС и СЛ могут использоваться различные методы: лазерное воздействие (CO2-лазер, эрбиевый лазер, неодимовый лазер), фотодинамическая терапия, радиоволновое воздействие, карбокситерапия, высокочастотный фокусированный ультразвук, а также инъекционные методы. К последним относятся плазмолифтинг (PRP) и введение препаратов на основе гиалуроновой кислоты (интимная контурная пластика, биоревитализация).
Гиалуроновая гислота (ГК) – это природный полисахарид, встречающийся в составе основного вещества многих видов тканей (в коже, связках, пуповине, сердечных клапанах, стекловидном теле глаза и др.) и биологических жидкостей (в слюне, амниотической, синовиальной и суставной жидкостях и др.). ГК обладает множеством биологических функций: поддерживает гидратацию и тургор тканей, являясь самым гигроскопичным веществом тела, оказывает противовоспалительное действие, снижает уровень провоспалительных цитокинов, участвует в процессах обновления, ремоделирования и регенерации тканей и органов, от нее зависит размножение, дифференцировка и миграция клеток (в т.ч. во время эмбриогенеза), осуществляет транспортную и сигнальную функции [13, 14].
Чаще всего для медицинской практики ГК производится биотехнологическим путем, а именно, выращиванием бактериальных культур (Streptococcus zooepidemicus, Streptococcus equi) на питательной среде, что обеспечивает высокую чистоту препарата и отсутствие аллергенных белковых фракций [15].
В основном выбор того или иного препарата ГК основывается на его реологических свойствах: вязкости, эластичности и тиксотропном эффекте. Однако важно учитывать также количественное содержание и характер сшивки молекул ГК, которые определяют скорость биодеградации препарата. Плотность препарата зависит от концентрации и молекулярной массы ГК, притом ввиду выраженной гидрофильности молекул можно добиваться высокой вязкости состава при относительно низкой концентрации ГК.
Исходя из молекулярной массы, препараты ГК подразделяют на:
- высокомолекуляные (~2 МДа);
- среднемолекулярные (~1 МДа);
- низкомолекулярные (~3 кДа).
Местное применение препаратов
ГК – это первая линия терапии вагинальной сухости. Притом, по данным некоторых исследований, в т.ч. рандомизированных контролируемых, эффективность ГК в лечении вагинальных симптомов ГУМС либо сопоставима с таковой местной гормональной терапии, либо превосходит ее [16, 17]. Состав гелей и кремов обычно представлен комбинацией низкомолекулярной ГК и растительных экстрактов (например, хмеля, календулы, клевера).
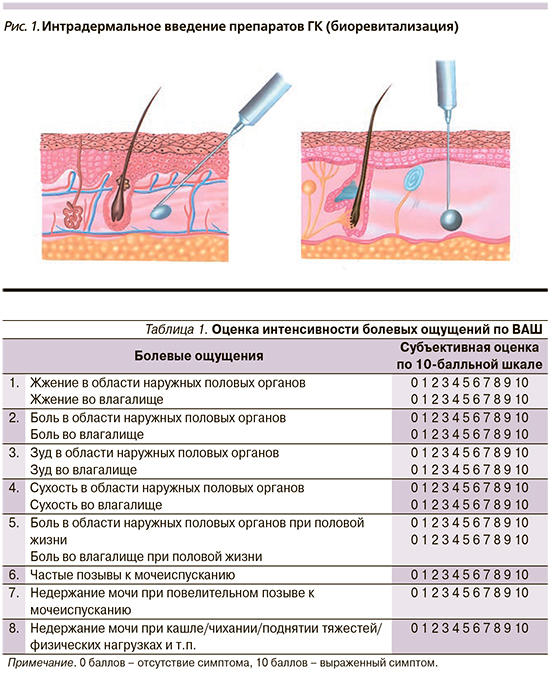
Биоревитализация – интрадермальное введение препаратов на основе нестабилизированной (нативной) ГК. Введение осуществляется болюсной и/или папульной техникой: небольшое количество препарата (до 0,1 мл) депонируется на глубине 1–4 мм в субдермальных слоях (рис. 1).
В настоящее время инъекционные методы пользуются большой популярностью в мире эстетической медицины, и медицинские специалисты небезосновательно предполагают, что многие из них могут быть адаптированы к применению в клинической практике врача-гинеколога. Применение препаратов на основе ГК зарекомендовало себя как метод, приводящий к эффективным результатам и обладающий значительным потенциалом, однако накопленного на данный момент клинического опыта все еще недостаточно для того, чтобы сформировать прочную доказательную базу о плюсах и минусах данного способа лечения. Отдельные исследования инъекционного способа введения ГК при ГУМС, в т.ч. в сочетании с аппаратными методами, подтверждают эффективность и безопасность данной терапии [18, 19], причем результаты длительного наблюдения (1 год и более) говорят о долгосрочном эффекте [20], однако все авторы подчеркивают необходимость дальнейшего изучения возможностей применения ГК для данного симптомокомплекса.
С этой целью в отделении эстетической гинекологии и реабилитации ФГБУ «НМИЦ АГП им. В.И. Кулакова» было проведено наблюдательное исследование по оценке эффективности биоревитализации НПО препаратами на основе ГК в сочетании с аппаратными методами купирования местных симптомов ГУМС и СЛ.
Методы
В исследование были включены 40 пациенток: 20 с ГУМС (группа 1) и 20 с СЛ (группа 2). Период наблюдения составил до 6 месяцев. Включались пациентки 24–65 лет, медиана возраста пациенток в обеих группах составила 42 года. Все пациентки подписали добровольное согласие на использование фото и данных в научных публикациях.
Для оценки результата применялось определение интенсивности болевых ощущений пациентками по визуально-аналоговой шкале (ВАШ, табл. 1), определение индекса вагинального здоровья (ИВЗ, табл. 2), фотофиксация до начала терапии и по ее завершении.
Оценке подлежали пять показателей: объем, качество и pH влагалищных выделений, состояние эпителия влагалища – его увлажненность, эластичность, истонченность. Каждый из параметров оценивали по 5-балльной шкале, затем баллы суммировали.
Перед процедурами все пациентки подписывали информированное согласие на медицинское обследование и лечение. Затем следовали сбор жалоб, анамнеза, общее физикальное обследование, бимануальное исследование, осмотр в зеркалах. При наличии согласия производилось фотодокументирование до процедуры, которое затем повторялось в течение периода наблюдения. Все пациентки проходили обследование в объеме:
- мазок из «V» на флору (14 дней);
- жидкостная цитология/Рар-тест с шейки матки (1 год);
- санация влагалища за 2–3 дня до манипуляции (при 2-й и более степеней чистоты влагалища);
- анализ крови на реакцию Вассермана, антитела (IgM, IgG), Human immunodeficiency virus (HIV 1), Hepatitis C virus, антигену HBsAg (Hepatitis B surface Antigen).
Процедуру начинали с обработки кожи и слизистых оболочек влагалища и НПО асептическим раствором. Затем осуществлялась локальная анестезия:
- кожа НПО: крем, содержащий 2,5%-ный лидокаин и 2,5%-ный прилокаин (ЭМЛА, Акриол Про): 2 г на 10 см2, экспозиция – 50–60 минут под окклюзионной повязкой;
- слизистые оболочки НПО: крем, содержащий 2,5%-ный лидокаин и 2,5%-ный придокаин (ЭМЛА, Акриол Про): 2 г на 10 см2, экспозиция – 10 минут под окклюзионной повязкой.
В присутствии пациентки вскрывали стерильный шприц, содержащий препарат, проверяли срок годности и герметичность упаковки. Проводили инъекции препаратами бренда Мезофарм на основе ГК MesoHydral или Hydro Line Extra (в обеих группах), или Nucleospire DNA-RNA 2% (только в группе СЛ). Повторно обрабатывали кожу и слизистые оболочки НПО 0,05%-ным водным асептическим раствором хлоргексидина и при необходимости 3%-ным раствором перекиси водорода, накладывали асептическую повязку.
После процедуры пациентке рекомендовалось в течение 5 дней воздержаться от физических нагрузок и половых контактов, избегать ношения синтетического белья и обтягивающей одежды, исключить тепловые воздействия (баня, сауна, бассейн, длительное пребывание под прямыми солнечными лучами).
Процедуры проводили двукратно с интервалом 14 дней. Визиты наблюдения осуществлялись через 14 дней после первой процедуры, затем – через 1 и 6 месяцев после второго введения. Повторно оценивали ИВЗ, динамику субъективных ощущений пациенток по шкале ВАШ. Данные регистрировали и обрабатывали при помощи программного пакета ППП Statistica for Window,s v.10.
Результаты
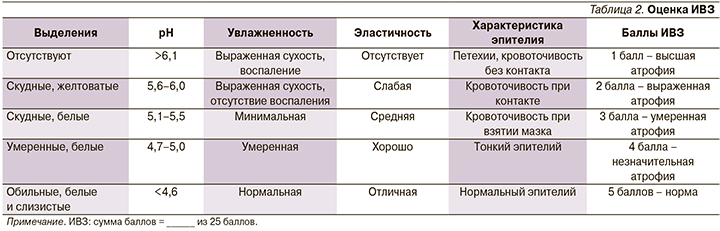
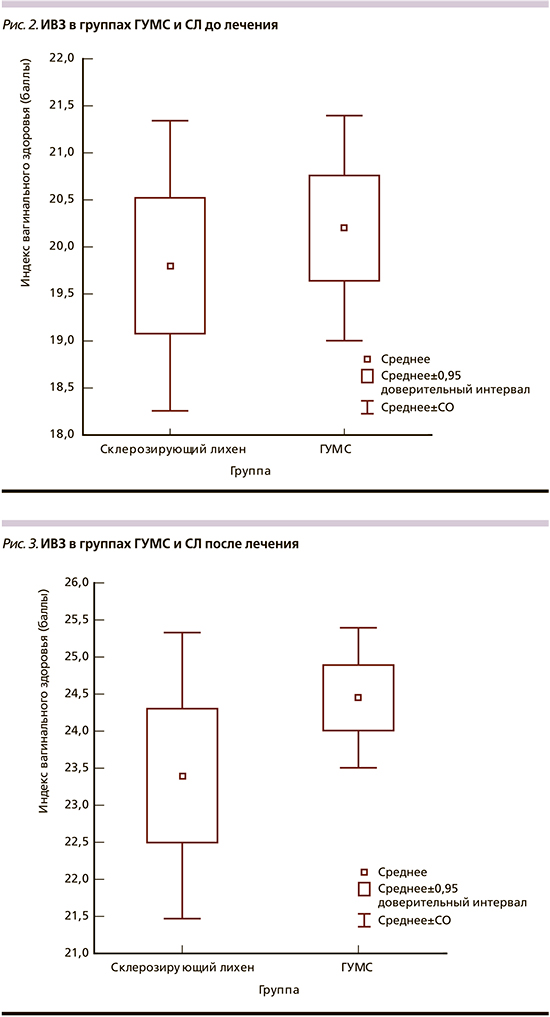
ИВЗ в группах ГУМС и СЛ до лечения был практически одинаковый и составлял 20,2±1,2 и 19,8±1,5 соответственно (рис. 2). После лечения значения данного индекса составляли 24,5±0,9 и 23,4±1,9 соответственно, т.е. было продемонстрировано статистически значимое (р<0,001) улучшение данного параметра в обеих группах. Из вагинальных симптомов сухость влагалища исчезла у 16 (100%) из 16 пациенток группы СЛ и у 17 (94%) из 18 пациенток группы ГУМС, также наблюдалось уменьшение или исчезновение зуда в группе СЛ у 10 (91%) из 11 и в группе ГУМС у 7 (100%) из 7 пациенток. Различий между пациентками, получавшими препараты бренда Мезофарм (MesoHydral или Hydro Line Extra, или Nucleospire DNA-RNA 2%) по исследуемым параметрам не обнаружено. Интересно, что результаты лечения пациенток с ГУМС и СЛ были практически идентичны по всем исследуемым параметрам (рис. 3).
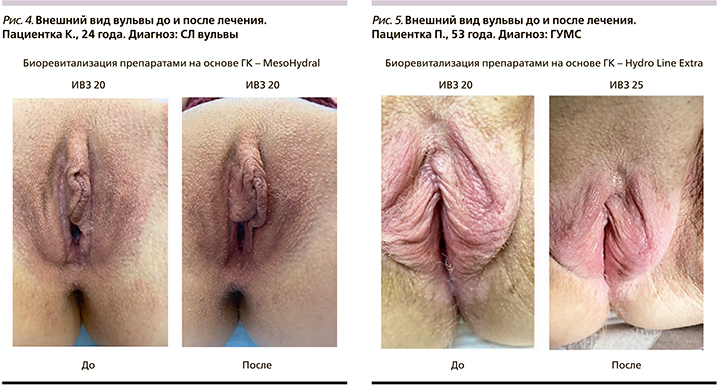
Все пациентки хорошо перенесли процедуры, побочные эффекты отсутствовали, пациентки выражали удовлетворенность лечением (рис. 4–9). Важно, что процедура проводилась амбулаторно, что положительно сказалось как на приверженности пациенток лечению, так и на фармакоэкономическом аспекте терапии.
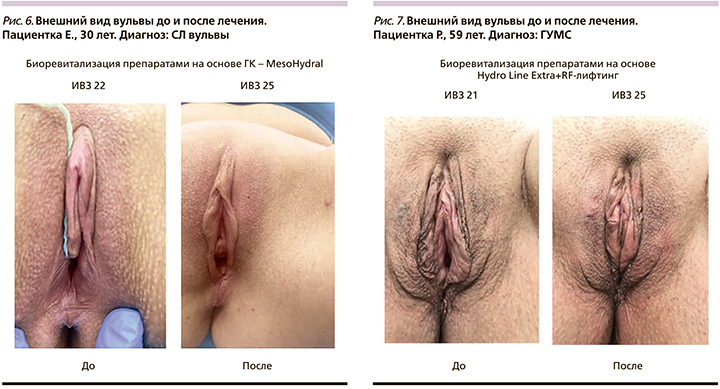
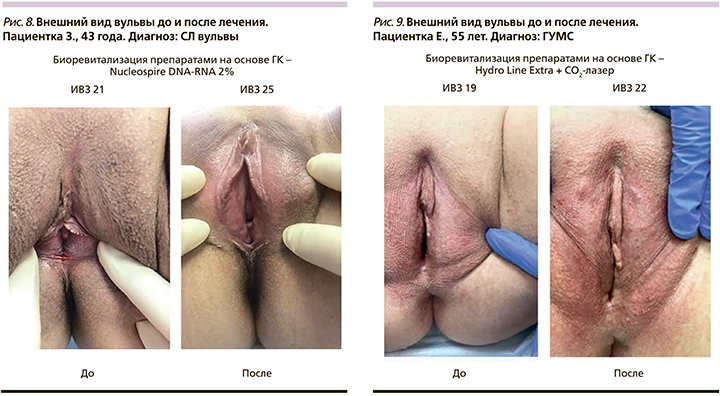
Обсуждение
Инъекции препаратов на основе ГК получают все большее распространение не только в эстетической гинекологии, но и как метод терапии патологических состояний, таких как ГУМС и/или СЛ. Благоприятное воздействие ГК на симптомы ГУМС можно рассматривать доказанным на основании многочисленных исследований ее местного применения в составе увлажняющих препаратов и лубрикантов, однако инъекционный способ введения имеет свои преимущества, среди которых доставка действующего вещества непосредственно в эпителий, отсутствие необходимости применять топический препарат постоянно, длительный эффект, воздействие практически на все симптомы ГУМС, отсутствие аллергических и иных побочных эффектов на вспомогательные вещества в составе топического препарата [21]. Подобная опция представляет собой большую ценность для пациенток с гормончувствительными видами рака, которым не показана гормональная терапия ни в каком виде [22].
Результаты вышеописанного исследования позволяют говорить об эффективности и безопасности трех изученных препаратов на основе ГК как при ГУМС, так и при СЛ – патологическом состоянии, при котором данный препарат в указанной форме ранее не изучался. Мы получили отчетливо выраженный положительный эффект изучаемой терапии при основных симптомах ГУМС – сухости влагалища и зуде, а также общее улучшение ИВЗ. Ограничением настоящего исследования является возраст пациенток (медиана=42 года), т.к. ГУМС наиболее часто проявляется у женщин старшего возраста, тем не менее его симптомы могут возникать у женщин практически в любом возрасте.
Что касается СЛ, в литературе все чаще встречаются упоминания об «омоложении» этого заболевания и распространении в репродуктивном возрасте [23]. Также в перспективе планируется расширить период наблюдения, который в настоящем исследовании составил 6 месяцев, чтобы оценить долгосрочное воздействие терапии и выработать наиболее эффективную стратегию повторного проведения процедур.
Изучение инъекционных препаратов на основе ГК в качестве терапии ГУМС и сопутствующих заболеваний начато в России и за рубежом относительно недавно, поэтому спектр нерешенных задач еще весьма широк. В систематическом обзоре 2021 г., в котором изучалось применение ГК в качестве терапии ГУМС, помимо вполне ожидаемых выводов, относительно высокой эффективности, хорошей переносимости и безопасности было показано, что для современной медицинской науки и практики крайне важны и востребованы исследования инъекционного способа применения ГК, причем особо ценными будут исследования ее применения в монорежиме, дабы исключить смещение результатов за счет воздействия дополнительных компонентов применяемого препарата [24].
Заключение
Таким образом, препараты данного вида могут быть рекомендованы не только к практическому применению, но и к дальнейшему, возможно, более детальному и широкому изучению спектра их возможностей.



