Введение
За последние годы увеличилось число таких хирургических вмешательств на матке, как кесарево сечение (КС), миомэктомия, а также реконструктивно-пластических операций, которые влекут за собой образование рубца на матке у женщин репродуктивного возраста [1, 2] не только повторно-, но и первородящих. Выбор тактики ведения беременности и родов такими пациентками требует особого внимания и в каждом конкретном случае должен осуществляться индиви-дуально [2].
В 17% случаев по всему миру рождение детей происходит путем операции КС [3]. По данным за 2007–2014 гг., оперативное родоразрешение применяют в 25% случаев в Европе, в 33% – в США, в 22% – в России, что в значительной мере превышает рекомендованный показатель Всемирной организации здравоохранения – 10–15% [3, 4].
Операция КС сопряжена с рисками не только во время, но и после операции (кровотечение и инфицирование раны, влекущие за собой нарушение репарации тканей и формирование неполноценного рубца), что в 25% случаев служит показанием к проведению повторного КС [5–7].
Важным условием для сохранения репродуктивной функции, снижения частоты КС и благополучного исхода родов через естественные родовые пути женщин с рубцом на матке считается формирование полноценного рубца, поэтому необходимо создание благоприятных условий для регенерации ткани – хорошее кровоснабжение в области шва и предотвращение развития ишемии и воспалительной реакции в области послеоперационной раны. Все это может быть достигнуто при помощи техники операции, использования вида шовного материала и современных технологий [8–10].
Целью исследования было сравнение тканевых эффектов в области раны на матке после применения аргоноплазменной коагуляции (АПК) и введения гиалуроновой кислоты.
Методы
В качестве объекта исследования были выбраны 30 половозрелых самок крыс линии Вистар в возрасте 3 месяцев массой тела 208,4±7,13 г. Данный вид животных был выбран ввиду анатомических особенностей строения – двурогой матки, что позволяет провести оценку эффективности воздействия по сравнению с контролем внутри одного организма. Эксперимент проведен с соблюдением этических норм (в соответствии с Международными рекомендациями по проведению биомедицинских исследований с использованием животных, 1985).
Экспериментальные операции проведены в асептических условиях, в специально оснащенной операционной, под ингаляционным наркозом (кислородной смесью с изофлюраном). Животным произведен лапаротомный доступ к матке, после чего на матке в области правого и левого рогов острым путем выполнен продольный разрез, не превышавший 1,5 см. Ушивание разреза произведено однорядным непрерывным швом синтетической рассасывающейся нитью. Шов на левом роге матки 15 крыс подвергли обработке аргоновой плазмой с помощью аппарата Фотек ЕА141 в режиме «спрей» со скоростью потока аргона 7 л/мин, другим 15 животным в рану на матке введена гиалуроновая кислота (1,0 мл) в составе официнального препарата. Рана на правом роге матки во всех 30 случаях дополнительному воздействию не подвергалась и считалась контрольной для дальнейшего сравнения сформированных рубцов. Оперативное вмешательство завершалось послойным ушиванием передней брюшной стенки (мышцы и апоневроз ушивались непрерывным однорядным швом синтетической нитью, на кожу накладывались отдельные узловые швы). После операции рана на коже обрабатывалась 1%-ным водным йодсодержащим раствором, после чего наложили асептическую повязку. В послеоперационном периоде животные содержались парами в чистых, свободных клетках. Асептическая повязка удалялась через сутки. Дополнительной обработки швов и антибиотикопрофилактики проведено не было.
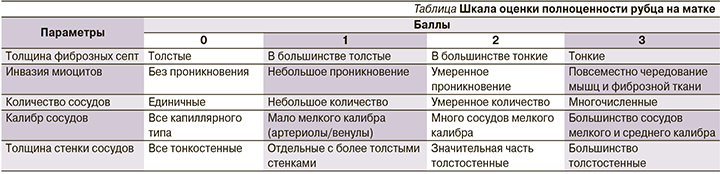
Выведение из эксперимента осуществлялось на 14-е сутки после операции. Участки в области рубцов правого и левого рогов матки фиксировались в 10%-ном растворе формалина, после чего были использрваны для дальнейшего приготовления препаратов для морфологического исследования, проведенного «слепым» методом. Для изучения структуры рубца, выявления особенностей строения соединительной ткани была применена окраска препаратов по Ван Гизону. Группы сравнения были сформированы следующим образом: 1-я группа – из рубцов левого рога матки после АПК (n=15), 2-я – из рубцов левого рога матки после введения гиалуроновой кислоты (n=15), контрольная группа (3-я) состояла из рубцов правого рога матки (n=30).
Для оценки и интерпретации гистологических результатов была разработана специальная шкала с учетом основных признаков формирования полноценного рубца на матке (см. таблицу).
При статистической обработке результатов использован пакет программ Statistica Version 10. При анализе количественных признаков определили среднее арифметическое, дисперсию и 95% доверительный интервал (ДИ). Достоверность разницы между двумя средними показателями оценена с помощью t-критерия Стьюдента. Различия считали статистически достоверными при р≤0,05.
Результаты исследования
Анализ гистологического исследования препаратов показал, что в 1-й группе средняя оценка рубца составила 10,8±1,18 (95% ДИ – 10,17–11,43; δ=1,14) баллов, во 2-й – 11,2±1,12 (95% ДИ – 7,48–14,92; δ=1,03) баллов (р1–2=0,852) и было ожидаемо лучше, чем в контроле – 8,0±0,46 (95% ДИ – 6,36–9,64; δ=0,31) баллов (р1–3=0,033; р2–3=0,012).
Причем данная закономерность отмечена как в целом по группе, так и при сравнении рубца на правом и левом рогах матки одной и той же особи. Рубцы в исследуемых группах гистологически расценивались как «небольшие, с заметным врастанием мышц» либо как «рубец с большим количеством мышечной ткани» (рис. 1), тогда как в контрольной группе преобладали «плотные, грубые рубцы» либо «рубцы с преобладанием соединительной ткани».
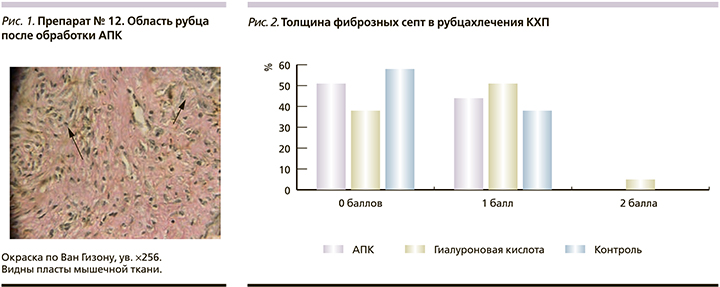
Вместе с тем при сравнительной оценке результатов гистологического исследования 1-й и 2-й групп выявлены различия. Наибольшая инвазия миоцитов в область рубца отмечена после интраоперационной обработки раны АПК и встречалась в 5 (33,3%) случаях. Во 2-й группе инвазия миоцитов на 3 балла встречалась лишь в 3 (20,0%) случаях (р=0,679). В 8 (53,3%) случаях во 2-й группе инвазия миоцитов соответствовала 2 баллам, в то время как в 1-й группе данный показатель был отмечен в 6 (40,0%) случаях (р=0,714). При этом, в контрольной группе инвазия миоцитов была оценена либо на 0, либо на 1 балл (в опытных группах их было по 4 случая – 26,7%; р1–3=0,016; р2–3=0,016). В большинстве наблюдений толщина фиброзных септ значительно не различалась в сравниваемых группах, однако у 5 (33,3%) особей их толщина была меньше. При детальном сравнении групп отмечено, что фиброзные септы были менее выражены после введения гиалуроновой кислоты в область рубца (рис. 2).
Оба воздействия стимулировали ангиогенез в области рубца с формированием полноценной сосудистой стенки. Причем для АПК был характерен активный ангиогенез, многочисленные сосуды после воздействия встречались в 5 (33,3%) случаях (рис. 3), в то время как во 2-й и контрольной группах данный признак отмечен у 4 (26,6%; р=1,000) и у 3 (20,0%; р1–3=0,129; р2–3=0,213) особей соответственно.
Несмотря на то что во 2-й группе в биоптатах рубцов преобладало умеренное количество сосудов (66,7% случаев), в 46,6% (7/15) сосуды были толстостенными, в то время как в 1-й группе данный показатель был несколько ниже – 6 (40,0%) случаев (р=0,885; рис. 4).
Калибр сосудов после воздействия АПК и гиалуроновой кислотой также изменился в сторону увеличения, что подтверждает улучшение регенеративных процессов в области рубца. Так, отмечено появление сосудов среднего калибра в 1-й и 2-й группах (в 6 случаях – 40% и в 5 – 33,3% соответственно; р=1,000), которые в образцах контрольной группы отсутствовали (р1–3=0,001; р2–3=0,004).
Резюмируя полученные результаты, отметим, что интраоперационная обработка ткани АПК стимулирует процессы репарации, повышая инвазию миоцитов в область рубца и увеличивая число новообразованных сосудов бóльшего калибра с полноценной сосудистой стенкой. Несмотря на то что инвазия миоцитов после введения гиалуроновой кислоты увеличилась по сравнению с контролем, но была несколько ниже по сравнению с 1-й группой, ангиогенез завершен формированием толстостенных сосудов.
Обсуждение
Полноценный рубец на матке – наиболее благоприятный фактор для ведения родов через естественные родовые пути как для матери, так и для плода, поэтому формирование состоятельного рубца представляет собой актуальную проблему, в т.ч. за счет повышения активности репарации тканей раны на матке [18].

Сам по себе процесс заживления раны определяется многими факторами, наиболее важные из которых – техника оперативного вмешательства, состояние макроорганизма, шовный материал, величина кровопотери и длительность операции, а также течение послеоперационного периода [11]. Безусловно, одним из определяющих факторов состоятельности рубца на матке может быть сам характер заживления раневой поверхности, определяющую роль в котором играет образование мышечной или рубцовой ткани [18]. Если заживление происходит по типу первичного (с преимущественным образованием мышечной ткани), такие дополнительные факторы риска, как локализация плаценты, промежуток времени, прошедший после КС, производство медицинских абортов после КС, в конечном исходе не имеют принципиального значения [12].
Современная концепция заживления ран рассматривает в т.ч. и формирование рубца на матке. Процессы репарации тканей вне зависимости от первичной локализации объединяются в три последовательные стадии: воспаления, репарации и ремоделирования [6]. При этом ремоделирование – это не только реорганизация рубца, но и (пожалуй, в большей степени) морфофункциональное восстановление утраченных тканей стенки органа – гладкомышечной ткани, эпителия, мезотелия и т.д. В основе образования рубцовой ткани лежит раневой процесс, который сопровождается сложными взаимодействиями клеточных элементов: в его формировании участвуют тучные клетки, лимфоциты, макрофаги и фибробласты. Клетки взаимодействуют посредством цитокинов и факторов роста: тромбоцитарный, трансформирующий β-фактор, основной фактор роста фибробластов, эпидермальный фактор роста и т.д. [6]. Физиологический ангиогенез в своей основе имеет оптимальное течение межклеточных взаимодействий, ведь именно образование новых сосудов (прежде всего мелкого калибра) необходимо для полноценной регенерации соединительнотканного и мышечного компонентов на начальных этапах заживления раны на матке [6]. Именно наличие сосудов мелкого диаметра определяет уровень тканевого метаболизма и оксигенации, транскапиллярного обмена и реологических свойств крови [13].
Биоматериалы и тканевая инженерия для лечения рубцов при ранах кожи, направленные на то, чтобы не только ускорить процесс заживления, но и предотвратить образование шрама или уменьшить размер рубца, широко применяются в настоящее время [14]. Аналогично актуальны для современного акушерства разработка и внедрение материалов и методов, влияющих на репаративные процессы в миометрии, однако число работ, выполненных в этом направлении, весьма ограничено [15, 16, 19].
Еще в 1999 г. в эксперименте на мышах показано, что гиалуроновая кислота оказывает выраженное профилактическое действие на послеоперационные спайки после лапаротомии и была признана перспективным материалом для будущего клинического применения [15]. Для предотвращения внутрибрюшинных послеоперационных спаек использовали адгезионные барьеры (Seprafilm, Gynecare Interceed), однако результаты оказались противоречивыми [16].
Опубликованы результаты применения биоматериала на основе коллагеновой мембраны непосредственно на рану матки в эксперименте и клинике [5]. Авторы приводят результаты гистологического, иммуногистохимического и иммунологического исследований послеоперационных рубцов на матке самок кроликов, которые показали значимые отличия в экспрессии миозина, сосудистого эндотелиального фактора роста и коллагена I типа. Имплантация коллагеновой мембраны в стенку матки повышает толщину миометрия в зоне послеоперационного рубца по сравнению с группой сравнения [5].
Применение коагуляции во время операции для обработки шва на матке и введение в рану на матке гиалуроновой кислоты улучшают течение репаративных процессов в области рубца, как показано в настоящем исследовании. При этом АПК стимулирует локальные процессы восстановления стенки матки, увеличивая инвазию миоцитов, в т.ч. и за счет улучшения ангиогенеза с формированием полноценной сосудистой стенки [19]. В то же время гиалуроновая кислота служит матрицей для ангиогенеза в области послеоперационной раны.
Основные положительные эффекты использования АПК реализуются за счет уменьшения кровопотери (дос-тигается надежный гемостаз), уменьшения объема раневого отделяемого, а также за счет предотвращения отека тканей, травмирующихся при хирургическом доступе. Применение АПК во время КС улучшает микроциркуляцию в области раны, уменьшает болевую афферентацию, способствует формированию состоятельного рубца на матке. Кроме того, значимо снижается частота тяжелых форм послеоперационных гнойно-воспалительных осложнений [9].
Препараты гиалуроновой кислоты показали свою эффективность не только в коррекции воспалительных нарушений пациенток со спаечным процессом в малом тазу с целью уменьшения степени его выраженности, но и для профилактики развития фиброзного процесса [17].
Заключение
Положительные свойства обоих методов воздействия на миометрий – АПК и гиалуроновой кислоты – могут быть использованы для формирования полноценного рубца на матке после оперативного родоразрешения. Актуальность проблемы обусловливает необходимость дальнейших исследований, посвященных изучению механизмов формирования полноценного рубца на матке. Это позволит расширить возможности патогенетически обоснованной профилактики его неполноценности и безопасного родоразрешения через естественные родовые пути при последующих беременностях.



