Введение
Розацеа представляет собой распространенное воспалительное кожное заболевание, которое обычно манифестирует у взрослых людей и поражает лицо. Заболевание характеризуется хроническим течением с эпизодами обострения [1].
Патология встречается у лиц обоего пола в возрасте от 30 до 50 лет (чаще у женщин, примерно в соотношении к мужчинам 4:1), имеющих определенную генетическую предрасположенность к транзиторному (преходящему, временному) покраснению кожи лица за счет расширения сосудов, реже – шеи и зоны декольте [2] Дерматозу больше подвержены лица I и II (североевропейского) фототипов (т.н. приливы кельтов), однако заболевание может встречаться при любом фототипе кожи [3]. В странах Европы заболеваемость розацеа в среднем составляет от 1,5 до 10%, в России – 5% [1, 4].
Наиболее значимые триггеры для развития розацеа: воздействие ультрафиолетовых лучей, низких или высоких температур, психологический стресс, прием раздражающей пищи либо алкоголя, горячие ванны, повышенная влажность воздуха [5].
Механизм развития розацеа весьма сложный. Большое значение в развитии розацеа придают нарушениям врожденного иммунитета, опосредованным активацией ТLR 2-го типа (toll-like подобных рецепторов). Триггеры, клещи рода Demodex, микроорганизм Bacillus oleronius и др. бактерии повреждают кожный барьер и способствуют активации калликреин-кининовой системы, появлению аномальной формы кателицидина LL37. В результате происходит стимуляция тучных клеток, ангиогенеза, Th-1и Th-17-иммунного ответа и мощный выброс провоспалительных цитокинов и хемокинов в коже. Активация кератиноцитов и эндотелиоцитов, а также раздражение нервных окончаний в коже способствуют избыточному выбросу субстанции Р и кальцитонин-зависимых пептидов. Это приводит к сосудистой вазодилатации, повышению проницаемости капилляров кожи, формированию приливов, оказывающих дополнительное неблагоприятное влияние на ангиогенез, развитию отека и формированию нейтрофильного инфильтрата в дерме [6–10]. Нарушение проницаемости барьера рогового слоя эпидермиса вызывает повышение чувствительности кожи у пациентов с розацеа [9–11].
Основные клинические признаки розацеа принято разделять на первичные (преходящая эритема, стойкая эритема, наличие папул, пустул и телеангиэктазий) и вторичные (жжение и болезненность в очагах, отек, центрофациальная локализация очагов, наличие фим). Для постановки диагноза достаточно одного первичного и одного вторичного признаков. Отдельно выделяют четыре подтипа розацеа: эритемато-телеангиэктатический, папуло-пустулезный, фиматозный; офтальморозацеа [3].
Лечение пациентов с розацеа зависит от подпита и выраженности клинических симптомов. Так, при эритемато-телеангиэктатическом подпите применяют высокоселективный агонист α2-адренергических рецепторов бримонидина тартрат; неодимовый лазер (длина волны Nd: YAG, 1064 нм), широкополосный импульсный свет (IPL c длиной волны 500–1200 нм и максимумом эмиссии в диапазоне 530–700 нм); лазер на красителе (PDL, импульсный лазер на красителе, 585–595 нм); калий-титанил-фосфатный лазер с удвоенной частотой (532 нм) [11, 12]. Лечение папулопустулезной розацеа проводится топическими препаратами (метронидазол, ивермиктин, азелаиновая кислота), антимикробными препаратами (доксициклин, орнидазол, метронидазол); низкими дозами изотретиноина; фотодинамической терапией, а также использованием лазерных технологий [2, 11, 12].
Несмотря на обилие средств и методов терапии, проблема лечения пациентов папулопустулезной розацеа сохраняет свою актуальность. С практической точки зрения представляется целесообразным комбинация лечения пациентов с данным подтипом заболевания с помощью сосудистого лазера и фотодинамической терапии. В доступной литературе мы не нашли публикаций о совместном применении данных аппаратных методов в лечении пациентов с таким заболеванием.
Цель работы: оценка эффективности и безопасности комбинированного лечения пациентов с папулопустулезным подтипом розацеа с использованием неодимового лазера и фотодинамической терапии.
Методы
Под нашим наблюдением находились 35 пациентов с розацеа, из них женщин 24 (68,6%), мужчин 11 (31,4%). Возраст пациентов составил от 23 до 57 лет (средний возраст – 36,1±2,5). Длительность заболевания – от 1 года до 15 лет.
Критерии включения: возраст 18 лет и старше, наличие папулопустулезного подтипа розацеа, подписание информированного согласия на участие в исследовании.
Критерии невключения: наличие злокачественного образования, эпилепсии, туберкулеза, сахарного диабета, порфирии, диффузных заболеваний соединительной ткани, недостаточности кровообращения IIБ–III ст., фотодерматозов, аллергии к компонентам фотосенсибилизатора.
Все пациенты получали терапию розацеа с использованием топического метронидазола 1% 1 раз в сутки и щадящий уход (бережное очищение, увлажнение кожи с использованием средств Cetaphil PRO, утро, вечер).
Участники исследования были рандомизированы случайным образом в две группы. Пациенты I группы (20 человек) получали стандартную топическую терапию и уход за кожей. Пациенты II группы (15 человек) последовательно получали 2 процедуры лазеротерапии с использованием неодимового лазера DEKA Motus AY (производитель – DEKA, Италия) на 1-й, 14-й дни лечения, далее сеансы фотодинамической терапии REVIXAN (на аппарате DUO LIGHT MIDI) c фотосенсибилизатором хлорин Е6 1 раз в неделю (на курс – 5 процедур).
Процедуру на аппарате Deka Motus AY выполняли методом «кисточки» с помощью насадки Nd:YAG 5 мм, длительность импульса – 0,7, частота – 3, флюенс – 24 (1 процедура), 27 (2 процедура). Фотодинамическую терапию Revixan проводили по следующей схеме: длина волны – 660 нм, плотность мощности – 80 мВт/см₂ в течение 10 минут, затем переключали на длину волны 400 нм, плотность мощности – 20 мВт/см₂ в течение 10 минут (1–2 процедуры), длина волны – 660 нм, плотность мощности 100 мВт/см₂ в течение 20 минут (3 процедуры), затем с 4-й по 5-ю процедуру, длина волны – 660 нм, плотность мощности – 120 мВт/см₂ в течение 20 минут. Перед процедурами светолечения на кожу наносили гель Revixan Derma под пленку (экспозиция – 20 минут).
До лечения, а также еженедельно начиная с 14-го дня наблюдения проводили:
1) подсчет числа воспалительных элементов сыпи (папулы, пустулы);
2) оценку эффективности терапии розацеа по шкале IGA (cм. таблицу) [13];
3) оценку побочных эффектов терапии.

Результаты
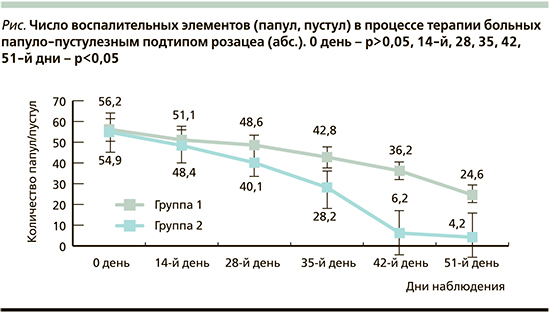
У пациентов обеих групп в процессе проводимого лечения констатировали снижение числа воспалительных элементов. Однако у лиц II группы динамика уменьшения числа папул и пустул была более отчетливой и наступала в более ранние сроки (см. рисунок). При этом обращает на себя внимание, что уже на 14-й день наблюдения (после 2 сеансов неодимового лазера) различия в числе элементов сыпи уже были статистически достоверными (р<0,05). По мере проведения курса процедур фотодинамической терапии различия в числе воспалительных элементов в группах наблюдения становились более выраженными. Наиболее значительные статистически достоверные различия в числе папул и пустул у пациентов обеих групп отмечались на 51-й день наблюдения, при этом в группе II, последовательно получавшей процедуры неодимового лазера и фотодинамической терапии, число сохранявшихся элементов сыпи было на 83% меньше, чем в группе I.
Одновременно была проведена оценка эффективности терапии наблюдавшихся лиц с розацеа с помощью индекса IGA. На 51-й день наблюдения в группе I, получавшей топическую терапию, значений индекса IGA 0/1 констатировали лишь у 2 (10%) участников исследования. В группе II, получавшей комбинированную терапию с использованием неодимового лазера и фотодинамической терапии, значений индекса IGA 0/1 на 42-й день лечения достигли 10 (66,7%) пациентов, на 51-й –12 (80%). Именно значения IGA 0/1 считаются успешным результатом лечения розацеа [15].
Заключение
Таким образом, применение аппаратных методов терапии розацеа существенно улучшают результаты терапии данного заболевания у пациентов в виде значительного уменьшения выраженности центрофациальной перманентной эритемы, числа и размера воспалительных папул и пустул. Вероятно, это связано с мощным действием неодимового лазера в отношении патологического ангиогенеза в коже, противовоспалительного и антибактериального действий фотодинамической терапии.
В группе I системных и местных побочных эффектов терапии не отмечено. У 4 (26,6%) пациентов группы II отмечались сухость и чувство стягивания кожи в течение первых 24 часов после сеансов фотодинамической терапии. Данные эффекты не требовали отмены терапии, назначения дополнительного лечения и купировались увлажняющими уходовыми средствами. Последовательное применение неодимового лазера и фотодинамической терапии высокоэффективно для пациентов с папуло-пустулезным подтипом розацеа. Метод позволяет значительно улучшать результаты терапии (по сравнению с применением топических средств на основе метронидазола), уменьшать ключевые проявления заболевания (выраженность фоновой центрофациальной эритемы, число и размеры воспалительных папул и пустул).
Вклад авторов. Концепция и дизайн исследования; написание текста; редактирование – А.Л. Бакулев. Сбор и обработка материала; статистическая обработка данных; написание текста – М.В. Бакулева.
Финансирование: рукопись подготовлена и опубликована за счет финансирования по месту работы авторов



