Сахарный диабет 2 типа (СД2) – наиболее распространенное эндокринное заболевание, имеющее сегодня характер неинфекционной эпидемии. Хорошо известно, что более 80% пациентов с СД2 имеют ожирение различной степени выраженности [1]. Одновременное наличие этих двух состояний вызывает выраженный гормональный дисбаланс и дисрегуляцию углеводного и жирового обменов. В большинстве проспективных исследований показано, что увеличение массы тела влияет на уровень артериального давления, приводит к отклонению клинико-биохимических параметров систем транспорта липидов, повышению уровня триглицеридов (ТГ) и снижению уровня липопротеидов высокой плотности (ЛПВП), а также к нарушению опосредованной инсулином утилизации глюкозы тканями, т.е. участвует в процессе развития атеросклероза и связанных с ним заболеваний [2]. Являясь синергичными факторами, ожирение и диабет повышают сердечно-сосудистый риск и уровень смертности при СД2. Также ожирение является неблагоприятным фактором риска некоторых злокачественных новообразований и повышает смертность от онкологических заболеваний. Кроме того, хорошо известно, что даже умеренное снижение массы тела (≥5% от исходной массы тела) может улучшать эффекты инсулина, снижать уровень гликемии натощак, уменьшать потребность в сахароснижающих препаратах (ССП) и снижать сердечно-сосудистый риск [3].
Жировая ткань – уникальный орган, секретирующий большое количество биологически активных пептидов – адипоцитокинов, которые оказывают как местное (аутокринное/паракринное), так и системное действия. Общее количество секретируемых жировой тканью адипоцитокинов может оказывать воздействие на все звенья гомеостаза. Некоторые адипоцитокины могут влиять на чувствительность к инсулину, метаболизм глюкозы, воспаление и атеросклероз, а также обеспечивать на молекулярном уровне взаимосвязь СД2 с ожирением, метаболическим синдромом и сердечно-сосудистой патологией. Увеличение массы жировой ткани сопровождается нарушением регуляции секреции и изменением уровня адипоцитокинов.
Наиболее изученным адипоцитокином является лептин. Содержание лептина в крови коррелирует с массой тела, поэтому, чем больше масса жировой ткани, тем больше она секретирует гормона в кровяное русло [4]. В настоящее время лептину отводится ведущая роль в регуляции процесса отложения жира в жировой ткани и развитии ожирения. Через активацию специфических лептиновых рецепторов в гипоталамусе лептин подавляет синтез нейропептида Y (NPY – Neuropeptide Y), что приводит к снижению аппетита и уменьшению потребления пищи, повышению тонуса симпатической нервной системы, увеличению расхода энергии, а также к изменению обмена веществ в периферических органах и тканях [5]. В печени лептин может тормозить действие инсулина на глюконеогенез. Имеются данные о том, что лептин способен повышать поглощение глюкозы миоцитами и жировыми клетками [6], снижать содержание ТГ в печени, скелетных мышцах и поджелудочной железе.
При ожирении лептин теряет свои регулирующие свойства. Нарушается перенос гормона транспортными системами, чувствительность тканей к лептину, развивается лептинорезистентность. При этом наблюдается повышение уровня лептина более 30 нг/мл. Избыток лептина ведет к повышению уровня свободных жирных кислот (СЖК), подавлению секреции инсулина и ингибированию его действия на гепатоциты и миоциты, развитию и усилению инсулинорезистентности инсулинзависимых тканей и липотоксичности.
Другой гормон, секретируемый белой жировой тканью, адипонектин, который уменьшает инсулинорезистентность, снижает поступление СЖК в печень и стимулирует их окисление, способствует снижению продукции глюкозы печенью, а также синтеза ТГ и липопротеидов очень низкой плотности (ЛПОНП) [7, 8]. За счет окисления липидов индуцируется глюкозозависимая стимуляция секреции инсулина [7, 8]. Обсуждается также PPARγ-(Peroxisome proliferator-activated receptor γ)-зависимое влияние адипонектина на синтез и секрецию инсулина и пролиферацию β-клеток, за счет активации мРНК [9]. В мышечной ткани адипонектин стимулирует окисление СЖК, уменьшает интрамиоцеллюлярные накопления липидов и улучшает чувствительность мышечной ткани к инсулину [10]. На уровне жировой ткани адипонектин тормозит дифференцировку преадипоцитов, липолиз, что подтверждает его возможное влияние на регуляцию метаболизма в жировой ткани [11].
Уровень адипонектина в плазме крови обратно пропорционален массе жировой ткани и отношению объема талии к объему бедер (ОТ/ОБ). При СД2 и ожирении уровень адипонектина и чувствительность к нему мышечной и жировой ткани снижены [10–12].
Другим важным гормоном, регулирующим аппетит и участвующим в формировании чувства насыщения и потреблении энергии, является глюкагоноподобный пептид-1 (ГПП-1). Эндогенный ГПП-1 продуцируется L-клетками подвздошной кишки после приема пища (в ответ на стимуляцию макронутриентами), а также группой нейронов в области мозгового ствола, которые принимают импульсы от блуждающего нерва. Воздействуя на β-клетки поджелудочной железы, эндогенный ГПП-1, потенцирует глюкозозависимую секрецию инсулина (инкретиновый эффект) [13, 14]. Доказано, что до 70% секреции инсулина в постпрандиальном периоде обеспечивается именно ГПП-1 [15]. Помимо стимулирующего эффекта на секрецию инсулина ГПП-1 стимулирует биосинтез инсулина клеточными линиями островковых клеток in vitro [14].
Кроме поджелудочной железы, ГПП-1 воздействует на ряд других органов и тканей, где имеются рецепторы к ГПП-1. Это клетки кишечника, желудка, почек, сердца, легких, периферической и центральной нервной системы, α-клетки поджелудочной железы. Кроме этого рецепторы к ГПП-1 обнаружены на адипоцитах и гепатоцитах, нейронах портальной вены [16].

ГПП-1 способствует увеличению транспорта глюкозы и инсулин-опосредованному поглощению глюкозы адипоцитами и гладкомышечными клетками [17]. За счет стимуляции рецепторов ГПП-1 в подвздошной кишке повышается вагусная иннервация, что вызывает замедление моторики желудочно-кишечного тракта и скорости эвакуации пищи из желудка, а также способствует снижению аппетита [18–20]. Регуляция пищевого поведения осуществляется и на уровне ядер гипоталамуса, где также присутствуют рецепторы ГПП-1, стимуляция которых снижает аппетит [18]. Важно подчеркнуть, что в области гипоталамических ядер и area postrema отсутствует гематоэнцефалический барьер, что позволяет ГПП-1 достигать этих областей из циркуляторного русла. Исследования показали, что введение ГПП-1 непосредственно в желудочки мозга грызунов приводит к дозозависимому снижению потребления пищи [21]. Интравентрикулярное введение антагонистов ГПП-1, напротив, повышает потребление пищи, что приводит к увеличению массы тела.
Имеются данные, свидетельствующие о том, что ГПП-1 может также играть роль в формировании чувства насыщения после приема пищи. Клетки мозгового ствола, продуцирующие ГПП-1, используют его как нейротрансмиттер в процессах регуляции приема пищи. Установлено, что прием пищи может активировать эти нейроны и что высвобождение ГПП-1 в головном мозге приводит к уменьшению объема съеденной пищи [18]. В эксперименте было показано, что при предварительном введении крысам даже низких доз ГПП-1 анорексигенный эффект лептина увеличивался [22]. Также было продемонстрировано, что снижение уровня лептина повышает анорексигенное действие ГПП-1 [23]. Напротив, высокий уровень лептина в условиях лептинорезистентности вызывает снижение активности ГПП-1 и не способствует уменьшению объема потребляемой пищи.
Кроме того, вызывая глюкозозависимую супрессию глюкагона, ГПП-1 влияет на резистентность к инсулину на уровне печени [18]. Также известно, что ГПП-1 модулирует липидный спектр крови. Имеется тенденция к снижению уровня холестерина, липопротеидов низкой плотности, повышению уровня ЛПВП и значительному снижению уровня ТГ как натощак, так и в постпрандиальном периоде [24].
Доказано, что как при СД2, так и при ожирении концентрация ГПП-1 резко снижена [25], а чувствительность β-клеток к нему нарушена, но может полностью восстанавливаться при введении экзогенного ГПП-1 в концентрациях, превышающих физиологическую в 4–5 раз [26].
Принимая во внимание сложные патофизиологические связи между инсулинорезистентностью, нарушениями гликемического контроля, ожирением, дислипидемией, артериальной гипертензией и атеросклерозом, особое значение приобретает способность ССП не только обеспечивать контроль гликемии, но и влиять на развитие и прогрессирование сосудистых осложнений и частоту развития инфаркта миокарда и инсульта у больных СД2. Кроме того, при выборе оптимальной стратегии лечения СД2 у лиц с избыточной массой тела или ожирением необходимо помнить, что применение большинства пероральных ССП и инсулинотерапии обеспечивает улучшение контроля гликемии, однако во многих случаях приводит к дальнейшему увеличению массы тела пациентов. В свою очередь снижение выраженности висцерального ожирения и восстановление чувствительности периферических тканей к действию инсулина могут быть решающими факторами в лечении СД2.
В настоящее время терапевтический эффект ГПП-1 доказан в многочисленных исследованиях. По сравнению с другими ССП терапия на основе ГПП-1 имеет существенные преимущества. Так, создавая фармакологическую концентрацию ГПП-1 у пациентов с СД2, агонисты рецепторов ГПП-1 – относительно новый класс ССП – не только способствуют улучшению гомеостаза глюкозы, но и приводят к снижению массы тела.
В настоящее время в терапии СД2 используют агонисты рецепторов ГПП-1 короткого действия – производные эксендина-4 (эксенатид, ликсисенатид) и длительного действия – лираглутид.
Лираглутид (Виктоза®; Novo Nordisk, Дания) – аналог человеческого ГПП-1 с 97%-ной гомологичностью человеческому ГПП-1 – единственный доступный сегодня для клинического применения при лечении СД2 агонист ГПП-1 длительного действия. В настоящее время эффективность и безопасность лираглутида при СД2 доказана более чем в 40 клинических исследованиях, результаты которых опубликованы в международных и национальных научных журналах, а также данными мета-анализов рандомизированных клинических исследований [27].
В программе клинических исследований LEAD лираглутид как в монотерапии, так и в комбинации с другими ССП хорошо переносился, способствовал клинически и статистически значимому, выраженному улучшению гликемического контроля (снижение HbA1c в среднем на 1,4%, от 50 до 70% пациентов достигла уровня HbA1c<7,0%) при низком риске гипогликемий, а также ассоциировался со снижением систолического артериального давления, улучшением липидного спектра крови (снижение уровня и СЖК, а также повышение уровня холестерина липопротеидов низкой плотности – ЛПНП) и снижением массы тела (на 1,8–3,4 кг) преимущественно за счет уменьшения количества висцеральной жировой ткани (на 13–17%), а выраженность снижения массы веса коррелировала с исходным индексом массы тела – ИМТ [28–34].
Согласно результатам мета-анализа 7 рандомизированных контролируемых исследований 3-й фазы по сравнению с препаратами сравнения число пациентов, добившихся снижения массы тела на лираглутиде, было больше по сравнению с приемом как плацебо, так и других ССП (ситаглиптин, производные сульфонилмочевины, тиазолидиндион, базальный аналог инсулина) (см. рисунок) [27]. Более того, хотя в прямом сравнительном исследовании лираглутида с эксенатидом прием обоих агонистов ГПП-1 в течение 26 недель способствовал сопоставимому снижению веса, однако число пациентов, достигших снижения веса на ≥5% и ≥10%, было выше в группе лираглутида [28], а перевод пациентов, ранее получавших эксенатид, на лираглутид способствовал дополнительному значимому снижению веса [35].
Результаты японского исследования также продемонстрировали преимущества использования лираглутида в комплексной терапии СД2 у лиц с ожирением, где кратковременное применение лираглутида (в течение 20 недель) привело к существенному улучшению контроля гликемии, а также ассоциировалось со значимым уменьшением выраженности висцерального ожирения: масса тела уменьшилась на 4,2 кг, ИМТ – на 0,93±0,12 кг/м2, ОТ – на 4,28±0,55 см (р<0,05) [36].
Целью настоящего анализа было оценить в амбулаторной практике эффективность трехкомпонентной терапии, одним из компонентов которой являлся лираглутид (Виктоза®), на показатели углеводного обмена, массу тела и выраженность нарушений адипоцитокинов у пациентов с СД2 в комбинации с ожирением, проживающих в Москве.
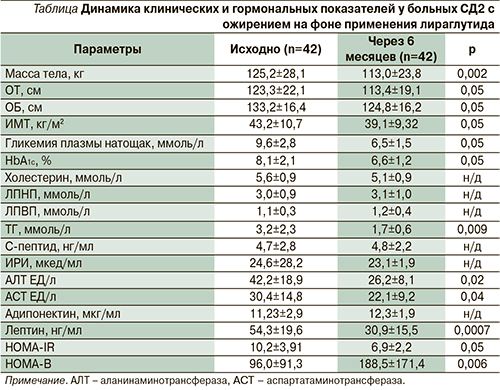
Были проанализированы амбулаторные карты 42 пациентов (15 мужчин и 27 женщин) с СД2 и ожирением, не достигших адекватного контроля гликемии на ранее проводимой терапии, которым в период с 01.01.2011 по 31.12.2013 в условиях амбулаторной практики с целью улучшения гликемического контроля к ранее применяемой терапии двумя пероральными сахароснижающими препаратами – препарат сульфонилмочевины в комбинации с метформином в среднетерапевтических или максимальных дозах – был добавлен лираглутид (Виктоза®). Длительность анализируемого периода составила 6 месяцев. У всех больных имелась неалкогольная жировая болезнь печени (НЖБП), гипертриглицеридемия, лептинорезистентность (см. таблицу). Средний возраст больных составил 59,9±4,9 года (53–71 год), средняя продолжительность СД2 – 6,1±5,5 года (2–19 лет). Все больные, включенные в анализ, имели признаки выраженного висцерального ожирения: средняя масса тела – 125,2±28,1 кг (89–172 кг), средний ИМТ – 43,2±10,7 кг/м2 (31–50 кг/м2), средний объем талии (ОТ) – 123,3±22,1 см (95–155 см), средний объем бедер (ОБ) – 133,2±16,4 см (109–160 см).
Лираглутид назначали 1 раз в сутки подкожно, согласно принятым рекомендациям, в начальной дозе 0,6 мг/сут с последующим титрованием через 1 неделю до 1,2 мг/сут. При необходимости (для улучшения контроля гликемии) дозу увеличивали до 1,8 мг/сут. Всем пациентам было рекомендовано уменьшить калорийность дневного рациона до 1600 ккалл в сутки.
В качестве цели лечения использовали достижение уровня гликозилированного гемоглобина (НbА1с) ≤7,0%.
Для оценки эффективности проводимой терапии исследовали уровень HbA1c с использованием анализатора HbA1c D10TM (Био-Рад). Уровень общего холестерина, холестерина ЛПВП, холестерина ЛПНП, ТГ, гликемию натощак исследовали с использованием биохимического анализатора Konelab 60i. Исследование иммунореактивного инсулина (ИРИ) и С-пептида проводили иммуноэлектрохемилюминесцентным методом с помощью наборов «Elecsys 2010» (Германия). Для оценки секреторной активности адипоцитов определяли уровни лептина и адипонектина. Исследование лептина проводили иммуноферментным методом с помощью наборов «Diagnostics Biochem Canada Inc» (Канада), уровня адипонектина – с помощью набора «BioVendor» (Чехия). Уровень инсулинорезистентности оценивали с помощью индекса HOMA-IR (Homeostasis Model Assesment), функциональную активность в-клеток – на основании индекса HOMA-B.
Статистическая обработка выполнена с помощью программы Excel 2010 (Microsoft), Statistica 8.0 (StatSoft, Inc.), исследуемые показатели приведены в виде M±m (среднее и стандартное отклонения), для сравнения использовали критерий уровня значимости (p), равный 0,05.
Через 6 месяцев терапии лираглутидом в анализируемой группе пациентов наблюдалось клинически и статистически значимое улучшение контроля гликемии, что проявлялось снижением уровня НbА1с на 1,5%, ГН – на 3,1 (р<0,05). Учитывая улучшение контроля гликемии и для снижения риска гипогликемий, некоторым пациентам (30%) были отменены препараты сульфонилмочевины, у остальных – доза сульфонилмочевины не изменялась.
Важным показателем эффективности терапии, особенно у пациентов с СД2 в сочетании с ожирением, было снижение массы тела в среднем на 12,2 кг (р<0,0001), ИМТ – на 4,1 кг/м2 (р<0,05), уменьшение ОТ – на 9,9 см (р<0,05), ОБ – на 8,4 см (р<0,05), что свидетельствует об уменьшении объема именно висцерального жира. Необходимо отметить, что наиболее выраженное снижение массы тела наблюдалось в первые три месяца терапии. У 74% пациентов снижение массы тела составило более 7 кг. При этом к концу второго месяца терапии большинство пациентов отмечали значительное снижение аппетита. Необходимо отметить, что у большинства (76%) пациентов эффективной в отношении достижения целевого уровня HbA1c и снижения массы тела была доза лираглутида 1,2 мг/сут. Лишь у 10 (24%) пациентов к концу 2-го месяца с целью улучшения контроля гликемии доза лираглутида была увеличена до 1,8 мг/сут.
При оценке динамики уровня адипоцитокинов было выявлено достоверное уменьшение уровня лептина – на 23,4 нг/мл (на 45% от исходного уровня, р<0,007), что свидетельствует о значительном уменьшение лептинорезистентности. Такое значимое снижение уровня лептина может быть связано как со снижением массы тела, так и, возможно, с центральными механизмами действия лираглутида.
В то же время изменения уровня адипонектина в анализируемой группе не наблюдалось.
Добавление к терапии лираглутида привело к улучшению липидного спектра крови: уровень ТГ в сыворотке крови снизился в среднем на 1,49 ммоль/л (р<0,009), что может свидетельствовать об уменьшении липотоксичности. При этом важно отметить, что улучшение липидного профиля крови не ассоциировалось с терапией гиполипидемическими препаратами, коррекция которой во время исследования не проводилась. Также терапия лираглутидом сопровождалась достоверным снижением уровня АЛТ (снижение на 16,02 ЕД/л, р<0,02) и АСТ (снижение на 8,32 ЕД/л, р<0,04) – маркеров липотоксичности и НЖБП, патогенез которой тесно связан с резистентностью к инсулину.
Кроме того, терапия лираглутидом ассоциировалась с существенным снижением индекса инсулинорезистентности HOMA-IR – на 3,31 (р<0,05) и повышением функциональной активности β-клеток (HOMA-B) на 154% (р<0,001).
Обсуждается роль диспепсических нежелательных эффектов терапии агонистами рецепторов ГПП-1 в снижении массы тела. В данном исследовании терапия лираглутидом хорошо переносилась и редко вызывала развитие побочных эффектов со стороны желудочно-кишечного тракта. Лишь у 4 пациентов в течение первых 2 недель применения лираглутида наблюдалась легкая тошнота, которая не требовала коррекции терапии, не влияла на приверженность пациентов лечению и прошла самостоятельно.
Таким образом, лираглутид является высокоэффективным ССП, применение которого связано с выраженным снижением массы тела и уменьшением выраженности висцерального ожирения, а также оказывает позитивное воздействие на другие патогенетические механизмы развития СД2. Снижение и нормализация уровня лептина, наблюдаемая на фоне терапии лираглутидом, может приводить к снижению инсулинорезистентности инсулинозависимых тканей, лептинрезистентности и липотоксичности. Хотя точные механизмы, с помощью которых агонисты ГПП-1 (в частности, лираглутид) вызывают снижение массы тела, до сих пор не выяснены, считается, что они уменьшают аппетит и снижают потребление калорий, в основном за счет повышения чувства насыщения [37]. Как показывают результаты ранее опубликованных исследований и данного анализа, очевидно, что замедленное опорожнение желудка – основная причина нежелательных диспепсических явлений при лечении агонистами рецепторов к ГПП-1, скорее всего, не оказывает значимого влияния на динамику массы тела.
Использование лираглутида при лечении СД2 у лиц с ожирением является простым и эффективным вариантом терапии для управления диабетом, уменьшения выраженности ожирения и связанных с ним патологических нарушений, а также может помочь преодолеть резистентность к ранее применяемой сахароснижающей терапии и улучшить сердечно-сосудистый прогноз у данной категории больных.



