Эверолимус (Афинитор) является ингибитором mTOR. Внутриклеточный сигнальный путь PI3K/AKT/mTOR, регулирующий выживание, рост и пролиферацию, метаболизм и ангиогенез опухолевой клетки, – один из основных опухолевого развития или канцерогенеза. Кроме того, активация пути mTOR наблюдается при генетических онкологических (болезнь фон Гиппеля–Линдау, нейрофиброматоз I типа) и других (туберозный склероз) синдромах.
Внутриклеточные взаимодействия чрезвычайно многообразны. Однако некоторые механизмы этих взаимодействий между различными органами-мишенями уже известны и, более того, используются в клинической практике для комбинации таргетных препаратов.
Примером таких комбинаций считается применение эверолимуса в сочетании с гормонотерапией (ГТ) с целью восстановления чувствительности к последней при диссеминированном раке молочной железы (РМЖ) или с октреотидом при нейроэндокринных опухолях (НЭО).
По механизму действия эверолимус потенциально может быть эффективным при ряде опухолей; первым показанием к его клиническому использованию стал почечноклеточный рак (ПКР). Препарат входит в клинические рекомендации в качестве средства 2-й линии терапии при прогрессировании заболевания после терапии ингибиторами тирозинкиназ (сунитиниб, сорафениб, пазопаниб).
Наиболее полно эверолимус изучен при НЭО, при которых проведено три рандомизированных клинических исследования RADIANT.
В предварительном исследовании II фазы была показана эффективность комбинации эверолимуса с октреотидом при НЭО поджелудочной железы (ПЖ), и в первом рандомизированном сравнительном исследовании (RADIANT-1) была установлена более высокая, чем одного эверолимуса, эффективность комбинации: контроль роста опухоли – 84,4 против 77 %, медиана выживаемости без прогрессирования (МВБП) – 16,7 против 9,7 месяца [1].
В рамках III фазы было проведено еще два исследования. Одно из них – RADIANT-2, двойное слепое плацебо контролируемое исследование, сравнивавшее комбинацию эверолимус + октреотид (Э + О) с плацебо в сочетании с октреотидом (Р + О) для пациентов с секретирующими опухолями. Характеристика больных представлена в табл. 1.
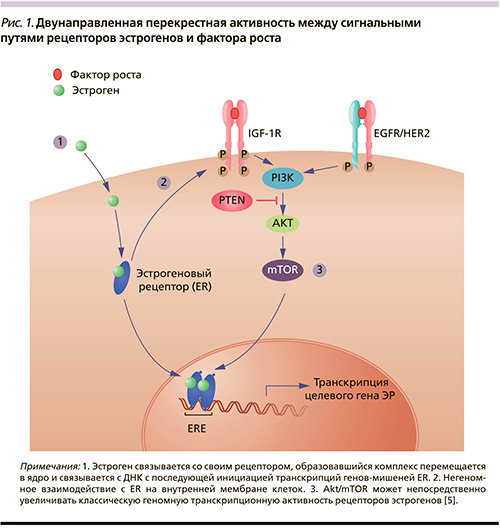
Основной целью исследования стала оценка ВБП. По данным централизованного анализа, медиана оказалась выше в группе с эверолимусом (16,4 против 11,3 месяца; р = 0,026). Пороговое значение показателя «р» по дизайну исследования должно было составить 0,0246. По данным исследователей, результаты были несколько другими: МВБП Э + О – 12,0 месяцев, П + О – 8,6 месяца (р = 0,018).
В связи с этим независимый комитет еще раз рассмотрел результаты и пришел к окончательному выводу о достоверном улучшении МВБП на 5,1 месяца при лечении комбинацией Э + О пациентов с НЭО с секреторной активностью (табл. 2) [2].
В исследовании это преимущество было подтверждено при подгрупповом анализе, также было показано улучшение контроля уровня 5-гидроксииндолуксусной кислоты, что является предпосылкой к предотвращению развития «карциноидного» сердца.
Подгруппа НЭО легких включила 44 из 429 больных, т.е. приблизительно 10 %. МВБП составила 13,6 против 5,5 месяцев в пользу комбинации Э + О. Отношение рисков (ОР) составило 0,72. В связи с этим указанная комбинация зарегистрирована в качестве лечебной для больных НЭО ПЖ и легких в Российской Федерации.
В исследовании RADIANT-3 сравнивали наилучшее для больных НЭО ПЖ низкой или умеренной степени злокачественности (Gr1 и Gr2), поддерживающее лечение (НПЛ), + эверолимус и НПЛ + плацебо. МВБП для эверолимуса составила 11 месяцев, для плацебо – 4,6 (р < 0,0001). Время лечения составило 8,79 месяца в группе эверолимуса и 3,70 – в группе плацебо; при прогрессировании 148 больных группы плацебо перешли в группу эверолимуса. При этом 18-месячная выживаемость в группе эверолимуса составила 57,3 %, двугодичная – 34,2. Наиболее частыми побочными явлениями при применении эверолимуса были стоматит (64 %), сыпь (49 %), диарея (34 %), утомляемость (31 %), инфекции (23 %).
Таким образом, программа исследований RADIANT, включившая 999 больных, показала эффективность эверолимуса в монотерапии НЭО ПЖ и в комбинации с октреотидом при секретирующих НЭО.
В отделении химиотерапии ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН имеется опыт применения эверолимуса к 21 больному, у 11 из которых были НЭО ПЖ. Опухолями Gr2 страдали 11 больных, 18 – метастазами в печень. Ранее 9 больным проведены циторедуктивные операции, 19 пациентов получали эверолимус в качестве 2-й линии терапии. Частичный эффект был отмечен у 1 (5 %) больного, стабилизация – у 14 (67 %). Таким образом, контроль роста опухоли был достигнут в 72 % случаев. МВБП составила 4,3 месяца. Нами было отмечено, что лучшие отдаленные результаты имели место в группе больных, к которым эверолимус применяли в качестве 1–2-й линий лечения: МВБП – 6,9 против 3,4 месяца при больших значениях числа линий.
Третья опухоль, при которой эверолимус разрешен к клиническому применению, – РМЖ. Наиболее частые мутации при РМЖ возникают именно в PI3K/AKT/mTOR-сигнальном пути [3].
Эверолимус был изучен при гормоночувствительном РМЖ с резистентностью к ранее применявшейся ГТ. Такая резистентность возникает у 25 % больных с наличием рецепторов эстрогенов (ER+) и прогестерона и у 50 % пациентов с другими характе-ристиками.
Ответ на первую линию ГТ отсутствует приблизительно у 50 % больных ER+-метастатическим РМЖ (мМРЖ), что указывает на первичную резистентность. В конечном итоге у оставшихся пациентов, несмотря на первоначальный ответ, происходит прогрессирование. Данный процесс называется приобретенной резистентностью.
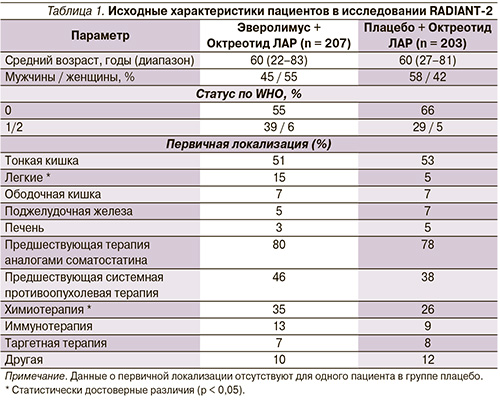
Важным компонентом резистентности считается сигнальная активность фактора роста. Активация перекрестной активности может происходить между сигнальными путями ER, IGFR и EGFR/HER2. Активация мембранных рецепторов этих факторов роста может приводить к стимуляции двух основных сигнальных каскадов внутриклеточных киназ: PI3K/AKT/mTOR и RAS/MAPK. По результатам доклинических исследований продемонстрирована перекрестная активность между сигнальными путями ER и mTOR (рис. 1).
Варианты лечения, при которых комбинируются гормональные и таргетные препараты, могут повышать эффективность терапии и предотвращать или отсрочивать появление эндокринной резистентности при РМЖ.
В рандомизированные клинические исследования эверолимуса при ER+-РМЖ включены исследования II фазы (летрозол ± Э и тамоксифен ± Э) и III фазы: BOLERO–2 (экземестан ± Э).
В исследовании II фазы было показано преимущество неоадъювантной терапии летрозол + Э (n = 138) по сравнению с летрозолом в сочетании с плацебо (n = 132) по объективному эффекту (ОЭ): 58 против 47 %; p = 0,035 (оценка по данным УЗИ). Редукция экспрессии Ki-67 (клеточный маркер пролиферации) наблюдалась среди 57 % больных, получавших эверолимус, и только среди 30 % – контрольной группы [5].
В исследовании BOLERO-2 была достигнута первичная цель – статистически достоверное улучшение МВБП до 6,9 месяца по сравнению с 2,8 в группе плацебо + экземестан (ОР = 0,45; р < 0,0001). Всего в исследование были включены 724 больных, в т.ч. в группу, получавшую эверолимус по 10 мг/сут и экземестан по 25 мг/сут (группа Э + Э), – 485 человек, в группу плацебо + экземестан – 239. Все пациентки находились в постменопаузе и имели ER+-, HER2-местнораспространенный или метастатический процесс с рецидивом или прогрессированием после применения летрозола или анастрозола.
У 84 % всех больных опухоли были гормоночувствительными.
Анализ ВБП был проведен при 18-месячном наблюдении, показавшем увеличение МВБП для группы с эверолимусом на 4,6 месяца (7,8 против 3,2; ОР = 0,45; р < 0,0001).
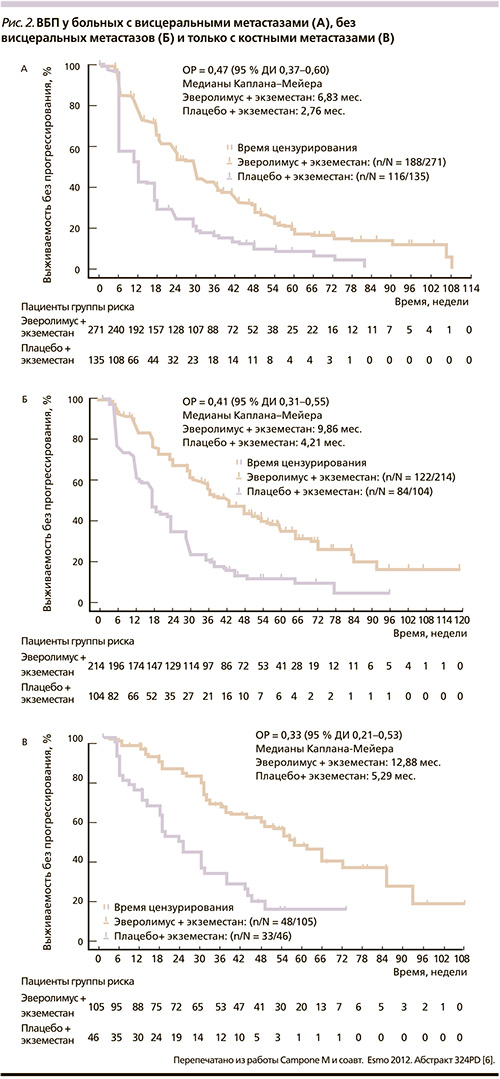
Преимущество эверолимуса сохранялось при раздельном анализе во всех подгруппах больных. Улучшение было достигнуто при наличии висцеральных метастазов, без них и у больных только с костными метастазами (рис. 2) [6].
Анализ результатов группы больных, получавших ранее химиотерапию, также показал значительное преимущество схемы Э +Э: МВБП составила 7,1 против 2,2 месяца при применении П + Э.
Вторичными целями исследования BOLERO-2 служила оценка общей выживаемости (ОВ), ОЭ, клинической эффективности (ОЭ + стабилизация болезни), качества жизни, безопасности и фармакокинетики.
Оценка качества жизни продемонстрировала более чем двукратное увеличение МВБП в группе Э + Э при хорошем физическом, эмоциональном и социальном статусе больных; время сохранения физической активности составило 15,2 месяца в группе Э + Э и 9,7 – в группе П + Э (р = 0,0211).
ОВ в исследовании BOLERO-2 оценивалась через 7, 12,5 и 18 месяцев [7–9]. В группах Э + Э и П + Э она в эти сроки составляла соответственно 89,3 против 87,0; 82,7 против 77,3 и 74,6 против 67,8 %. При медиане продолжительности наблюдения (03.10.2013) в группе Э + Э она составила 44,9 %, а в группе П + Э – 40,2 %. На лечении оставались еще 13 больных.
Медиана ОВ составила 30,98 месяца для Э + Э и 26,55 – для П + Э групп (ОР = 0,89; р = 0,14) [10].
При анализе последующего лечения оказалось, что в группе П + Э было на 10 % больше больных, получавших химиотерапию, в т.ч. винорелбин и таксаны.
Медиана времени от рандомизации до первой химиотерапии или смерти составила в группе Э + Э 11,86 месяца, в группе П + Э – 5,98. Не было отмечено новых токсических проявлений [10].
Таким образом, в исследовании BOLERO-2 не было обнаружено достоверных различий в ОВ между группами Э + Э и П + Э. Однако с учетом отчетливой тенденции к увеличению ОВ в группе Э + Э, возможно, необходим подгрупповой анализ этих результатов.
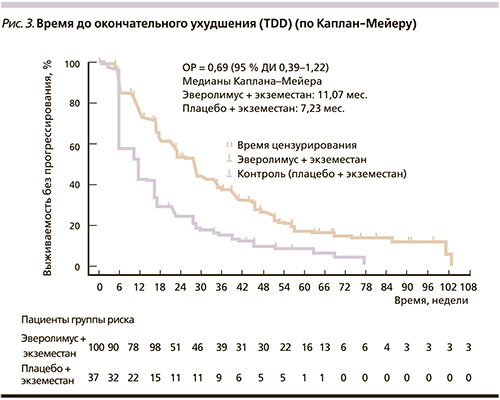
В 2014 г. опубликованы результаты выборочного анализа МВБП в подгруппе пациенток, получавших ранее летрозол или анастрозол в неоадъювантном режиме [11]. В данной подгруппе больных при HR+-, HER-РМЖ комбинация Э + Э вызвала почти трехкратное увеличение МВБП по сравнению с П + Э по локальной оценке (11,5 против 4,1 месяца), что было подтверждено централизованной оценкой (15,5 против 4,2 месяца).
Важно отметить сохранение хорошего качества жизни при применении комбинации Э + Э, несмотря на побочные эффекты эверолимуса. Время до окончательного ухудшения (TDD – time to definitive deterioration) по глобальной оценке здоровья было заметно продолжительней в группе с эверолимусом (11,1 против 7,2 месяца; рис. 3) [11].
Если сопоставить полученные результаты с возможностями любой другой ГТ после применения нестероидных ингибиторов ароматазы, результаты ее использования были менее впечатляющими: 3,7 месяца – фульвестрант + экземестан (EFECT); 4,4 – фульвестрант 250 мг + анастрозол, 4,8 – фульвестрант 250 мг и 3,4 месяца – экземестан (SOFEA); 6,5 месяцев – фульвестрант 500 мг и 5,5 – фульвестрант 250 мг (CONFIRM).
Исследования ГТ при РМЖ в комбинации с таргетными агентами пока достаточно ограничены. В исследовании HORIZON темсиролимус в сочетании с летрозолом не вызвал ожидаемого адекватного улучшения по сравнению с одним летрозолом, хотя 56 % больных в этом исследовании не получали предшествующей ГТ.
Таким образом, результаты представленного выше выборочного анализа данных исследования BOLERO-2 служат предпосылкой к использованию комбинации Э + Э в качестве 1-й линии лечения больных после неоадъювантной/адъювантной терапии нестероидными ингибиторами ароматазы.
В настоящее время проводится исследование BOLERO-4, в котором изучается комбинация эверолимуса с летрозолом в качестве 1-й линии терапии при HR+-, HER-мРМЖ. Инициирован также протокол по добавлению эверолимуса к адъювантной ГТ.
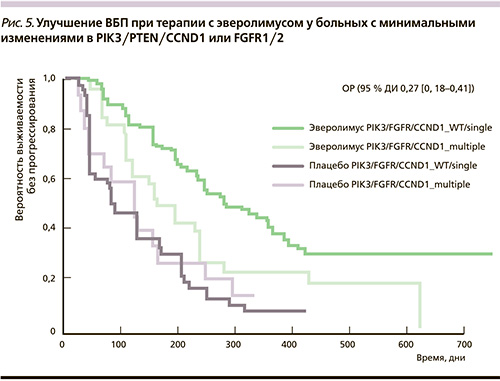
Также на основе данных BOLERO-2 было проведено изучение последовательностей экзонов и вариантов числа копий генов посредством секвенирования следующего поколения (NGS – Next–Generation Sequencing), что было проведено с использованием образцов опухолей от 227 из 724 больных. Было изучено 182 опухолево-родственных гена. Лечебная польза от Э + Э, превышающая пользу от одного экземестана, была подтверждена в отношении каждого из 9 генов с частотой мутаций < 10 % (например, PIK3CA, FGFR1, CCND). Было установлено, что 76 % больных с минимальными генетическими изменениями в PI3K-, FGFR- или CCND-сигнальных путях имеют наибольшую пользу от применения эверолимуса (ОР = 0,27 против 0,40 для полной популяции NGS). Этот подход может быть популярным в будущем [12].
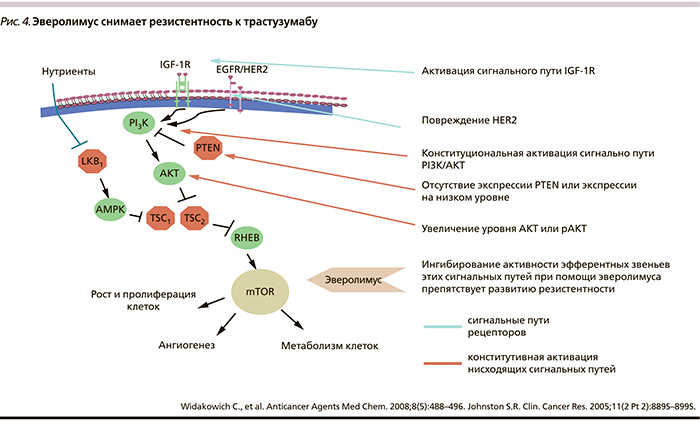
Другим направлением изучения эверолимуса при мРМЖ счиается его применение при возникновении резистентности к трастузумабу. С точки зрения механизма действия препарата имеются теоретические предпосылки эффективности эверолимуса в данной ситуации (рис. 4) [13].
В исследовании BOLERO-3 эверолимус по 5 мг в день в комбинации с винорелбином (В) 25 мг/м²/нед и трастузумабом (Т) 2 мг/кг/нед сравнивался с комбинацией плацебо + В + Т при местнораспространенном или мРМЖ после предшествующей терапии Т (100 %), таксанами (100 %), лапатинибом (28 % больных). Висцеральные метастазы были обнаружены в 76 % случаев. Первичной целью исследования была оценка ВБП: МВБП для Э + В + Т составила 7 месяцев, для П + В + Т = 5,78 (ОР = 0,78; р = 0,0067).
Таким образом, Э + В + Т является эффективной комбинацией, значительно удлиняющей ВБП при мРМЖ с 22 %-ным снижением риска прогрессирования или смерти, но пока она не одобрена. Видимо, необходимы дополнительные клинические исследования и поиск наиболее оптимальных характеристик опухолей с точки зрения достижения значительного выигрыша в эффекте. Пока же выделены группы, в которых добавление эверолимуса давало наименьший результат. Это больные с поражением печени (ОР = 0,90; 95 % ДИ – 0,68–1,18), пациентки, никогда не получавшие трастузумаб адъювантно (ОР = 0,92; 95 % ДИ – 0,71–1,18), и ER+ (ОР = 0,94; 95 % – ДИ 0,72–1,23).
При оценке ОЭ дополнительной достоверной выгоды от добавления эверолимуса отмечено не было: 40,8 против 37,3 %; контроль роста опухоли (ОЭ + стабилизация) – 59,2 против 53,3 %.
Улучшение ВБП было зарегистрировано среди больных с минимальными изменениями в PI3K, PTEN, CCND1 или FGFR1/2 (рис. 5).
Это дополнительное исследование подчеркивает значение вовлечения в процесс канцерогенеза двух или более ключевых сигнальных путей и их возможные взаимодействия.
В исследовании TAMRAD (тамоксифен + эверолимус против тамоксифена; n = 111) опухолевый маркерный анализ, проведенный 51 больному распространенным HR+ РМЖ, показал, что эффективность эверолимуса оказалась выше при низкой экспрессии PI3K и антионкогена LKB1 – опухолево-супрессорного гена печеночной В1/серин/треонин киназы. Наибольшая эффективность была отмечена при высокой экспрессии белка р4ЕВР1, характеризующего нисходящие эффекторные механизмы. Таким образом, активация mTOR сигнального пути служит лучшим предиктором эффективности эверолимуса. Это состояние характеризуется низкой экспрессией PIK3СА-генной сигнатуры, низкой LKB1 и высокой р4ЕВР1.
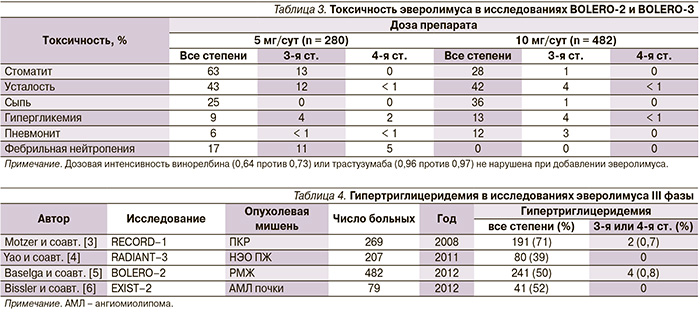
Основные побочные эффекты при применении эверолимуса – стоматит, усталость, сыпь, гипергликемия, инфекции. Сравнение специфической токсичности препарата при использовании в дозах 5 (BOLERO-3) и 10 мг/сут (BOLERO-2) перорально представлено в табл. 3.
Стоматит был более выраженным в BOLERO-3 – скорее всего за счет сочетания эверолимуса с химиотерапией винорелбином.
Описано также возникновение гипертриглицеридемии, отмеченной у многих получавших эверолимус больных в RECORD-1 (71 % при ПКР) и ряде других исследований (табл. 4) [14–17].
Имеются редкие описания возникновения на фоне применения эверолимуса острого панкреатита [18]. Кожная сыпь, по данным мета-анализа, включившего 2242 больных из 13 клинических исследований, возникла у 28,6 % пациентов, получавших препарат, в т.ч. у 1 % – тяжелой степени [19]. Для получающих эверолимус больных характерно также развитие мукозита, анемии, появление тошноты, но частота тяжелых случаев этих эффектов незначительна [20]. C учетом возможных инфекционных осложнений с осторожностью следует назначать препарат пожилым и ослабленным больным.
Таким образом, эверолимус представляет собой ингибитор серин-треонин-киназного участка PI3K/AKT-сигнального пути, критичного для клеточного роста и ангиогенеза. Препарат связывает внутриклеточный протеин, что ведет к торможению mTOR-киназной активности. Дополнительно он тормозит экспрессию гипоксии индуцирующего фактора и уменьшает экспрессию эпидермального фактора роста (EGFR).
Первоначально эверолимус был одобрен Комитетом по пищевым продуктам и лекарственным препаратам США (FDA) в 2009 г. в качестве средства 2-й линии лечения распространенного ПКР. Затем он был разрешен для лечения субэпендимальных гигантоклеточных астроцитом, ассоциированных с туберозным склерозом (2010), прогрессирующих НЭО ПЖ (2011), почечной ангиолипомиомы в составе комплекса поражений при туберозном склерозе.
Последним показанием к применению эверолимуса стал HR+-, HER2-мРМЖ, ранее леченный нестероидными ингибиторами ароматазы (2012). Также эверолимус продемонстрировал многообещающие результаты при трансплантации почек и сердца [21, 22].



