Введение
К одним из самых значимых факторов риска развития лекарственно-индуцированных заболеваний (ЛИЗ) относят наличие у пациента коморбидных заболеваний и вредных привычек [1].
Коморбидные заболевания
Некоторые заболевания, имеющиеся у пациента, могут в значительной степени изменять фармакокинетику и фармакодинамику лекарственных средств (ЛС) [1]. Прежде всего это заболевания почек и печени с нарушением их функций, сердечная недостаточность (СН), особенно тяжелая (III–IV функциональные классы – ФК по классификации Нью-Йоркской ассоциации сердца NYHA – The New York Heart Association,), ожирение [1].
Нарушение функции почек. Хрони-ческая болезнь почек (ХБП) – это повреждение почек (наличие ≥1 маркера повреждения почек, например альбуминурия/протеинурия, гематурия, цилиндрурия, лейкоцитурия, изменение электролитного состава мочи и ее удельного веса, трансплантация почки в анамнезе и т.д.) или снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2, существующее у пациента >3 месяцев, независимо от нозологии нефропатии [2]. В мире снижение СКФ отмечается не менее чем у 10% населения, в США распространенность ХБП составляет ~15%, в Российской Федерации снижение СКФ зарегистрировано у 16% пациентов, при этом распространенность данной патологии повышается до 26% в случае наличия у пациента сердечно-сосудистых заболеваний [2, 3].
Изменение функции почек влияет на фармакокинетику и фармакодинамику ЛС, что в свою очередь обусловливает повышение рисков фармакотерапии, т.к. почки являются одним из двух (второй – печень) основных органов, ответственных за выведение ЛС и их метаболитов из организма [1]. Однако число ЛС, которые выводятся из организма в неизмененном виде, невелико. Большинство ЛС являются высоколипофильными соединениями и не могут быть эффективно удалены из системного кровотока исключительно за счет почечной экскреции. Поэтому для их выведения необходим процесс биотрансформации с образованием полярных метаболитов, которые выводятся из организма с мочой через почки.
Нарушение функции почек не только изменяет (обычно снижает) экскрецию ЛС в неизмененном виде и/или его метаболитов, но и способствует изменениям в распределении, транспорте и биотрансформации ЛС, кроме того, влияет и на их фармакодинамику [4]. У пациентов с нарушением функции почек из-за снижения клубочковой фильтрации и/или канальцевой секреции снижается выведение гидрофильных препаратов, которые в основном выводятся в неизмененном виде через почки [5]. Поэтому у пациентов с заболеваниями почек риск развития ЛИЗ выше, чем у лиц с нормальной функцией почек [6, 7]. Риск развития нежелательных реакций (НР) в случае снижения функций почек повышается в случае приема таких препаратов, как, например, некоторые β-адреноблокаторы, диуретики, инсулин, ингибиторы ангиотензинпревращающего фермента (АПФ), ацетилсалициловая кислота, варфарин и клопидогрел [7]. Заболевания почек также могут влиять на риск развития ЛИЗ, изменяя всасывание, распределение и клиренс ЛС. Влияние заболеваний почек на всасывание ЛС может быть результатом изменения рН желудка, что может приводить к изменению биодоступности некоторых ЛС. Примерами препаратов с повышенной биодоступностью у пациентов с ХБП являются ингибиторы протеазы, иммунодепрессанты и эритромицин [5, 8, 9].
Протеинурия, которая является частым и патогномоничным симптомом при заболевании почек, обусловливает снижение концентрации сывороточного альбумина, что может способствовать увеличению свободной фракции ЛС, имеющих высокое сродство к белкам плазмы крови, потенциально приводя к усилению терапевтического эффекта и риска развития НР [10]. На метаболизм ЛС в печени также могут влиять существенное повышение концентрации паратиреоидных гормонов в сыворотке крови, которое имеет место у пациентов с ХБП, изменение экспрессии ферментов, участвующих в метаболизме фаз I и II. Примеры препаратов с печеночным метаболизмом, который нарушается вследствие заболевания почек, включают мидазолам, морфин и зидовудин [5].
Примером препаратов, клиренс которых изменяется при заболевании почек, может служить эноксапарин – антикоагулянт, широко применяемый в клинической практике для профилактики тромбоэмболических осложнений. В нескольких исследованиях эноксапарина на пациентах с различной степенью почечной недостаточности [11–13] показано, что его клиренс снижается пропорционально тяжести нарушения функции почек [11]. В результате пациентам с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин) рекомендуется снижение дозы эноксапарина. Кроме того, накопление в организме продуктов метаболизма мочевой кислоты у пациентов с хронической почечной недостаточностью может способствовать развитию нарушений свертывающей системы крови и увеличивать риски кровотечений, которые на фоне введения антикоагулянтов, например, во время процедуры гемодиализа повышаются еще в большей степени [12], этот факт был подтвержден результатами клинических исследований [13].
Нарушение функций печени. Нару-шение функций печени – нередкое явление в клинической практике. Оно может протекать как бессимптомно длительно, так и в форме острой печеночной недостаточности и фульминантного гепатита. К нарушениям функций относятся вирусные гепатиты, прием некоторых ЛС (лекарственное поражение печени), инфекционные и неинфекционные заболевания, протекающие с поражением печени (например, болезнь Вильсона–Вестфаля–Коновалова) и др. [14].
Печень играет важную роль в фармакокинетике большинства ЛС, поэтому снижение функций печени оказывает существенное влияние на фармакокинетические параметры. При печеночной недостаточности не только происходит снижение клиренса и элиминации ЛС, но и может нарушаться связывание ЛС с белками плазмы крови, изменяться процессы распределения и выведения [15]. Портосистемное шунтирование, которое применяется в лечении портальной гипертензии у пациентов с циррозом печени, может существенно снижать пресистемную элиминацию ЛС, тем самым увеличивая их абсорбцию. Также печень является основным органом метаболизма ЛС, а нарушение ее функций изменяет активность различных ферментов цитохрома Р-450 (CYP450) [1].
Так, метаболизм некоторых ЛС группы бензодиазепинов (например, мидазолам, диазепам), которые интенсивно метаболизируются в печени, у пациентов с нарушением функции печени снижается, что способствует аккумуляции данных ЛС, следовательно, к повышению рисков развития их НР (увеличение седативного действия, ухудшение течения печеночной энцефалопатии) и ЛИЗ [16]. У пациентов с нарушениями функции печени возможна аккумуляция морфина вследствие снижения клиренса и/или увеличения периода полувыведения. Поэтому для профилактики НР и ЛИЗ рекомендуется применять препарат в более низких дозах, а по мере прогрессирования заболевания и нарастания тяжести печеночной недостаточности – увеличивать интервал между введением препарата [17]. У пациентов с хронической печеночной недостаточностью отмечается снижение активности метаболизма парацетамола, одного из самых часто назначаемых ЛС, и увеличение периода его полувыведения, т.е. у пациентов с нарушением функции печени выявляются более высокие концентрации препарата в плазме крови по сравнению с людьми без нарушения функций печени, соответственно, имеет место увеличение риска развития НР и ЛИЗ [18].
Кроме того, у пациентов с циррозом печени часто встречается сопутствующее нарушение функций почек, что требует корректировки дозы ЛС с почечным путем выведения.
Сердечная недостаточность. СН – это прогрессирующее сердечно-сосудистое заболевание, которым страдают 1–2% населения развитых стран, ее наличие ассоциировано с высокой заболеваемостью и смертностью, кроме того, особенно у пожилых пациентов СН часто сочетается с другими сопутствующими заболеваниями, прежде всего с заболеваниями почек и печени с нарушением их функции, которые в свою очередь также могут влиять на фармакокинетику и фармакодинамику ЛС, в т.ч. ЛС, используемых в лечении СН [19].
Учет изменений фармакокинетики у пациентов с СН необходим для подбора оптимальных режимов дозирования ЛС, повышения их терапевтической эффективности и безопасности (профилактика НР в первую очередь типа А, т.е. зависящих от концентрации препарата в сыворотке крови). Известно, что все основные фармакокинетические параметры (абсорбция, распределение, метаболизм и выведение) напрямую зависят от состояния гемодинамики пациента [20]. Критически значимы следующие изменения [20]: снижение кровотока и интерстициальный отек в области основных участков абсорбции ЛС (кожа, подкожная ткань, кишечник), снижение кровотока в печени, нарушение функции гепатоцитов из-за гипоксии и/или застойных явлений, снижение кровотока в почках с последующим ухудшением их функции и др.
У пациентов с хронической сердечной недостаточностью изменяются многие параметры фармакокинетики (см. таблицу) [21–27].
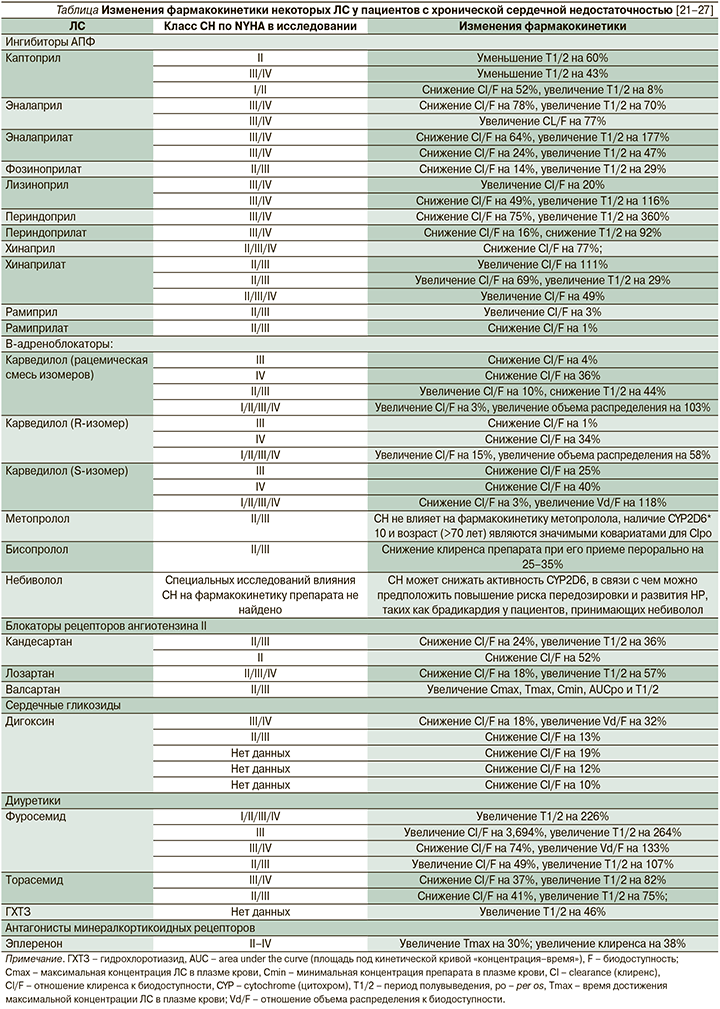
Для повышения безопасности фармакотерапии пациентам с СН при выборе стартовой дозы ЛС и его схемы титрации ЛС необходимо учитывать ряд особенностей фармакокинетики ЛС.
Ожирение. С 1980-х гг. глобальная распространенность ожирения (индекс массы тела – ИМТ≥30 кг/м2) приобрела характер эпидемии, а к 2015 г. в мире ожирением страдали более 100 млн детей и более 600 млн взрослых [28].
Известно, что ожирение влияет на физиологические процессы, такие как проницаемость стенки кишечника, скорость опорожнения желудка, сердечный выброс, функция печени и почек, что в свою очередь может обусловливать изменения фармакокинетики ЛС [29]. Так, при ожирении увеличиваются скорость опорожнения желудка и проницаемость стенок кишечника, чтобы обеспечить питательными веществами и кислородом избыточную жировую ткань [30, 31]. Также у пациентов с ожирением увеличиваются объем циркулирующей крови, капиллярный кровоток и сердечный выброс, что должно способствовать увеличению кровотока в печени и усилению метаболизма ЛС с высокой печеночной экстракцией [32]. Однако из-за частого наличия сопутствующей неалкогольной жировой болезни печени, приводящей к стеатозу или стеатогепатиту, кровоток в печени у лиц с ожирением со временем может снижаться, особенно у пациентов с тяжелыми формами ожирения [33].
У пациентов с ожирением концентрации белка и сывороточного альбумина, по-видимому, не изменяются, в то время как уровень α-1-кислого гликопротеина, по всей видимости, повышен [34].
Данные о влиянии ожирения на функцию почек неоднозначны. Так, по мнению J. Ribstein et al. [35], у пациентов с ожирением СКФ увеличивается, по другим данным [36], наоборот, ожирение имеет тесную взаимосвязь с развитием и прогрессированием ХБП.
В настоящее время принято считать, что у пациентов с ожирением почечный клиренс первоначально увеличивается за счет компенсаторной гиперфильтрации и гиперперфузии, а в конечном итоге он снижается в результате постоянно повышенного внутригломерулярного давления [35–37].
У пациентов с ожирением наблюдается повышение почечного клиренса прокаинамида, цисплатина, ципрофлоксацина, топотекана и дигоксина из-за усиления канальцевой секреции, что подтверждено в ряде работ [38–39]. У детей с ожирением наблюдалось 5-кратное увеличение метаболизма кофеина, опосредованного N-ацетилтрансферазой, по сравнению с детьми без ожирения [40]. Пациенты с ИМТ 27–35 кг/м2 и пациенты с ИМТ>35 кг/м2 имеют намного более высокие значения клиренса бусульфана при пероральном приеме по сравнению с пациентами без ожирения [41].
В целом на сегодняшний день изменения фармакокинетики ЛС у пациентов с ожирением изучены недостаточно, в т.ч. потому, что эта группа пациентов была часто недостаточно представлена в клинических исследованиях [42].
Кроме того, определенные физиологические изменения у пациентов с ожирением, такие, как, например, особенности иммунного статуса и/или хроническое асептическое вялотекущее воспаление, могут оказывать влияние на фармакодинамику некоторых ЛС, например антибактериальных препаратов [37, 43, 44].
Особенности физиологии пациентов с ожирением и ассоциированные с ними изменения фармакокинетики и фармакодинамики ЛС обусловливают необходимость индивидуального подбора схемы фармакотерапии и режима дозирования некоторых ЛС у детей и взрослых с ожирением [45, 46].
Другие сопутствующие заболевания/состояния. Риск развития НР некоторых ЛС и ЛИЗ повышен у пациентов с такими заболеваниями, как гипотиреоз, синдром нарушения питания (мальнутриции), дефицит электролитов (гипокалиемия, гипомагниемия) [1]. Так, у пациентов с гипотиреозом могут быть снижены почечный клиренс и печеночный кровоток. Было обнаружено, что введение обычных доз дигоксина и некоторых других ЛС пациентам с гипотиреозом приводит к развитию НР этих препаратов [47]. Увеличение риска развития дигоксин-индуцированных нарушений ритма сердца наблюдается у пациентов со сниженным уровнем калия и/или магния в сыворотке крови [48].
Синдром недостаточности питания (мальнутриции) может приводить ко многим патофизиологическим изменениям в организме пациента, которые впоследствии могут влиять на фармакокинетику и фармакодинамику ЛС [49]. При недостаточном питании отмечены изменение транспорта питательных веществ, атрофия слизистой оболочки тонкого кишечника с атрофией ворсинок, изменение проницаемости слизистой оболочки кишечника и активности ферментов тонкой кишки, в совокупности они могут быть причиной нарушения всасывания (абсорбции) ЛС. Синдром недостаточности питания сопровождается изменением соотношения жировой и мышечной массы тела. Изменения в составе тела также могут приводить к изменению распределения ЛС, которое также может быть изменено из-за снижения способности связывания ЛС с белками плазмы крови. Снижение содержания белка в плазме, главным образом альбумина, вызывает увеличение концентрации свободной фракции ЛС, что потенциально обусловливает увеличение риска развития НР и ЛИЗ. Кроме того, снижение функции печени при синдроме недостаточности питания служит основной причиной изменения метаболизма ЛС, а нарушение функции почек, особенно при обезвоживании, значительно влияет на их выведение, что в свою очередь способствует аккумуляции ЛС и повышению риска НР и ЛИЗ [49].
Коморбидные заболевания отнесены нами к частично модифицируемым факторам риска ЛИЗ, т.к. своевременное и комплексное их лечение в соответствии с современными клиническими рекомендациями [50–52] позволит на ранних стадиях этих заболеваний модифицировать данный фактор риска ЛИЗ и повышать безопасность фармакотерапии. На поздних стадиях заболеваний (например, цирроз печени или ХБП 4–5-й стадий) этот фактор ЛИЗ выступает как немодифицируемый, поэтому практикующие врачи должны иметь представления о потенциальных изменениях фармакодинамики и фармакокинетики ЛС и принимать соответствующие меры в плане выбора препаратов, их доз, кратности и путей введения.
Вредные привычки
Курение. Одним из модифицируемых факторов риска развития ЛИЗ является курение табака [1, 53, 54]. Табачный дым – это гетерогенный аэрозоль с размером частиц 0,2–0,5 мкм, в состав которого входит не только никотин, но и более 4000 компонентов, в т.ч. фармакологически активные вещества, а также вещества, обладающие цитотоксическими, мутагенными и канцерогенными свойствами [53, 54]. Компоненты табачного дыма увеличивают риск развития НР и ЛИЗ, оказывая влияние как на фармакокинетические параметры ЛС (на всасывание ЛС, их связь с белками, метаболизм и элиминацию), так и на фармакодинамические эффекты ЛС (за счет изменения реактивности органов-мишеней у курящих пациентов, с одной стороны, и воздействия компонентов табачного дыма на физиологические процессы организма, с другой) [54, 55].
Фармакокинетическое взаимодействие. Влияние курения на риск развития НР на фармакокинетическом уровне осуществляется главным образом за счет влияния на активность цитохромов печени CYPH450, а также уридин-5-дифосфат глюкуронилтрансферазы (УДФ-ГТ) – фермента, который катализирует процесс глюкуронирования (фаза II метаболизма), находится в мембранах эндоплазматического ретикулума гепатоцитов и в других органах. УДФ-ГТ очень важна для деактивации и выведения из организма многих медикаментов [53–55]. В свою очередь среди многих компонентов табачного дыма главную роль в этом процессе играют полициклические ароматические углеводороды (ПАУ, син.: полиароматические углеводороды, или полициклические ароматические углеводороды). Другие компоненты табачного дыма (ацетон, пиридин, тяжелые металлы, бензол, окись углерода, никотин) также влияют на активность цитохромов печени, однако этот эффект менее выражен и его клиническая значимость также существенно меньше [54, 55].
Компоненты табачного дыма, являясь индуктором цитохромов печени, ускоряют метаболизм многих ЛС, что приводит к снижению концентраций препаратов в крови и снижению их эффективности [56]. Так, некоторые из компонентов табачного дыма, в частности ПАУ, являются индукторами цитохромов печени CYP1А1, 1А2, 2В6 и, по-видимому, 2Е1 [1, 54–56]. Ряд достаточно часто назначаемых ЛС, включая ацетаминофен (парацетамол), диазепам, дулоксетин, оланзапин, ондансетрон, клозапин, метадон, являются субстратами CYP1А1, поэтому у курящих пациентов их метаболизм ускоряется. Компоненты табачного дыма, которые являются индуктором цитохрома CYP1А2 и дифосфатуридин-глюкуронозила, ускоряют метаболизм следующих ЛС: варфарина, верапамила, пропафенона, флекаинида, мексилетина, пропранолола, нитратов, инсулина, кофеина, арбидола, афобазола, эстрогенов. Влияние на метаболизм ЛС в конечном итоге приводит к снижению концентраций ЛС в крови, следовательно, к уменьшению их терапевтического эффекта [1, 53, 54, 56].
В связи с этим для получения сходного клинического эффекта курильщикам требуются более высокие дозы препаратов по сравнению с некурящими пациентами. Вследствие данных взаимодействий у курящих пациентов резко возрастает риск развития НР в момент резкого прекращения курения [52, 57]. Индукционный эффект полностью меняется через 10 дней после прекращения курения [52]. Поэтому при отказе пациента от курения может потребоваться снижение дозы ЛС, взаимодействующего с компонентами табачного дыма [54, 57]. Данный факт также необходимо учитывать, например, при поступлении пациента в стационар или при развитии острого заболевания, в связи с чем пациент прекращает курить самостоятельно (например, острые респираторные вирусные инфекции). В этом случае также следует рассматривать возможность снижения дозы подобных ЛС.
Фармакодинамические взаимодействия. Пожалуй, наибольшее клиническое значение имеет взаимодействие компонентов табачного дыма с оральными контрацептивами: риск развития НР со стороны сердечно-сосудистой системы у курящих женщин, принимающих оральные контрацептивы, значительно выше, особенно у женщин более старшего возраста [54]. Так, в возрастной группе 35–44 лет у некурящих женщин, которые принимают низкодозированные оральные контрацептивы (20–50 мг эстрогена), абсолютный риск смерти от сердечно-сосудистых заболеваний составляет 6,21 на 100 тыс. женщин, тогда как у курящих женщин он возрастает в несколько раз: 29,4 на 100 тыс. женщин [58]. Подобная закономерность прослеживается и в более молодой возрастной группе (15–34 года): у некурящих женщин риск составляет 0,65 на 100 тыс. женщин, у курящих – 3,3 на 100 тыс. женщин [58].
Однако гораздо чаще компоненты табачного дыма снижают эффективность ряда ЛС, что диктует необходимость их назначения в более высоких дозах. Риск развития НР этих ЛС, как уже говорилось выше, существенно возрастает в момент резкого прекращения курения [54]. Так, компоненты табачного дыма снижают седативный эффект бензодиазепинов (за счет стимуляции центральной нервной системы – ЦНС никотином), пульсурежающий и гипотензивный эффекты β-адреноблокаторов (за счет активации симпатического отдела вегетативной нервной системы), анальгетическую активность опиатов (механизм окончательно не установлен), липидснижающий эффект статинов (опосредованно, через активацию симпатического отдела вегетативной нервной системы и в конечном итоге увеличения синтеза триглицеридов и липопротеидов низкой плотности и очень низкой плотности в печени) и др. [54, 59].
Если пациент резко прекращает курить, сознательно или, например, при экстренной госпитализации в стационар, концентрации этих ЛС в плазме крови возрастают и могут развиться НР, в т.ч. серьезные. Так, например, у курящих пациентов, которые принимают бензодизепины, наблюдается снижение эффективности седации, поскольку никотин способствует секреции различных нейромедиаторов (ацетилхолина, допамина, серотонинаыф глутамата) за счет взаимодействия с пресинаптическими N-холинорецепторами нейронов ЦНС, в связи с этим курильщикам приходится назначать бензодиазепины в более высоких дозах [54, 60]. Поэтому в случае резкого внезапного прекращения курения, но продолжения приема бензодизепинов развивается чрезмерное угнетение ЦНС.
Курение служит модифицируемым фактором риска развития ЛИЗ, поэтому врач любой специальности должен проинформировать курящего пациента о вреде курения для здоровья и о его негативном влиянии на течение имеющихся у пациента заболеваний, обсудить с ним различные стратегии – медикаментозные и/или немедикаментозные, прекращения курения [54]. Если пациент планирует бросать курить, следует пересмотреть лекарственные назначения для исключения/снижения доз тех ЛС, которые могут приводить к развитию НР и ЛИЗ в момент резкого прекращения курения. В том случае, когда фармакотерапия назначается пациенту, который не считает необходимым перестать курить, целесообразно выбирать по возможности ЛС, на фармакокинетику и фармакодинамику которых курение табака оказывает минимальное влияние [54].
Алкоголь. Одним из модифицируемых факторов риска развития ЛИЗ является избыточное потребление алкогольных напитков [1, 61]. Этанол – основной компонент алкогольных напитков, может вступать как в фармакокинетические, так и в фармакодинамические взаимодействия со многими ЛС [61, 62].
Выделяют несколько механизмов взаимодействия алкоголя (этанола) с ЛС [63]: изменение структуры и функции клеточных и субклеточных мембран, различных рецепторов, ферментов, проницаемости гистогематических барьеров (как следствие – нарушения текучести липидных мембран), структуры потенциалзависимых ионных каналов; «переключение» микросомальной этанолокислительной системы на окисление этанола (в результате – снижение уровня окисления других эндогенных и экзогенных лигандов), индукция микросомальных ферментов печени (изменение скорости и уровня биотрансформации других веществ, повышение секреции желудочной слизи и влияние на скорость эвакуации ЛС из желудка.
Фармакокинетические взаимодействия алкоголя и лекарственных средств. За счет обширного спектра механизмов влияния на организм, включающих в т.ч. индукцию микросомальных ферментов печени и скорость эвакуации содержимого желудка, этанол способен в значительной степени изменять фармакокинетику различных ЛС за счет влияния на их абсорбцию, метаболизм, распределение или экскрецию, что будет проявляться изменением фармакокинетических параметров ЛС (AUC –
AreaUnder the Curve, площадь под фармакокинетической кривой «концентрация–время», максимальной концентрации – Cmax, периода полувыведения – Т1/2 и др.) [1, 61].
Влияние этанола на абсорбцию ЛС.
В некоторых случаях этанол при приеме внутрь в низких дозах может увеличивать абсорбцию и тем самым повышать биодоступность ЛС за счет увеличения растворимости ЛС в содержимом желудка, усиления кровотока в желудочно-кишечном тракте (ЖКТ) и угнетения пресистемного метаболизма ЛС [64]. Так, у лиц, хронически злоупотребляющих этанолом, обнаружено увеличение биодоступности аминогликозидных антибиотиков из-за вызванного этанолом повреждения слизистой оболочки ЖКТ, как следствие – потенциальное повышение риска нефро- и ототоксичности [65].
Влияние этанола на метаболизм ЛС. При одновременном приеме этанола и парацетамола значительно повышается риск поражения печени вследствие индукции этанолом экспрессии CYP2E1 и увеличения образования токсичного метаболита парацетамола – N-ацетил-р-бензохинонимина [66].
Другим примером потенциальных изменений фармакокинетики ЛС на фоне одновременного применения с этанолом служит увеличение на 27% AUC несвязанной фракции диазепама и снижение на 50% AUC его первичного метаболита N-десметилдиазепама за счет ингибирования этанолом CYP2C19, что может быть ассоциировано с усилением седативного действия препарата [67]. В работе A. Tatsumi и at al. [68] показано, что ингибирование 7-гидроксилирования S-варфарина и метаболизма S-варфарина за счет угнетения CYP2C9.1 потенциально может приводить к увеличению риска кровотечений, т.к. S-изомер варфарина в 5 раз активнее R-изомера [69].
Влияние этанола на распределение ЛС. Данные о влиянии этанола на распределение требуют дополнительного изучения и уточнения, однако, крайне вероятно, что этанол может уменьшать объем распределения (Vd) некоторых ЛС (из-за изменений в перфузии тканей и связывания ЛС с белками плазмы крови и/или тканями, а также дегидратации организма вследствие ингибирования секреции антидиуретического гормона, а также рвоты на фоне алкогольной интоксикации) [61]. Уменьшение объема распределения в ряде случаев может повышать риски развития НР [1, 61]. Так, в литературе описан случай развития болей в боку и острой почечной недостаточности у пациента, страдавшего запойным пьянством, после инъекции нестероидного противовоспалительного средства ибупрофена [70].
Влияние этанола на почечную экскрецию ЛС. Влияние этанола на почечную экскрецию ЛС неоднозначно [61]. С одной стороны, этанол подавляет секрецию антидиуретического гормона и тем самым способен вызывать повышенную экскрецию ЛС через почки, однако, с другой стороны, задержка жидкости в организме пациентов с хроническим алкоголизмом может, наоборот, способствовать снижению выведения ЛС через почки и, следовательно, повышению риска развития НР и ЛИЗ [71]. Например, на фоне совместного применения с этанолом габапентина (антиконвульсант, характеризующийся преимущественно почечным путем элиминации и относительно низким потенциалом межлекарственных взаимодействий) наблюдалось увеличение частоты развития и тяжести нарушений координации и моторных функций, а также дозозависимое увеличение частоты сердечных сокращений [72].
Фармакодинамические взаимодействия алкоголя и ЛС. Этанол оказывает дозозависимое угнетающее действие на ЦНС, клинические проявления которого варьируются от легкого анксиолитического эффекта, растормаживания поведения до седативного эффекта и угнетения дыхания [61, 73]. Поэтому ЛС, которые могут вызывать угнетение ЦНС, такие как бензодиазепины, барбитураты, опиоиды и антидепрессанты, могут усиливать фармакологические эффекты этанола, и наоборот. Воздействие этанола на сердечно-сосудистую систему более сложное [61, 73]. Так, в течение нескольких часов после употребления этанола имеет место умеренная дилатация артерий, в т.ч. коронарных, однако длительное употребление этанола в больших дозах приводит к стойкому повышению систолического и диастолического артериального давления [61, 73].
Прием алкоголя служит модифицируемым фактором риска развития соматической и психической патологии, а также ЛИЗ, поэтому специалист практического здравоохранения независимо от специализации должен проинформировать пациента о вреде приема алкоголя для здоровья и о его негативном влиянии на течение имеющихся у пациента заболеваний. Также в случае необходимости следует рекомендовать пациенту проведение психологической коррекции, направленной на формирование приверженности здоровому образу жизни, минимизации психологических факторов риска возникновения алкогольной зависимости [74].
В случае необходимости проведения фармакотерапии пациентам, принимающим алкоголь, для минимизации потенциальных рисков развития НР и ЛИЗ целесообразно придерживаться определенных рекомендаций [61, 75].
Наркотики и психоактивные вещества. Психоактивное вещество – вещество (или смесь), которое влияет на функционирование ЦНС, приводя к изменению психического состояния, иногда вплоть до измененного состояния сознания [76], они используются в рекреационных целях и в медицине.
К психоактивным веществам относятся конопля (каннабиноиды), ЛСД (ЛСД-25, LSD – Lysergsäurediethylamid, диэтиламид d-лизергиновой кислоты – полусинтетическое психоактивное вещество из семейства лизергамидов), кокаин, амфетамины, опиаты (морфин, героин и др.), а также алкоголь, снотворные средства, никотин и кофеин [76]. Они воздействуют на определенные рецепторы, на которые влияют и эндогенные лиганды [76]: конопля – на каннабиноидные рецепторы (эндогенные лиганды – анандамид, 2-арахидонилглицерин), амфетамины, кокаин и ЛСД – на дофаминовые, серотониновые и адренорецепторы (эндогенные лиганды, соответственно, дофамин, нораденалин, серотонин), опиоиды – на опиоидные рецепторы (эндогенные лиганды – эндорфины, эндоморфины).
Конопля (Cánnabis) – род однолетних растений семейства коноплевые (Cannabaceae). В листьях конопли содержатся тетрагидроканнабинол и другие каннабиноиды. Конопля имела большое промышленное значение с XV по начало XX в., затем ее посевы были значительно сокращены. Единая конвенция о наркотических средствах (1961) включает коноплю в список наркосодержащих растений и обязывает правительства стран-участниц строго контролировать ее выращивание. В английском языке «каннабисом» (cannabis) традиционно называется именно психоактивное вещество каннабиас (марихуана, исп.: marijuana, marihuana), получаемое из конопли, а «коноплей» (hemp) – сельскохозяйственная культура. Воздействие на организм человека связано с содержащимися в конопле психоактивными веществами (каннабиноидами), всего их более 100, но наибольшее значение имеют 3-дельта-9-тетрагидроканнабинол (самый действенный из всех каннабиноидов), каннабидиол и каннабинол [77].
В экспериментальных исследованиях было обнаружено, что 3-дельта-9-тетрагидроканнабинол метаболизируется CYP3A4 и CYP2C9, а каннабидиол – главным образом CYP3A4 [78]. S. Yamaori et al. [79] в экспериментальном исследовании изучали воздействие курения марихуаны (т.е. дельта‐9‐тетрагидроканнабинола, каннабидиола, каннабидиола и каннабинола) и ПАУ на каталитическую активность CYP2C9 in vitro. Их результаты показали, что все перечисленные каннабиноиды, но не ПАУ вызывают прямое, зависящее от концентрации ингибирование CYP2C9, опосредованное 7‐гидроксилированием S‐варфарина [79]. W. Yamreudeewong et al. [80] представили клинический случай 56‐летнего мужчины с множественными коморбидными заболеваниями (ишемическая болезнь сердца с недавней установкой стента, механический протез клапана сердца, симптомный атеросклероз периферических артерий, эпилепсия, гастроэзофагеальнорефлюксная болезнь). Он получал терапию варфарином в течение 11 лет и одновременно лечился несколькими другими препаратами (ацетилсалициловая кислота, клопидогрел, карбамазепин, фуросемид, метопролол, омепразол, хлорид калия, сертралин, трамадол, вальпроевая кислота). Лечащим врачом было зарегистрировано два эпизода внезапного увеличения международного нормализованного отношения (МНО) у пациента до значений выше 10. Оба эпизода привели к развитию кровотечений, в обоих случаях МНО нормализовалось после введения витамина К. Было установлено, что пациент продолжал принимать все другие препараты в тех же дозах, без пропусков, не менял рацион питания и не принимал никаких новых, в т.ч. безрецептурных, ЛС, травяных сборов или БАДов перед развитием вышеописанных эпизодов кровотечения. Тем не менее он сообщил, что увеличил как частоту, так и количество выкуриваемой марихуаны с 1–2 косяков в неделю (0,25–0,5 г/нед.) до 4–5 (2,0–2,5 г/нед.). После того как пациент бросил курить марихуану, в течение следующих 9 месяцев наблюдения никаких высоких значений МНО не зарегистровано, кровотечений не было.
В одном из исследований, в котором обследовали 18 лиц, регулярно курящих марихуану, обнаружено, что средняя концентрация дельта‐9‐тетрагидроканнабинола в плазме, измеренная в течение 24 часов после последнего рекреационного воздействия вдыхаемых каннабиноидов (т.е. курения «косяка»), составила 1,9 мкг/л (~6,04 мкмоль/л) в диапазоне от 0,5 до 9,0 мкг/л [81]. После 7 дней воздержания от употребления марихуаны дельта‐9‐тетрагидроканнабинол был обнаружен у 16 из 18 участников, его средняя концентрация в плазме составила 1,1 мкг/л (~3,5 мкмоль/л) [81]. Таким образом, у лиц, регулярно курящих марихуану, дельта‐9‐тетрагидроканнабинол присутствует в крови в достаточно высокой концентрации даже после 7 дней воздержания, что подтверждает высокую клиническую значимость взаимодействия между каннабисом и варфарином. В последние годы варфарин «уступил место» новым пероральным антикоагулянтам – прямые пероральные антикоагулянты (ПОАК, дабигатран этексилат, ривароксабан, апиксабан, эдоксабан) являются препаратами первого выбора у пациентов с фибрилляцией предсердий неклапанной этиологии и венозной тромбоэмболией. Хотя ни один из ПОАК не метаболизируется через CYP2C9, все они служат субстратом Р‐гликопротеина [82], который, как было установлено, ингибируют каннабиноиды [83]. Хотя потенциальное клиническое значение этого взаимодействия пока не задокументировано, тем не менее фармакокинетическое взаимодействие между каннабисом и ПОАК возможно, что диктует необходимость более тщательного мониторинга параметров безопасности фармакотерапии при назначении ПОАК пациентам, регулярно курящим марихуану, поскольку риск развития кровотечений у них может быть повышен.
Канабиноиды являются мощными ингибитороми CYP3A4 [1]. Поскольку CYP3A4 метаболизирует около четверти всех ЛС, при частом потреблении марихуаны может повышаться концентрация макролидов, блокаторов кальциевых каналов, бензодиазепинов, циклоспорина, силденафила (и других ингибиторов фосфодиэстеразы типа 5), антигистаминных препаратов, галоперидола, антиретровирусных препаратов, некоторых статинов (аторвастатин и симвастатин, но не розувастатин) и других препаратов в сыворотке крови, что потенциально увеличивает риск развития НР и ЛИЗ, ассоциированных с применением таких ЛС.
Каннабиноиды также индуцируют CYP1A2 аналогично табаку [1]. Одновременное применение каннабиса и субстратов CYP1A2, таких как клозапин, оланзапин, галоперидол и тамоксифен, может потребовать назначения более высоких доз этих препаратов для обеспечения требуемого терапевтического эффекта [84]. Поэтому пациенты, которые получают эти препараты, подвергаются высокому риску передозировки и развития тяжелых НР и ЛИЗ после прекращения употребления каннабиса, поскольку они с большой долей вероятности применялись в более высоких дозах в то время, когда пациент употреблял марихуану.
Амфетамины – класс соединений, включающий собственно амфетамин и его производные [85]. Многие амфетамины обладают заметными психоактивными свойствами и являются распространенными наркотиками. Пример производных амфетамина: метамфетамин, эфедрин, катинон, меткатинон, 3,4-метилендиоксиамфетаин, 3,4-метилендиоксиметамфетамин (Экстази), 2,5-диметокси-4-бромоамфетамин.
Амфетамины метаболизируются CYP2D6 и ингибируют активность этого цитохрома [1]. Поэтому одновременное применение препаратов, метаболизируемых CYP2D6, и амфетаминов увеличивает риск развития НР этих ЛС, следовательно, риск развития соответствующих ЛИЗ [85, 86]. CYP2D6 метаболизирует массу препаратов класса антидепрессантов, поэтому совместное употребление амфетаминов может повышать концентрацию в сыворотке селективных ингибиторов обратного захвата серотонина (СИОЗС), трициклических антидепрессантов, антипсихотиков, β-адреноблокаторов и опиоидов (включая кодеин) [1].
Кроме того, амфетамины и кокаин (алкалоид тропанового ряда, метиловый сложный эфир бензоилэкгонина, широко распространенный наркотик, наряду с другими алкалоидами содержится в растениях рода Эритроксилум, лат.: Erythroxylum) блокируют обратный захват моноаминов (например, дофамина) и подавляют их метаболизм [1]. Когда амфетамины или кокаин используются одновременно с антидепрессантами, такими как СИОЗС и трициклические антидепрессанты, в результате фармакодинамического взаимодействия повышается риск развития НР антидепрессантов со стороны сердечно-сосудистой системы, в т.ч. гипертонического криза, и со стороны ЦНС [86, 87].
Заключение
Некоторые распространенные заболевания могут влиять на фармакокинетику и фармакодинамику ЛС. Помимо этого существуют факторы риска, которые необходимо предупреждать. К таким факторам относятся курение, злоупотребление алкоголем, применение наркотических и психоактивных веществ.
Вклад авторов. Д.А. Сычев, О.Д. Остроумова – концепция, дизайн исследования, редактирование. А.П. Переверзев, А.И. Кочетков, Е.Ю. Эбзеева, В.А. Дё – сбор и обработка материала. М.В. Клепикова – написание текста.



