Введение
В 1986 г. S.H. Roth предложил использование термина «НПВС-гастропатия» для интерпретации им эрозивно-язвенных поражений слизистой оболочки гастродуоденальной зоны у пациентов, получающих терапию нестероидными противовоспалительными средствами (НПВС) [1]. На сегодняшний день в связи с широким клиническим применением НПВС клиницистам хорошо известны характерные клинико-эндоскопические особенности НПВС-гастропатий, заключающиеся в появлении острых, обычно множественных гастродуоденальных эрозий и/или язв с преимущественной локализацией в антральном отделе желудка в отсутствие локального воспаления и гистологических признаков гастрита, возникающих на фоне курсового приема НПВС. Важная особенность – в 40–45% случаев течение заболевания мало- или бессимптомно [2]. Отмечается частая манифестация с развитием осложнений, а также склонность язвенных дефектов к самостоятельному заживлению после отмены НПВС. Наибольший риск развития кровотечения вне зависимости от назначенного НПВС возникает на первой неделе приема (отношение шансов [ОШ]=11,7; 6,5–21,0) и снижается при продолжении приема НПВС (ОШ=5,6; 4,6–7,0), становясь минимальной через неделю после отмены (ОШ=3,2; 2,1–5,1) [3]. Целью данной статьи стала систематизация накопленных к настоящему моменту времени данных о патогенезе, профилактике и лечении НПВС-индуцированных гастропатий.
Патогенез
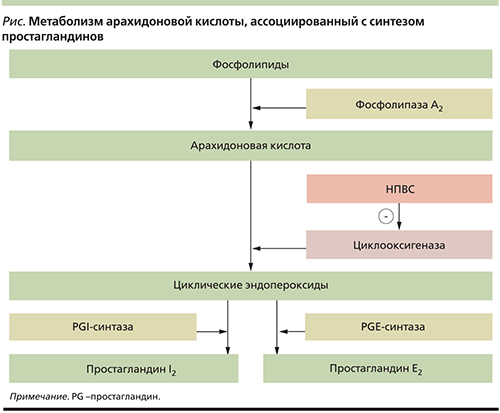
Патогенез НПВС-индуцированных гастропатий основан на главном механизме действия данных лекарственных средств: снижении синтеза простагландинов в результате блокады фермента циклооксигеназы (ЦОГ), ключевого фермента метаболизма арахидоновой кислоты – предшественника простагландинов (см. рисунок) [2, 4, 5]. Причем именно подавление синтеза простагландинов вызывает противовоспалительный, жаропонижающий и обезболивающий эффекты НПВС, одновременно сопровождаясь побочным эффектом поражения желудочно-кишечного тракта (ЖКТ), где простагландины являются необходимым компонентом функционирования защитного барьера слизистой оболочки.
На сегодняшний день известны две изоформы ЦОГ: ЦОГ-1 и ЦОГ-2 [6]. При этом основные положительные клинические эффекты НПВС связаны с блокадой изофермента ЦОГ-2, а побочный эффект (гастропатия) – с ингибированием изофермента ЦОГ-1, который отвечает за физиологическую защиту слизистой оболочки желудка (СОЖ) [7, 8]. ЦОГ-1 отвечает за синтез простагландинов, которые защищают СОЖ от детергентного действия соляной кислоты, поддерживают кровоток в СОЖ и стимулируют выработку бикарбонатов [2, 9, 10].
Существует три различных механизма индуцированного НПВС повреждения СОЖ:
- ингибирование фермента ЦОГ-1 и гастропротективных простагландинов;
- повышение проницаемости мембран;
- выработка дополнительных провоспалительных медиаторов.
Основным путем патологического воздействия НПВС на СОЖ, преимущественно его антрального отдела, является системное воздействие НПВС на защитный барьер слизистой оболочки, осуществляемый через блокаду синтеза простагландинов (PGE2, PGI2) и их метаболитов (простациклина и тромбоксана A2) [2, 11]. Известно, что простагландины предохраняют слизистую оболочку от повреждения, в первую очередь от действия соляной кислоты и пепсина.
Предохраняющее, цитопротективное действия простагландинов связаны с несколькими механизмами, отличными от PGE2 и PGI2. Так, первые реализуют свое цитопротективное действие через подавление синтеза соляной кислоты и увеличение продукции слизи и бикарбонатов. Вторые – через стимуляцию кровообращения в СОЖ, стабилизацию мембран тучных клеток и лизосом, подавление продукции свободных радикалов и ферментов нейтрофилами, а также через регуляцию деятельности эпителия сосудов [2].
Подавление активности ЦОГ-1 приводит к изменению метаболизма арахидоновой кислоты, переключая его с простагландинового на липооксигеназный путь, сопровождающийся выработкой лейкотриенов (в частности, лейкотриена В4) [12, 13]. Лейкотриены вызывают воспаление и ишемию тканей, что ведет к повреждению СОЖ [14, 15]. Последнее очень важно, т.к. лейкотриены оказывают токсическое воздействие на СОЖ, индуцируя в ней развитие воспаления за счет адгезии нейтрофилов к эндотелию сосудов. Усиление адгезии нейтрофильных лейкоцитов с образованием в сосудах «белых» тромбов при приеме НПВС связано также с компонентом С5-коплемента и цитокинов, а повреждающее действие – с фактором некроза опухоли α [16–17].
Существен и тот факт, что ингибирование преимущественно ЦОГ-2 изоформы некоторыми селективными ингибиторами ЦОГ-2 помимо противовоспалительного эффекта может вызывать усиление агрегационной активности тромбоцитов, возникающее в результате снижения синтеза простациклина клетками эндотелия при одновременном сохранении выработки тромбоксана (ТхА2) тромбоцитами, что усиливает агрегационную активность тромбоцитов, вызывая нарушение микрогемоциркуляции [2].
Профилактику острых осложнений со стороны сердечно-сосудистой системы видят в приеме низких доз ацетилсалициловой кислоты (аспирина). Но здесь надо учитывать, что аспирин-ацетилированная ЦОГ-2 изменяет метаболический путь арахидоновой кислоты таким образом, что под действием фермента липооксигеназы образуются малоизученные формы лейкотриенов, в свою очередь индуцирующие воспалительную реакцию в СОЖ. Кроме того, есть данные, что под действием селективного ингибитора ЦОГ-2 происходит снижение синтеза липоксина, необходого для защиты СОЖ от действия ацетилсалициловой кислоты. Все это приводит к тому, что сочетание селективного ингибитора ЦОГ-2 и низких доз ацетилсалициловой кислоты по своему ульцерогенному потенциалу и частоте осложнений не уступает обычным неселективным НПВС.
Локальный токсический эффект НПВС, имеющий особое значение в первые дни приема препаратов, связан в первую очередь с непосредственным влиянием на СОЖ противовоспалительных средств как слабых органических кислот с константой ионизации pKa в диапазоне 3–5 [4]. Выраженность эффекта в данном случае зависит от растворимости и рКа конкретного НПВС. Под действием НПВС гидрофобность слизистой оболочки снижается и данные ксенобиотики становятся способными проникать (посредством диффузии) через фосфолипидную мембрану в цитоплазму эпителиальных клеток СОЖ, где они ионизируются при высоких значениях рН и накапливаются в больших концентрациях, что приводит к повреждению клеток. Нарушение внутриклеточной концентрации водородных ионов приводит к их обратной диффузии в слизистую оболочку, снижению рН, что снижает порог чувствительности болевых рецепторов, локализованных в подслизистом слое, обусловливая появление болевого и диспепсического синдромов.
Помимо влияния на метаболизм простагландинов некоторые НПВС, в частности ацетилсалициловая кислота, способны ингибировать синтез оксида азота, что также приводит к нарушению микроциркуляции в СОЖ и двенадцатиперстной кишке и ее повреждению. Существует даже мнение, будто адаптация слизистой оболочки к приему НПВС как раз и опосредована компенсаторным увеличением синтеза оксида азота [16].
Инфекция Helicobacter pylori (H. pylori) примерно в 1,5 раза повышает риск поражения НПВС СОЖ [2, 19]. Помимо этого НПВС и H. pylori достоверно повышают риск язвенного кровотечения в 1,79 и 4,86 раза соответственно, а наличие обоих факторов увеличивает его уже в 6,13 раза [20]. Таким образом, на сегодняшний день считается, что H. pylori и НПВС – независимые, но значительно потенцирующие друг друга факторы риска ульцерогенеза [21].
Профилактика и лечение
В связи с широким клиническим применением НПВС и достаточно высоким риском осложненного течения этого вида гастропатий большое внимание уделяется разработке методов их профилактики и лечения. Так, специалистами American College of Gastroenterology рекомендуется несколько стратегий для регресса риска НПВС-индуцированного поражения СОЖ, включая использование селективных ингибиторов ЦОГ-2, совместный прием гастропротективных препаратов или ингибиторов протонной помпы (ИПП) [22]. Эти стратегии основаны на анализе влияния многочисленных факторов риска развития осложнений со стороны ЖКТ, связанных с приемом НПВС, включая возраст пациента, сопутствующий прием медикаментов (в первую очередь аспирина), отягощенный язвенный анамнез, инфекцию H. pylori и др. [5, 23].
Говоря о методах профилактики развития НПВС-гастропатии, следует сказать, что в первую очередь надо опираться на анализ факторов риска гастропатии и назначать НПВС избирательно, отдавая предпочтение селективным ингибиторам ЦОГ-2 (целекоксиб), или назначать неселективные НПВС совместно с приемом ИПП и/или гастропротекторами [24, 25] с учетом риска развития осложнений со стороны сердечно-сосудистой системы на фоне приема коксибов [26, 27]. Наиболее распространенные из применяемых защитных стратегий представлены в таблице.
Селективные ингибиторы ЦОГ-2.
В плане предупреждения осложнений со стороны ЖКТ наиболее эффективны препараты группы ингибиторов ЦОГ-2 – коксибы [28, 29]. Некоторые исследования применения ингибиторов ЦОГ-2 по сравнению с неселективными НПВС как в комбинации с ИПП, так и без показывают явные преимущества коксибов: в 3–4 раза, даже перед комбинацией НПВС с ИПП в регрессе риска повреждений СОЖ [30, 31]. Однако, несмотря на то что ингибиторы ЦОГ-2 в значительной мере снижают риск поражения ЖКТ, риск сердечно-сосудистых осложнений по причине тромбоза коронарных артерий и развития инфаркта миокарда, связанных с их использованием, сохраняется на высоком уровне [26, 27, 32].
Долгосрочные исследования влияния применения целекоксиба (CLASS) и рофекоксиба (VIGOR) на состояние ЖКТ и развитие побочных сердечно-сосудистых эффектов ставят под сомнение безопасность использования данных лекарственных средств [28, 33]. Некоторые из указанных препаратов были даже отозваны с рынка. Данные события инициировали оценку безопасности сначала других ингибиторов ЦОГ-2, а затем и традиционных НПВС. К текущему моменту результаты мета-анализа S. Trelle и соавт. (2011) продемонстрировали увеличенный риск сердечно-сосудистых осложнений при терапии любыми НПВС независимо от селективности в отношении к ЦОГ-2 [27]. Эти данные были позже подтверждены Coxib and traditional NSAID Trialists' Collaboration в мета-анализе 2013 г. [34].

Кислотосупрессивная терапия (ИПП). Препаратами выбора при лечении НПВС-гастропатии на сегодняшний день являются ИПП [5], высокоэффективные в рамках ингибирования синтеза соляной кислоты и профилактики пептических язв при совместном приеме с НПВС. В связи с этим ИПП обычно назначают длительными курсами, а после исчезновения эндоскопических признаков поражения СОЖ применяется поддерживающая терапия ИПП в половинной дозе длительностью 6 месяцев [24, 35, 36].
Эрадикация инфекции H. pylori. Консенсусом Маастрихт-IV (2010) в отношении инфекции H. pylori и НПВС определено, что данные факторы ульцерогенеза независимы относительно деструктивных процессов СОЖ и ассоциированных с ними геморрагических осложнений [37]. Однако данные факторы могут выступать как синергисты по отношению друг к другу, ввиду чего всем больным, которым планируется длительный прием НПВС, рекомендуется стратегия «test and treat», заключающаяся в неинвазивной диагностике и последующей эрадикации инфекции в случае ее обнаружения. Результаты мета-анализа показали, что эрадикация H. pylori менее эффективна, чем применение ИПП, для профилактики развития НПВС-ассоциированных язв [38]. Эрадикация микроорганизма показана пациентам, принимающим даже низкие дозы ацетилсалициловой кислоты, при наличии язвенной болезни в анамнезе как фактора риска и осложненного течения НПВС-гастропатий [19].
Гастропротекторы. Гастропротек-торы широко применяются с целью профилактирования и терапии НПВС-индуцированных гастропатий, однако представлены достаточно гетерогенной группой препаратов с различными механизмами действия и доказательной базой.
Мизопростол – синтетический аналог простагландина Е1, достоверно снижающий риск возникновения деструктивных процессов в СОЖ при приеме НПВС [39, 40]. Однако на фоне приема препарата у пациентов нередко отмечаются диспепсические расстройства (изжога, тошнота, отрыжка, дискомфорт в эпигастрии, диарея) [40, 41]. С учетом того что при приеме НПВС больные часто не отмечают дискомфорта со стороны ЖКТ, его появление на фоне приема мизопростола воспринимается больными крайне негативно.
В настоящее время с целью гастропротекции мизопростол в России используется крайне ограниченно.
На протяжении многих лет в рутинной клинической практике используются гастропротективные средства, такие как сукральфат и препараты висмута. Как правило, оба препарата применяются в комбинации с ИПП и/или в рамках комплексной терапии H. pylori-ассоциированных патологий. Однако доказательная база их применения в рамках гастропротекции при НПВС-индуцированных поражениях СОЖ ограниченна.
С 2016 г. в России появился новый гастропротективный препарат ребамипид, широко использовавшийся в предшествующие годы в ряде стран в качестве как моно-, так и комплексной терапии (в комбинации с ИПП) НПВС-индуцированных гастропатий. Механизмы действия данного гастропротектора заключаются в стимулировании синтеза простагландинов PGE2 и PGI2 и гликопротеинов СОЖ, а также в ингибировании продуктов оксидативного стресса, провоспалительных цитокинов и хемокинов [42–44]. Ребамипид способствует улучшению кровоснабжения СОЖ, активизирует ее барьерную функцию, активизирует щелочную секрецию желудка, усиливает пролиферацию и замещение эпителиальных клеток желудка, оказывает гастропротекторное действие [44].
Ребамипид отличает хорошая доказательная база в рамках превенции и терапии НПВС-индуцированных гастропатий. Так, в мета-анализе, опубликованном в 2013 г., объединившем 15 рандоминизированных исследований (965 пациентов), была показана достоверно бóльшая эффективность ребамипида по сравнению с плацебо при лечении гастродуоденальных повреждений, индуцированных НПВС. Серьезных побочных эффектов обнаружено не было [45].
В исследование J.H. Kim и соавт. (2014) были включены 479 пациентов, требовавших проведения длительной терапии НПВС в стандартных дозах. В процессе рандомизации 1-я группа получала ребамипид в дозе 100 мг 3 раза в сутки, в то время как 2-я – мизопростол в дозе 200 мкг 3 раза в сутки. Оба препарата применялись в течение 12 недель. Частота развития НПВС-индуцированных язв желудка была сходной в обеих группах и составила 20,3% при приеме ребамипида против 21,9% при приеме мизопростола, однако частота и тяжесть побочных эффектов со стороны ЖКТ были ниже в группе пациентов, принимавших ребамипид (27,1 против 19,4%). Важно и то, что в группе мизопростола почти в 2 раза чаще больные отказывались от продолжения терапии [46]. Ана-логичные данные были получены в Корее. Частота возникновения язвенных дефектов равнялась 4,5% в группе ребамипида и 4,4% в группе мизопростола [47]. В исследование K. Tozawa и соавт. (2014) были включены 32 здоровых мужчины-добровольца, рандомизированных в 4 группы с 14-дневным курсом терапии: группа А принимала плацебо 3 раза в сутки+аспирин в низкой дозе; группа В – ребамипид 100 мг 3 раза в сутки+аспирин в низкой дозе; группа С – плацебо 1 раз в сутки+аспирин в низкой дозе+клопидогрел 75 мг 3 раза в сутки; группа В – ребамипид 100 мг – 3 раза в сутки+аспирин в низкой дозе+клопидогрел 75 мг 3 раза в сутки. Результаты данного исследования продемонстрировали преимущества ребамипида перед плацебо в профилактике повреждений СОЖ, индуцированных аспирином и клопидогрелом [48].
К заявленным показаниям к применению препарата относятся предотвращение возникновения повреждений слизистой оболочки на фоне приема НПВС, язвенная болезнь желудка, хронический гастрит с повышенной кислотообразующей функцией желудка в стадии обострения, эрозивный гастрит. Рекомендованный курс терапии ребамипидом составляет 2–4 недели и может быть продлен до 8 недель. Препарат назначают перорально по 1 таблетке 3 раза в сутки с небольшим количеством жидкости.
Заключение
Таким образом, НПВС-гастропатии нередко встречаются в практике интерниста ввиду широкого применения этой группы препаратов в клинической практике. В силу безболевого течения рассматриваемая патология не диагностируется в ряде случаев вплоть до развития таких грозных осложнений, как желудочно-кишечное кровотечение. В основе патогенеза НПВС-индуцированных гастропатий лежит снижение синтеза простагландинов в результате блокады фермента ЦОГ – ключевого фермента метаболизма арахидоновой кислоты. Ввиду того что терапия НПВС, как правило, носит долгосрочный характер и не может быть отменена, чрезвычайно важной представляется стратегия профилактики и лечения повреждений гастродуоденальной зоны. На данный момент наиболее распространенной из применяемых стратегий остается комбинированная терапия НПВС с ИПП, а также применение селективных ингибиторов ЦОГ-2. Внедрение в клиническую практику нового препарата с доказанным эффектом ребамипида, обладающего гастропротективным действием за счет повышения продукции эндогенных простагландинов, открывает новые перспективы ведения этой непростой группы пациентов.



