Введение
На настоящий момент инфекция Helicobacter pylori является одной из наиболее распространенных патогенных инфекций человека, ассоциированной с развитием ряда заболеваний гастродуоденальной зоны [1–3]. Согласно современным международным консенсусным рекомендациям (Маастихт-V, 2015; Киотский консенсус, 2015; Торонтский консенсус, 2016), базисным методом профилактики и лечения H. pylori-ассоциированных заболеваний является эрадикационная терапия (ЭТ), включающая ингибитор протонной помпы (ИПП) в сочетании с несколькими антибактериальными препаратами [4–6]. Однако сегодняшний этап изучения инфекции H. pylori связан с негативным трендом снижения эффективности классических схем ЭТ, что коррелирует с ростом резистентных к антибиотикам штаммов микроорганизма в популяции [1, 2, 4, 7]. Этот вызов современной медицине обусловливает целесообразность дальнейшего поиска, разработки и комплексного изучения альтернативных вариантов ЭТ.
Гибридная схема ЭТ, предложенная в 2011 г. P.I. Hsu и соавт. [8] и успешно апробированная в ряде стран Азии, Европы и Ближнего Востока, привлекла к себе широкое внимание мирового гастроэнтерологического сообщества благодаря сочетанию высокой эффективности и приемлемой безопасности. В настоящем обзоре систематизированы литературные данные о гибридной схеме ЭТ, включая вопросы ее эффективности, безопасности, переносимости и текущего места в качестве метода профилактики и лечения H. pylori-ассоциированных заболеваний.
Состав и механизм действия гибридной схемы ЭТ
Гибридная схема ЭТ представляет собой комплексный 14-дневный четырехкомпонентный протокол антихеликобактерного лечения без препаратов висмута и состоит из двух этапов: проведения двойной терапии в течение первых 7 дней (ИПП и амоксициллин) с переходом на четырехкомпонентную терапию в последующие 7 дней (ИПП, амоксициллин, кларитромицин и метронидазол/тинидазол). Разовые дозировки лекарственных средств не отличаются от таковых при использовании классических схем ЭТ: ИПП в стандартной дозе, амоксициллин 1 г, кларитромицин 0,5 г и метронидазол/тинидазол 0,5 г. Все препараты принимают 2 раза в сутки [8–10].
Таким образом, гибридная схема ЭТ представляет собой сочетание двух других схем ЭТ: двухкомпонентная терапия на первом этапе аналогична последовательной терапии, а четырехкомпонентная терапия на втором этапе соответствует «одномоментной» схеме. В целом гибридная терапия основана на оптимизации последовательной схемы ЭТ: пролонгирован курс ЭТ с 10 до 14 дней, а второй этап ЭТ дополнен амоксициллином [8, 11].
В рамках гибридной схемы ЭТ применяется сразу три антибактериальных препарата с различным альтерирующим действием на клетки H. pylori. Механизм воздействия амоксициллина на Н. pylori заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллинсвязывающих белков – ферментов, осуществляющих завершающие стадии биосинтеза основного компонента клеточной стенки микроорганизма – пептидогликана, что приводит к нарушению роста и гибели бактерии [1, 12]. Кларитромицин ингибирует синтез белка бактериальной рибосомы, что приводит к образованию неполноценных белковых молекул и гибели микроорганизма [12]. Механизм действия метронидазола/тинидазола реализуется посредством повреждения ДНК бактериальной клетки. Проникая внутрь клетки, NO2-группа препарата восстанавливается в форму гидроксиламинового производного, вызывая повреждение ДНК и гибель микроорганизма [2, 13].
Механизм комплексного антихеликобактерного действия гибридной терапии аналогичен последовательной терапии. В течение первого этапа применения протокола уничтожаются кларитромицин-резистентные штаммы H. pylori и бóльшая часть бактерий на поверхности слизистой оболочки, а в течение второго этапа – прочие, в т.ч. в глубине желудочных ямок, и адгезированные на эпителии (с учетом действия кларитромицина на биопленки и высокой способности проникновения в ткани) [13–15]. Помимо этого амоксицилин в первые 7 дней применения протокола приводит к значительному снижению бактериальной нагрузки и редукции образования в бактериальной клетке трансмембранных эффлюксных каналов для выведения антибиотиков, что значительно повышает эффективность последующего применения кларитромицина и метронидазола/тинидазола [15–17].
Эффективность гибридной схемы ЭТ
Согласно последнему систематическому обзору, опубликованному в 2016 г., включившем 12 исследований из различных регионов мира (Тайвань, Китай, Иран, Южная Корея, Испания, Италия), уровень эрадикации при использовании гибридной схемы ЭТ составил 77,6–97,4%, по данным анализа intention-to-treat (ITT, «все включенные пациенты»), и 82,6–99,1%, по данным анализа per-protocol (PP, «по протоколу»). Систематизация данных различных исследований показывает, что средний уровень эрадикации при применении гибридной схемы ЭТ составляет 85,1 (ITT) и 91,2% (PP) [18].
В целом эффективность гибридной терапии имеет существенные региональные отличия и требует дальнейшей валидации в различных популяциях. При ранжировании схем ЭТ по эффективности, предложенной специалистами Европейской группы по изучению Н. pylori (EHSG – European Helicobacter Study Group) [19], можно отметить, что гибридная схема ЭТ в подавляющем большинстве исследований продемонстрировала приемлемую (85–89%), высокую (90–95%) и очень высокую (≥95%) эффективность при анализе PP (см. таблицу).
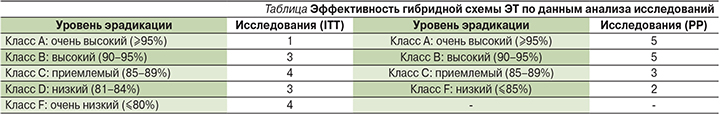
Эффективность ниже приемлемой, показанная в нескольких работах, по всей видимости, может быть ассоциирована с высоким уровнем полирезистентности к антибиотикам в исследуемых регионах. Согласно консенсусу Маастрихт-V (2015), двойная резистентность к кларитромицину и метронидазолу (>15%) снижает эффективность всех висмутнесодержащих схем ЭТ, включая гибридную схему ЭТ [4]. При анализе исследований эффективности гибридной схемы ЭТ, в которых оценивалась антибиотикорезистентность Н. pylori, показано, что эффективность ЭТ в отсутствие резистентности к кларитромицину и метронидазолу составляет 98,5%, при наличии изолированной резистентности к метронидазолу или кларитромицину – 92,9–97,6%, а при двойной резистентности к кларитромицину и метронидазолу – 80,0% [18].
Другим актуальным аспектом, потенциально оказывающим влияние на эффективность гибридной схемы ЭТ, является длительность протокола лечения. В исследовании, проведенном в Иране, показано, что сокращение курса терапии до 10 дней приводит к редукции эффективности примерно на 10% [20]. Однако в работе, выполненной на Тайване и в Китае, оценивающей эффективность 10-, 12- и 14-дневного курсов гибридной ЭТ, были продемонстрированы примерно эквивалентные результаты, превышающие 90% (анализ PP) [21]. Аналогично в несравнительных работах, проведенных в Южной Корее и Испании, были показаны приемлемые уровни эрадикации Н. pylori при применении 10-дневной гибридной схемы ЭТ, превышающие 85% (анализ PP) [22, 23]. Таким образом, выявленные региональные отличия при оценке эффективности более коротких курсов гибридной схемы ЭТ могут быть ассоциированы с различным паттерном резистентности к антибиотикам в исследуемых регионах.
Безопасность и переносимость гибридной схемы ЭТ
Общая частота регистрации побочных эффектов на фоне применения гибридной схемы ЭТ составила 14,5–67,5%. При систематизации данных различных исследований общий показатель частоты побочных эффектов составил 32,9% [18]. Побочные эффекты включали изменения вкусового восприятия, боль/дискомфорт в животе, тошноту, рвоту, диарею, головокружение, головную боль и другие жалобы, большинство из которых были легкой или умеренной степени выраженности (не влияющие или незначительно влияющие на повседневную деятельность). Лишь в 2,5% случаев выраженность побочных эффектов оказывала заметное влияние на ежедневную активность пациента и приводила к прекращению курса ЭТ. В свою очередь общий показатель переносимости протокола лечения составил 96,6% [18]. Таким образом, гибридная схема ЭТ продемонстрировала приемлемый профиль безопасности, сопоставимый с другими четырехкомпонентными протоколами антихеликобактерного лечения без препаратов висмута.
Сравнение гибридной терапии с другими режимами ЭТ
Классическая тройная терапия. В исследовании, проведенном в Испании, сравнивалась эффективность 10-дневной гибридной терапии по сравнению с 10-дневной классической тройной терапией. По результатам исследования эффективность гибридной терапии была значительно выше классической тройной терапии (ITT – 90,8 против 70,0%; р=0,002; PP – 93,9 против 72,4%; р=0,001). Отмечена хорошая переносимость обоих режимов (98,5 против 99,6%), в то время как общая частота развития побочных эффектов при использовании гибридной терапии была значительно выше (67,5 против 45,0%; р=0,012) [22].
Последовательная терапия. Эффек-тивность гибридной и последовательной терапии сравнивали в шести исследованиях. По результатам работ, проведенных на Тайване, Китае [8, 24, 25] и Иране [26], уровень эрадикации при использовании гибридной схемы ЭТ был значительно выше по сравнению с последовательной терапией. В двух исследованиях, проведенных в Италии [27, 28], эффективность последовательной терапии была незначительно выше. Подобный результат был также получен в исследовании, проведенном в Корее [29]. Систематизация данных показала, что уровень эффективности при применении гибридной терапии составил 87,8 (ITT) и 93,0% (РР), а при использовании последовательной терапии – 83,8 (ITT) и 86,6% (PP) [18]. В целом определено, что среди населения Азии эффективность гибридной терапии выше, тогда как среди населения Италии последовательная терапия более приемлемой. Показатель переносимости и профиль безопасности анализируемых схем ЭТ между группами существенно не различались.
«Одномоментная» терапия. Эффек-тивность гибридной и «одномоментной» терапии сравнивалась в пяти исследованиях. В исследовании, проведенном в Италии [28], при анализе PP уровень эрадикации на фоне применения 14-дневной гибридной терапии был значительно выше по сравнению с 5-дневной «одномоментной» терапией (без существенной разницы при анализе ITT). Однако в другом исследовании, проведенном в Италии [27], никаких существенных различий выявлено не было. По результатам исследования, проведенного в Испании и Италии [30], уровень эрадикации на фоне применения 14-дневного курса гибридной терапии был ниже по сравнению с 14-дневной «одномоментной» схемой ЭТ (анализ PP), в то время как существенного различия при анализе ITT выявлено не было. Аналогичные результаты были получены в двух других исследованиях [22, 23]. Объединенный анализ данных показал, что уровень эрадикации при использовании гибридной терапии составил 84,1% (ITT), 91,4 (РР) и 84,6 (ITT), 91,5% (РР) при применении «одномоментной» терапии. Таким образом, эффективность гибридной и «одномоментной» терапии фактически эквивалентная, однако переносимость и безопасность гибридной терапии несколько лучше – частота развития выраженных побочных эффектов примерно на 2,5% ниже [18].
Заключение
Таким образом, гибридная терапия – одна из наиболее перспективных схем ЭТ. Комплексное и последовательное действие нескольких антибактериальных препаратов, входящих в состав данного протокола лечения, обусловливает высокую эффективность эрадикации. Тем не менее эффективность и приемлемая безопасность, продемонстрированные в ряде стран Азии, Европы и Ближнего Востока, требуют дальнейшей валидации в других регионах мира.



