Применение современных режимов лекарственной терапии существенно улучшило результаты лечения метастатического колоректального рака (мКРР) и по мере накопления опыта привело к пониманию, что локализация первичной опухоли (ПО) имеет прогностическое значение. Разное эмбриональное происхождение проксимального и дистального отделов толстой кишки обусловливает ряд клинико-морфологических отличий в опухолях различных локализаций. Вследствие анатомических особенностей толстой кишки опухоли правого отдела клинически проявляются позднее и как следствие – могут быть выявлены на более поздней стадии ПО или диссеминированной болезни.
В настоящее время установлены генетические особенности и профили экспрессии белков и генов, наиболее свойственные для той или иной локализации ПО. У женщин чаще возникают опухоли проксимального отдела. При этой локализации выше частота возникновения низкодифференцированных аденокарцином или перстневидноклеточного рака [1]. Правосторонние опухоли, как правило, имеют относительно сохранный кариотип, обычно диплоидный.
В них чаще встречается микросателлитная нестабильность (MSI), экспрессия c-erbB2 в цитоплазме и рецепторах эпидермального фактора роста (EGFR) [2]. Дистально расположенным опухолям присущи комплексные хромосомные аномалии: в них выше частота мутаций р53, эспрессии циклооксигеназы-2, относительно высокая частота хромосомной нестабильности [3–6] и более высокие уровни экспрессии эпи- и амфирегулина [7]. Частота мутаций генов КRAS выше при локализации опухоли в правом углу [8, 9].
Особенностями молекулярного фенотипа рака правого и левого отделов толстой кишки частично может быть объяснено различие в эффективности анти-EGFR-препаратов [10]. Высокие уровни эндогенных лигандов EGFR ассоциированы с эффективностью анти-EGFR-агентов, а низкий их уровень – с устойчивостью к EGFR-ингибиторам. Метилирование островков CpG (эпигенетический механизм генного слайсинга) чаще наблюдается при правосторонней локализации. Метилирование промоутера EGFR может приводить к снижению экспрессии EGFR [11], обусловливая резистентность к анти-EGFR-препаратам. В свою очередь левосторонние опухоли характеризуются наличием «канонического» CMS2-подтипа эпителиальной активации, определяющей большую чувствительность к ингибированию EGFR [12]. Ранее было показано, что проксимальные опухоли толстой кишки к терапии фторпиримидинами более чувствительны, чем дистальные, чаще резистентностны к фторурацилу и его аналогам [13, 14].
Современные режимы лечения мКРР включают фторпиримидины, оксалиплатин, иринотекан и моноклональные антитела (MAB, анти-VEGF или анти-EGFR). Результаты подгрупповых анализов ряда исследований, выявившие значимую разницу в медианах общей (ОВ) и беспрогрессивной выживаемости (ВБП), зависящей от локализации ПО, обозначили новую проблему – рационального применения MAB, особенно при ПО в правом отделе толстой кишки.
В исследовании II фазы AIO KRK-0104 [15] в I линии лечения сравнивали эффективность двух комбинаций: (№ 1-CAPIRI) цетуксимаба (400 мг/м2), капецитабина (1600 мг/м2) и иринотекана (200 мг/м2) с (№ 2-CAPOX) цетуксимабом, капецитабином (2000 мг/м2) и оксалиплатином (130 мг/м2). Набор больных был проведен в 2004–2006 гг.
В подгрупповом анализе оценили связь локализации ПО и статуса KRAS. Из 146 больных у 100 ПО локализовалась слева. У 68 (68%) из них в генах KRAS (12/13-й кодоны) мутаций не обнаружено, у 32 (32%) были мутации KRAS; мутации BRAF – у 6%. Женщины составили в этой подгруппе 23%. Число пациентов, получивших режимы CAPIRI и CAPOX, было сравнимым (52 и 48 % соответственно).

У 46 больных ПО находилась справа, из них у 27 (58,7%) ген KRAS был не мутирован, у 19 (41%) мутирован; BRAF-мутация встречалась часто – в 24%; доля женщин среди таких больных была выше (39 против 23%); соотношение режимов было одинаковым в обеих подгруппах CAPIRI/CAPOX – 52/48%. При оценке медианы ОВ было продемонстрировано преимущество опухолей левого отдела толстой кишки. В общей популяции локализация ПО слева влияла на увеличение медианы ОВ до 26,3 месяца против 14,8 (p=0,016, ОР=0,63). В отсутствие мутации в генах KRAS в левосторонних опухолях медиана ОВ увеличивалась до 29,0 месяцев против 13,0 – в правосторонних (p<0,001, ОР=0,42). В случаях выявления мутаций KRAS различий в ОВ не было (19,7 против 18,9 месяца) Закономерно, что при локализации опухолей слева мутации в генах KRAS отрицательно влияли на медиану ОВ по сравнению с отсутствием мутаций. При локализации опухолей справа разница в медианах ОВ не выявлена, возможно из-за небольшого числа больных.
Анализ ВБП также продемонстрировал преимущество опухолей левосторонней локализации. Во всей популяции медиана ВБП при локализации опухоли слева была выше, составив 7,8 против 5,2 месяца (p=0,02, ОР=0,67). При немутированном гене KRAS – 8,4 против 4,6 месяца (p=0,007, ОР=0,54), при мутированном гене статистических различий не получено – 5,8 против 7,5 месяцев.
Мутации в гене BRAF V600E выявлялись чаще при правосторонней локализации (24 против 6%). В отсутствие мутаций в генах BRAF и KRAS (n=79) медиана ВБП для диссеминированных правосторонних опухолей была 5,9 месяца, для левосторонних 8,2 (p=0,47, ОР=0,81); медиана ОВ – 16,2 против 27,3 месяца (p=0,11, ОР=0,60). При оценке частоты эффекта (правый угол против левого) достоверной разницы не было, результаты были закономерно хуже при наличии мутации KRAS. Представленные результаты свидетельствуют о целесообразности использования цетуксимаба в лечении диссеминированных левосторонних опухолей. Применение цетуксимаба позволяет достигать высоких значений ОВ и ВБП в отсутствие мутаций в генах KRAS. В свою очередь на метастазы правосторонних опухолей в случае отсутствия мутаций KRAS применение цетуксимаба существенного влияния не оказывало – нет разницы в медианах выживаемости. Помимо этого не представляется возможным проследить влияние режима химиотерапии на основе иринотекана или оксалиплатина [15].
Аналогичная связь эффективности цетуксимаба и локализации ОП была отмечена в работах Missiaglia et al. (2013) и Brule et al. (2013) [16, 17]. Полученные результаты позволяют предположить, что при метастазах ПО правосторонней локализации эффективность анти-EGFR препаратов снижается. Данные, подтвердившие это положение, были представлены R. Moretto et al. [18], где изучалось влияние расположения ПО на эффективность анти-EGFR-терапии в однородной популяции. В небольшом исследовании 75 пациентов с отсутствием в опухоли мутаций RAS и BRAF при прогрессировании болезни на фоне химиотерапии получали анти-EGFR-препараты самостоятельно или в комбинации с иринотеканом (при рефрактерности к нему). У 14 больных ПО локализовалась в правом отделе, у 61 – в левом. При правосторонней локализации чаще выявлялись синхронные метастазы (р=0,04) и низкодифференцированные опухоли (р=0,0097) (табл. 1).
Необходимо отметить, что большая часть больных получала лечение после прогрессирования в рамках исследования при левосторонней локализации ПО. Судя по представленным результатам, отдаленные метастазы при левосторонних опухолях появлялись позже; частота достижения лечебного эффекта была выше, достоверно и значимо выше была медиана ВБП без статистически достоверного влияния на медиану ОВ. Можно предположить, что это свидетельствует о худшем прогнозе метастатической болезни в популяции больных с локализацией ПО справа. Необходимо отметить, что в ретроспективный анализ были включены пациенты только с «диким» типом генов, имевших значение для эффективности анти-ЕGFR-терапии. Поэтому различия в частоте мутаций этих генов не могли влиять на более низкую эффективность анти-ЕGFR-терапии при метастазах правосторонних опухолей. Важно также, что в анализ были включены только химиорезистентные больные, что позволяет судить об истинном влиянии анти-EGFR-препаратов на эффективность и ВБП в зависимости от локализации ПО. При этом отсутствие контрольной группы (не получавшей терапии анти-EGFR-препаратами) снижает ценность представленного исследования.
Наличие условной контрольной группы было представлено в ретроспективной работе китайских авторов [19], оценивших связь локализации ПО с эффективностью цетуксимаба. Больные получали различные схемы химиотерапии (нерандомизированное исследование), части из них был назначен цетуксимаб в комбинации с капецитабином или режимом XELOX, что не рекомендовано в комбинации с анти-EGFR-препаратами. К правосторонним опухолям авторы отнесли новообразования толстой кишки, локализованные в слепой и до селезеночного угла ободочной, к левосторонним – все опухоли, находившиеся ниже. Таким образом, к правосторонним опухолям была отнесена поперечно-ободочная кишка, т.е. включены больные с промежуточным прогнозом.
Химиотерапию с включением цетуксимаба получили 206 больных, из них 110 в первой линии и 96 во второй. Контрольная группа была представлена 210 пациентами, получившими только химиотерапию, из них 117 в первой линии, 93 во второй. Обе группы были сбалансированы по клиническим характеристикам. В первой линии большинство пациентов в группе химиотерапии получали оксалиплатин: 53,8 против 33,6% в группе получавших химиотерапию в комбинации с цетуксимабом (достоверный дисбаланс, р=0,003). Во второй линии у 71,9% больных, получавших химиотерапию в комбинации с цетуксимабом, было поражение только одного органа и только у половины (51,6%, р=0,005) пациентов в группе химиотерапии без цетуксимаба. Также во второй линии лечение химиотерапией в комбинации с цетуксимабом было более длительным (8 против 6 циклов, р=0,031) по сравнению с пациентами, получавшими только химиотерапию.
Исходные характеристики пациентов и режимы лечения при правосторонних и левосторонних опухолях были в целом сбалансированы. Пропорция муцинозных форм и перстневидноклеточного рака была выше при локализации справа в группе химиотерапии в комбинации с цетуксимабом (21,2 против 2,6%, р=0,003). В группе пациентов с локализацией опухолей слева, получивших только химиотерапию, чаще определяли множественные метастазы (51,8 против 29,5%, р=0,015). Большинство больных с правосторонней локализацией в первой линии получали иринотекан+цетуксимаб чаще, чем оксалиплатин+цетуксимаб (81,8 против 59,7%, р=0,029), только иринотекан или оксалиплатин – 55,7 и 35,7% соответственно (р=0,041). Наличие мутаций в генах RAS/BRAF не изучали, исследовали только гены KRAS.
При локализации опухолей слева в группе больных, получавших химиотерапию в комбинации с цетуксимабом в 1-й линии, частота эффекта была выше, чем в группе химиотерапии без цетуксимаба (49,4 против 28,6%, р=0,005). При локализации справа результаты различались недостоверно (36,4 против 26,2%, р=0,349). При сравнительном анализе частота объективного ответа при лечении метастазов не зависела от локализации ПО как в первой группе (28,6 против 26,2%, р=0,837), так и во второй (49,4 против 36,4%, р=0,296). При локализации ПО в правом отделе включение в режим цетуксимаба не привело к статистически значимому изменению медианы ВБП (справа 5,7 против 5,6 месяца слева) и ОВ (25,1 против 19,8 месяца). В свою очередь достоверное увеличение ВБП (9,1 против 6,2 месяца, р=0,002) и ОВ (28,9 против 20,1 месяца, р=0,036) достигнуто пациентами первой группы по сравнению с больными второй группы, при условии, что ПО локализовалась слева.
Во второй линии лечения эффективность в обеих группах не имела статистических различий вне зависимости от включения в режим цетуксимаба. При левосторонней локализации была только тенденция к увеличению частоты эффекта в первой группе. Во II линии при правосторонней локализации влияния на ВБП и ОВ цетуксимаба не было выявлено; при левосторонней была отмечена только тенденция к увеличению ВБП и достоверное увеличение ОВ (17,1 против 12,4 месяца, р=0,047). Не было установлено различий в выживаемости, зависящей от локализации ПО в группах, получивших только цитостатики как в первой, так и во второй линиях. Соответственно, если при левосторонней локализации назначение цетуксимаба было рационально и приводило к улучшению результатов лечения, то при правосторонней его включение в режим достоверно не изменяло частоту достижения объективного эффекта и сроков выживаемости.
Необходимо отметить, что в первой линии (до включения в проект) больными при правосторонней локализации бевацизумаб применялся чаще, чем при левосторонней, – в 39,3 против 23,5%. Можно предположить, что снижение эффективности цетуксимаба происходит при назначении его после бевацизумаба, однако это положение дискутабельно. Аналогичная связь локализации ПО с эффективностью цетуксимаба для химиорефрактерных больных была представлена в работе S.Y. Brule и соавт. [20]. При левосторонней локализации цетуксимаб приводил к достоверному увеличению ВБП (5,4 против 1,8 месяца) по сравнению с группой симптоматического лечения. При метастазах ПО справа влияния на ВБП не было установлено (1,9 против 1,9 месяца).
На эффективность цетуксимаба при правосторонней локализации, возможно, негативно влияет и достоверно более высокая частота выявления микросателлитной нестабильности (MSI) (20 против 1%) [21]. Влияние локализации ПО на эффективность анти-VEGF-препарата бевацизумаба оценено в ретроспективном датском популяционном исследовании [22].
В анализ включены 880 больных, 667 из них получали капецитабин, оксалиплатин и бевацизумаб (CAPEOX+БЕВ) и 213 – режим без бевацизумаба (CAPEOX). Больные с ПО в сигмовидной или прямой кишке были отнесены к группе с левосторонней локализацией, в слепой и восходящей – с правосторонней. В группе CAPEOX+БЕВ в последующих линиях больные реже получали иринотекан и цетуксимаб. Для пациентов, получавших только CAPEOX, эффективность не зависела от локализации ПО. В свою очередь в группе CAPEOX+БЕВ медианы ВБП и ОВ были достоверно выше при локализации ПО слева: 9,3 против 7,2 месяца (ОР=0,68) и 23,5 против 13,0 месяца (ОР=0,68) соответственно. Обращают на себя внимание сравнимые значения ВБП при правосторонней локализации в группах CAPEOX+БЕВ и CAPEOX – 7,2 и 6,5 месяца соответственно, что влечет за собой вопрос о целесообразности применения бевацизумаба в данной ситуации.
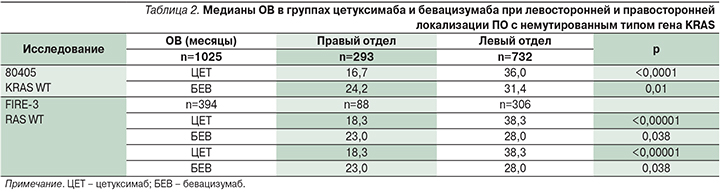
Проведенный подгрупповой анализ результатов крупного исследования CALGB/SWOG 80405 также продемонстрировал существенную разницу в ОВ при локализации ПО в левом (нисходящий отдел, сигмовидная и прямая кишка) и правом отделах (слепая и восходящая кишка) кишечника [23]. В первой линии больные получали режимы FOLFIRI или FOLFOX (на выбор исследователя) с включением цетуксимаба или бевацизумаба (рандомизация). Подгруппы с право- и левосторонней локализацией были сбалансированы по клиническим характеристикам. Медиана ОВ в общей популяции при левосторонней локализации (33,3 и 19,4 месяца, р<0,0001) была достоверно выше, чем при правосторонней.
У получавших бевацизумаб ОВ при правосторонней локализации была достоверно ниже, чем при левосторонней (24,2 против 31,4 месяца, р=0,01). Та же закономерность прослеживалась и в группе цетуксимаба (16,7 против 36,0 месяца, р<0,0001). В работе не оценена статистическая разница ОВ в группах, получавших бевацизумаб и цетуксимаб, при локализации в правом отделе, но абсолютная разница составила 7,5 месяцев в пользу применения первого.
Аналогичная закономерность была выявлена и при анализе ВБП, где во всей популяции медианы были достоверно ниже при локализации в правом отделе (8,9 против 11,7 месяца, р=0,0006); в группе цетуксимаба (7,8 против 12,4 месяца, р<0,0001) и статистически не значимо в группе бевацизумаба (9,6 против 11,2 месяца, р=0,55). Полученные закономерности были подтверждены данными международного исследования FIRE-3 с аналогичным дизайном. В этих исследованиях интерес представляют результаты подгруппового анализа эффективности терапии бевацизумабом и цетуксимабом для больных с немутированными генами KRAS. Данные ОВ были сопоставимыми в обоих исследованиях, эффективность химиотерапии в комбинации с цетуксимабом была ниже при правосторонних опухолях, менее весомые различия были отмечены при использовании химиотерапии и бевацизумаба (табл. 2).
В исследовании CALGB/SWOG 80405 был проведен анализ медиан ОВ при применении того или иного MAB в сбалансированных по клиническим характеристикам и режимам лечения группах больных. При локализации опухоли в правом отделе было преимущество бевацизумаба, ОВ: 30,44 против 25,48 месяца; ОР – 1,26 (95% ДИ – 0,98–1,63), p=0,08. При локализации слева – явное преимущество цетуксимаба, ОВ: 40,46 против 35,99 месяца; ОР – 0,82 (95% ДИ – 0,69–0,96), p=0,01. Таким образом, результаты представленных исследований свидетельствуют о значительно худшем прогнозе эффективности комбинаций с включением MAB при метастатической опухоли с локализацией ПО в правом отделе толстой кишки. У больных «таргетной» популяции с отсутствием мутаций RAS эффективность цетуксимаба уступает таковой бевацизумаба. При правосторонней локализации ПО, согласно предварительным данным французских исследователей, при наличии мутации BRAF скорее более рационален трехкомпонентный режим FOLFIRINOX с включением бевацизумаба [24]. При локализации ПО в левых отделах у больных с немутированными генами семейства RAS явное преимущество в комбинации с химиотерапией имеет цетуксимаб, позволяя достигать максимальных значений медианы ОВ.



