Последнее десятилетие может рассматриваться как начало инкретиновой эры в терапии сахарного диабета 2 типа (СД2). Фармакологическая реализация инкретинового эффекта позволила стремительно и достаточно широко использовать инкретины в мировой клинической диабетологической практике. Важной отличительной особенностью данного инновационного класса сахароснижающих препаратов является одновременное позитивное воздействие на два патогенетических звена СД2. Инкретины не только способствуют увеличению постпрандиальной глюкозозависимой секреции инсулина β-клетками поджелудочной железы, но и обусловливают
снижение синтеза α-клетками контринсулярного гормона глюкагона и, следовательно, интенсивности процесса печеночного глюконеогенеза.
Основными инкретинами энтероинсулярной оси являются глюкагоноподобный пептид-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП). Ингибирование дипептидилпептидазы-4 (ДПП-4), осуществляемое ингибиторами ДПП-4 (глиптинами), позволило пролонгировать время полураспада нативного ГПП-1 с нескольких минут до нескольких часов (рис. 1). Необходимо отметить, что терапевтический потенциал глиптинов определяется физиологической концентрацией ГПП-1.
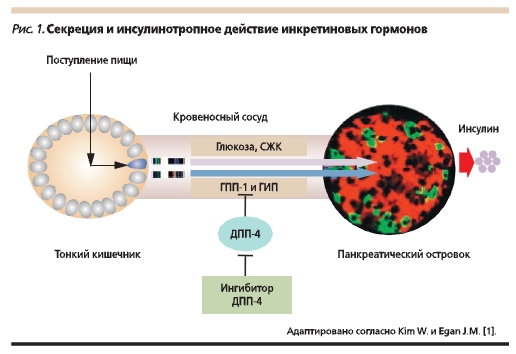
Персонифицированная медицина предполагает индивидуализацию назначения терапии в зависимости от длительности СД2, качества гликемического контроля, риска развития гипогликемий, осложнений СД и имеющихся коморбидных заболеваний, возраста (ожидаемой продолжительности жизни), анамнестических особенностей [2].
Каким требованиям должны отвечать современные сахароснижающие препараты?
• Несомненно и прежде всего – это высокий сахароснижающий потенциал, сохраняющийся на протяжении длительного периода использования.
• Снижение уровня гликемии на основе максимально физиологичного воздействия, не вызывающего истощения функциональной активности β-клеток поджелудочной железы.
• Снижение вариабельности гликемии и устранение пиков постпрандиальной гипергликемии.
• Низкая частота развития гипогликемических эпизодов.
• Высокая степень безопасности.
• Отсутствие снижения качества жизни пациента.
• Приверженность пациента к терапии, удобная фармакологическая форма, возможность производства фиксированных комбинаций, минимизация числа пропущенных приемов.
• Положительные негликемические эффекты.
• Отсутствие набора массы тела.
Согласно принятым в большинстве стран мира консенсусам и стандартам по ведению пациентов с СД2,
препаратом первого выбора в терапии СД2 остается метформин. Установлена его положительная роль
в снижении глюконеогенеза, инсулинорезистентности и риска развития онкологических заболеваний. Тем не менее для каждого десятого пациента вследствие развития нежелательных побочных эффектов со стороны желудочно-кишечного тракта прием метформина оказывается неприемлемым. Таким образом, сохраняется проблема выбора препарата второй линии на фоне приема метформина, препарата для стартовой терапии в комбинации с метформином, а также препарата
первой линии в случае непереносимости метформина. В соответствии с обновленным консенсусом ADAEASD (American Diabetes Association-European Association for the Study of Diabetes, 2012) ингибиторы ДПП-4 являются одним из перспективных терапевтических подходов к выбору препаратов первой и второй линий терапии [3].
Рассмотрение рынка сахароснижающих препаратов свидетельствует о том, что выбор клиницистов все
чаще смещается в сторону назначения пациентам с СД2 ингибиторов ДПП-4. Наибольший опыт, накопленный в ходе проведения клинических испытаний (как преклинических, так и постмаркетинговых), основан на оценке и безопасности ингибитора ДПП-4 ситаглиптина, первого и наиболее изученного представителя класса глиптинов. Препарат Янувия (ситаглиптин, Merck Sharp & Doum, США) был утвержден Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) в 2006 г., Европейским медицинским агентством в 2007 г. Продолжающиеся и уже проведенные рандомизированные клинические исследования (РКИ) с участием ситаглиптина составляют мощную доказательную базу, которая позволяет всесторонне очертить эффективность
сахароснижающего действия, негликемические эффект и безопасность его использования. Следует отметить, что ситаглиптин используется в качестве интервенционного или эталонного препарата сравнения. Изучено использование ситаглиптина в виде монотерапии, комбинации с метформином, двойных и тройных комбинаций пероральных сахароснижающих препаратов, комбинации с инсулином.
Постмаркетинговые исследования ситаглиптина продолжаются. Следует отметить, что клиническая эффективность комбинации ситаглиптина с препаратом первого выбора метформином послужила предпосылкой к созданию первой фиксированной комбинации ингибитора ДПП-4 и метформина –
препарата Янумет (Janumet, Merck Sharp & Doum, США).
Эффективность и безопасность класса ингибиторов дпп-4
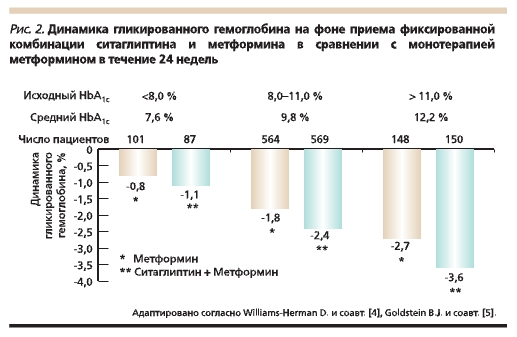
Имеется большая доказательная база эффективности клинического использования стартовой комбинации ситаглиптина и метформина. Показано, что степень снижения уровня гликированного гемоглобина (HbA1c) зависит от его исходного уровня. Так, в группе пациентов с плохим гликемическим
контролем на фоне приема в течение 24 недель стартовой комбинированной терапии препаратом Янумет она составила -3,6 % (рис. 2) [4, 5].
При проведении теста со стандартной пищевой нагрузкой продемонстрировано более выраженное
улучшение функции β-клеток при использовании комбинированной терапии по сравнению с монотерапией. Данное положение подтверждено оценкой базального, статического и динамического компонентов секреции инсулина. Выявлено улучшение функциональной активности β-клеток как натощак, так и в постпрандиальный период. Устранение глюкотоксичности и улучшение чувствительности β-клеток обусловливают также и устранение постпрандиальной гипергликемии, вносящей основной вклад в процесс гликирования и вызывающей негативные последствия за счет окислительного стресса [6].
В рандомизированном двойном слепом плацебо-контролируемом РКИ среди пациентов, имевших при включении в исследование уровень HbA1c > 8,0 %, в ходе эугликемического гиперинсулинемического и гипергликемичского клэмпа выявлено улучшение первой и второй фаз секреции инсулина на фоне приема в течение года комбинации “ситаглиптин + метформин”. Продемонстрировано снижение плазменного уровня маркеров инсулинорезистентности – ретинолсвязывающего протеина, висфатина и хемерина [7].
Необходимо отметить, что нормализация гликемического контроля у пациентов, принимающих ингибиторы ДПП-4, не сопровождается увеличением частоты развития гипогликемических эпизодов – важного параметра оценки качества лечения и безопасности сахароснижающей терапии.
Наиболее часто используемыми в диабетологии на протяжении многих десятилетий остаются препараты сульфонилмочевины (ПСМ), привлекательные вследствие мощного сахароснижающего действия в постпрандиальный период и низкой стоимости. Однако эффективное сахароснижающее действие секретагогов обусловлено нефизиологичным усилением секреции инсулина, сопровождающимся истощением функции инсулярного секреторного аппарата β-клеток и применением инсулинотерапии. Так, в ретроспективном когортном исследовании, оценивавшем частоту развития сердечно-сосудистых заболеваний (острого инфаркта миокарда, инсульта и летальных исходов) у 253 690 пациентов, рассчитан скорректированный риск их развития, составивший 1,26 при использовании глибенкламида и 1,15 – глипизида при их стартовом назначении по сравнению с метформином [8]. В крупномасштабном когортном исследовании, проведенном в США, продемонстрировано, что использование ПСМ (98 665 пациентов) по сравнению с применением метформина (155 025) ассоциировалось с повышенной опасностью развития сердечно-сосудистых событий и смертности – скорректированное различие роста заболеваемости соответствовало 2,2 (95 % доверительный интервал [ДИ] – 1,4–3,0) [9]. Два недавно проведенных в Великобритании исследования, ретроспективно рассмотревших огромную базу данных UK-GPRD (General Practice Research Database), подтвердили положение о развитии худших исходов при приеме ПСМ как в виде монотерапии, так и в комбинации с метформином [10]. Кроме того, пациенты с СД2, получавшие
инсулинотерапию, имели повышенный риск развития осложнений СД, онкологических заболеваний, а также худшие показатели общей смертности [11]. Следовательно, при выборе препаратов не следует ограничиваться рассмотрением лишь их сахароснижающего действия – должна быть проведена интерпретация и других характеристик.
Установлено, что использование глибенкламида повышает уровень сердечно-сосудистого риска вследствие нарушения процесса ишемического прекондиционирования миокарда [12]. Как правило, прием ПСМ сопровождается набором массы тела, усугубляющим инсулинорезистентность. Кроме того, для пациентов с впервые установленным диагнозом СД2 применение ПСМ (как правило, в комбинации с метформином) часто оборачивается развитием гипогликемических эпизодов и снижением приверженности пациента лечению.
Использование ингибиторов ДПП-4 возможно в качестве альтернативы ПСМ как при выборе препарата второй линии сахароснижающей терапии, так и в комбинации с секретагогами. У пациентов с более длительным анамнезом СД2 включение ингибиторов ДПП-4 в схему сахароснижающей терапии позволяет снижать дозу ПСМ и смягчать их негативное влияние на β-клетки.
В двойном слепом плацебоконтролируемом исследовании 516 пациентам, придерживавшимся монотерапии метформином и имевшим неудовлетворительный контроль гликемии (средний HbA1c – 7,5 %), в течение 30 недель был назначен в дополнение к метформину ситаглиптин в дозе 100 мг/сут, другим 519 пациентам –глимепирид. При сходном снижении уровня гликемии (динамике HbA1c и доли пациентов, достигших в конце исследования HbA1c ≤ 7 %) выявлена меньшая частота развития гипогликемических состояний в группе инкретина.
В соответствии с необходимостью всестороннего рассмотрения эффективности и безопасности сахароснижающей терапии большое значение в настоящее время приобретает исследование комбинированных критериев, предусматривающих одновременное достижение нескольких “целей” включенными в исследование пациентами. Так, комбинированный критерий “достижение целевого уровня HbA1c (HbA1c ≤ 7 %) без развития гипогликемии” составил 93 % в группе ингибитора ДПП-4 и 78 % – секретагога. В этом исследовании на фоне приема ситаглиптина зафиксировано снижение массы тела, в то время как использование глимепирида приводило к ее набору (-0,8 и +1,2 кг соответственно, p < 0,001) [13].
В другом исследовании с аналогичным дизайном при назначении ситаглиптина (100 мг/сут, 248 пациентов) и глипизида (5–20 мг/сут, 256 пациентов) было подтверждено долгосрочное (2 года) и сопоставимое улучшение гликемического контроля в обеих группах. Показано улучшение функциональной активности β-клеток при приеме ситаглиптина и ее снижение у пациентов, принимавших ПСМ (рис. 3а). Группа пациентов, достигших целевого уровня HbA1c ≤ 7 %, составила 63 и 59 % на фоне приема ситаглиптина и глипизида соответственно. Необходимо подчеркнуть, что развитие гипогликемических состояний у пациентов, получавших ситаглиптин, отмечалось более редко (5 по сравнению с 34 %). Выявлено и снижение массы тела при приеме глиптина (-1,6 кг)
по сравнению с ее увеличением (+0,7 кг) при приеме секретагога (рис. 3б) [14].
Рисунок 3. Динамика гликированного гемоглобина (а0 и массы тела (б) на фоне приема метформина с ситаглиптином или препаратом сульфонилмочевины в течение 1 года терапии.
Необходимо подчеркнуть целесообразность использования комбинации препаратов инсулина и ингибиторов ДПП-4 [16]. В РКИ, в котором были сопоставлены две тактики – назначение ингибитора ДПП-4 ситаглиптина в дополнение к инсулинотерапии и увеличение дозы инсулина. Продемонстрирован более выраженный сахароснижающий эффект глиптина в комбинации с инсулином, сопровождающийся меньшим риском развития гипогликемических состояний и увеличением дозы инсулина на 25 % при инсулинотерапии больных второй группы (рис. 4) [17].
Рисунок 4. Процент пациентов, достигших целевого значения HbA1 < 7,0%, в том числе без тяжелых гипогликемий, и частота развития эпизодов гипогликемий(всех и тяжелых, событие/пациенто-лет) в течение 24 недель при назначении ситаглиптина в дополнении к инсулинотерапии в сравнении с увеличением дозы инсулина.
Важно отметить, что достигнутая на фоне приема ситаглиптина стабилизация гликемии сохраняется длительно.
Безопасность использования ингибиторов дпп-4
Риск сердечно-сосудистых заболеваний у пациентов с СД2 повышен в 2 раза по сравнению с популяцией людей без диабета. Основные факторы риска развития сердечно-сосудистых катастроф: висцеральное ожирение, развитие гипогликемических эпизодов, дислипидемия.
Важным негликемическим эффектом ингибиторов ДПП-4 является нейтральное влияние на массу тела. Более того, в ряде исследований выявлена отрицательная динамика данного параметра. Установлено, что снижение массы тела на фоне приема ситаглиптина ассоциируется не с глюкозурией,
а со снижением потребления пищи и увеличением расхода энергии [18].
Показано, что повышение частоты развития тяжелых гипогликемий дополнительно увеличивает риск сердечно-сосудистой смертности еще в 2–4 раза. При рассмотрении показателей гликемического контроля на фоне приема ситаглиптина было показано снижение массы тела и частоты развития гипогликемий. Важно, что прием ингибитора ДПП-4 сопровождается снижением частоты ночных гипогликемий. В табл. 1 представлены данные многоцентрового открытого РКИ EASIE (Evaluation of
insulin glargine versus Sitagliptin in Insulinnaive patients), продемонстрировавшего частоту развития ночных гипогликемий при применении ситаглиптина и инсулина гларгин пациентами с неудовлетворительным гликемическим контролем на фоне приема метформина в зависимости от степени их тяжести [19].
Таблица 1. Частота развития ночных симптоматических гипогликемий и их стратификация в группах пациентов, принимавших комбинации “метформин + инсулин гларгин” и “метформин + ситаглиптин” в течение 24 недель.
В настоящее время негативное влияние СД2 не ограничивается лишь процессами, происходящими в миокарде. В последнее десятилетие получила признание предложенная M. Naghavi в 2003 г. концепция “уязвимого пациента”, согласно которой патофизиологические изменения имеют место как в миокарде, так и в стенке сосудов и в циркулирующей по ним крови (рис. 5). Изучение прямых и непрямых эффектов ГПП-1 на миокард является целью многочисленных РКИ, в т. ч. экспериментальных с использованием животных моделей (рис. 6).
Рисунок 5. Сердечно-сосудистые проблемы пациента с сахарным диабетом 2 типа (концепция"уязвимого пациента" M. Naghavi, 2003).
Рисунок 6. Цитопротекторное действие ГПП-1, оказываемое на миокард.
Необходимо отметить, что ГПП-1 под действием фермента ДПП-4 переходит из активной формы амида
ГПП-1 (7–36) в неактивную ГПП-1 (9–36), также способную оказывать кардиопротективное действие. Таким образом, действие ГПП-1 характеризуется комбинированным эффектом – прямым воздействием на рецепторы ГПП-1, а также системными и сосудистыми эффектами, вносящими вклад в
улучшение функции кардиомиоцитов.
Прямой эффект ГПП-1 (7–36) обусловлен его воздействием на рецепторы ГПП-1, расположенные на
поверхности кардиомиоцитов, что обусловливает его цитопротективный эффект. Основным сигнальным путем, активируемым ГПП-1 (7–36), является путь RISK-киназы (Reperfusion Injury Salvage Kinase), фосфоинозитол3-киназы и внеклеточных сигналрегулирующих киназ ERK1/2. Кроме того, ГПП-1 (7–36) способствует улучшению функции сердечно-сосудистой системы вследствие снижения активации провоспалительных клеток, процессов микроциркуляции в миокарде, а также повышению захвата глюкозы кардиомиоцитами. В дальнейших исследованиях предстоит изучить влияние терапии ГПП-1 (7–36) на ремоделирование миокарда, прежде всего на развитие гипертрофии и некроза кардиомиоцитов, коллагенообразование и фиброз миокарда [20].
Непрямой эффект на миокард обусловлен воздействием ГПП-1 (9–36), также обладающим кардиопротективной активностью и образующимся из ГПП-1 (7–36) под действием ДПП-4. Показано, что на плазменный уровень ГПП-1 (9–36) оказывает влияние терапия инкретинами [21]. ГПП-1 (9–36)
активирует сигнальный путь NO/цГМФ, способствует улучшению систолической функции левого желудочка. К другим эффектам относятся повышение миокардиального захвата глюкозы, уменьшение системного сосудистого сопротивления, снижение плазменной концентрации норадреналина и его
метаболизма в миокарде [22].
Таблица 2. Отсутствие повышенного риска развития новообразований на фоне приема ситаглиптина.
Анализ сердечно-сосудистых событий ишемического типа у 5429 пациентов, принимавших ситаглиптин, и 4709 пациентов, получавших другую терапию (плацебо, ПСМ, инсулин, метформин, глитазоны или их комбинации), продемонстрировал снижение кардиоваскулярного риска до 0,68
(0,41–1,12) на фоне приема ситаглиптина [23].
Обобщенный анализ данных 25 РКИ подтвердил, что использование ситаглиптина безопасно и не увеличивает кардиоваскулярный риск для пациентов с СД2. Рост сердечно-сосудистой заболеваемости, рассчитанный на 100 пациенто-лет и скорректированный по длительности сахароснижающей терапии, соответствовал нулевому при приеме ситаглиптина и 0,86 – в случае приема ПСМ. Относительный рост сердечно-сосудистой заболеваемости при применении ситаглиптина и
секретагогов соответствовал 0,00 (95 % ДИ – 0,00–0,31), подтвердив ассоциацию сердечно-сосудистых событий с приемом секретагогов [24].
Нецелевыми субстратами ДПП-4 являются SDF-1α (лиганд для CXCR4-рецептора на поверхности стволовых клеток костного мозга) и мозговой Na-уретический пептид. В проведенном плацебо-контролируемом РКИ 3-й фазы SITAGRAMI-Trial (Safety and efficacy of SITAgliptin plus GRanulocyte-colony-stimulating factor in patients suffering from Acute Myocardial Infarction) установлено увеличение кардиального хоминга клеток-предшественников у пациентов, перенесших острый инфаркт миокарда. Кроме того, показано улучшение сердечной деятельности и повышение показателей выживаемости при приеме комбинации ситаглиптина и колониестимулирующего фактора гранулоцитов в течение первых 6 недель после инфаркта миокарда [25].
Дислипидемия рассматривается как фактор, значительно увеличивающий риск развития сердечно-сосудистых заболеваний. Более того, нарушение параметров липидного спектра сопровождается развитием липотоксичности, ассоциируемой со снижением инкретинового эффекта даже при
хорошем гликемическом контроле (рис. 7).
Рисунок 7. Вклад глюко- и липотоксичности в снижение инкретинового эффекта.
Отмечено, что при сопоставимой эффективности гликемического контроля различные сахароснижающие препараты могут оказывать разнонаправленное влияние на кардиоваскулярный риск. Так, в исследовании итальянских ученых, продолжавшемся 2 года, прием ситаглиптина способ
ствовал снижению уровня общего холестерина на 13 %, липопротеидов низкой плотности – на 20,4 %, триглицеридов – на 32,3 % и увеличению липопротеидов высокой плотности – на 13,6 % [27].
Неалкогольная жировая болезнь печени (НАЖБП) ассоциируется с развитием инсулинорезистентности, ожирения, дислипидемии, СД2 [28]. В настоящее время эффективность
лечения НАЖБП продолжает изучаться. В пилотном исследовании показано улучшение печеночных маркеров НАЖБП и гликемического контроля у пациентов с СД2, в течение 4 месяцев принимавших ситаглиптин [29]. В другом ретроспективном исследовании, проведенном той же группой авторов,
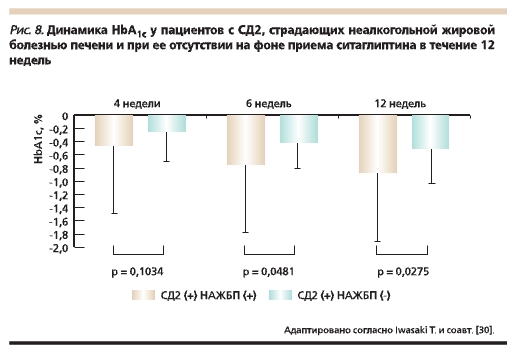
с дизайном “случай–контроль” приняли участие 20 пациентов, страдавших СД2 и НАЖБП, и 85 пациентов с СД2 без патологии печени. Выявлена более выраженная положительная динамика
гликемического контроля у пациентов, принимавших ситаглиптин, при сочетании СД2 и НАЖБП (7–9 баллов по шкале Чайлд–Пью) (рис. 8), а также отсутствие побочных эффектов, связанных с терапией ситаглиптином. Необходимо отметить, что в отличие от ситаглиптина ПСМ метаболизируются в печени и ухудшают прогноз НАЖБП [30].
Панкреатит, ассоциированный с приемом глиптинов, рассматривается в рамках побочных явлений при
проведении РКИ и постмаркетинговых исследований. В мета-анализе S.S. Engel, обобщившем данные 19 РКИ, показана сопоставимая частота развития панкреатита у пациентов, получавших терапию ситаглиптином, по сравнению с больными, не применявшими инкретины. На фоне приема ситаглиптина отсутствовали случаи геморрагического и некротического панкреатитов и летальные исходы [31].
Хроническая почечная недостаточность. Ситаглиптин выводится почками (80 % в неизмененном виде). У пациентов со скоростью клубочковой фильтрации (СКФ), соответствующей диапазону от 30 до < 50 мл/мин/1,78 м2, доза ситаглиптина снижается до 50 мг/сут, а при СКФ < 30 мл/мин/1,78
м2 – до 25 мг/сут. В недавно проведенном под руководством J.K. Ferreira исследовании [32] 426 пациентов были рандомизированы в зависимости от стадии хронической болезни почек, сердечно-сосудистых заболеваний и сердечной недостаточности для лечения ситаглиптином или глимепиридом. При сопоставимом, достигнутом через 52 недели терапии улучшении гликемического контроля (различие HbA1c между группами – 0,11 %), было отмечено меньшее число симптоматических гипогликемий (6,2 и 17 %, p = 0,001) и лучшая динамика массы тела (снижение на 0,6 кг и ее набор на 1,2 кг, p < 0,001) на фоне приема ситаглиптина по сравнению с ПСМ. Ранее безопасность ситаглиптина была подтверждена в плацебо-контролируемом РКИ, в т. ч. для пациентов, находившихся на гемодиализе [33]. В недавно проведенном исследовании показано, что монотерапия ситаглиптином была охарактеризована как эффективная и хорошо переносимая в течение 54
недель пациентами с CД2 и терминальной хронической почечной недостаточностью, находившихся на программном диализе [34].
Онкологическая безопасность использования ситаглиптина подтверждается оценкой риска развития
новообразований как на экспериментальных животных моделях, так и в ретроспективных когортных исследованиях.
Известно, что ГПП-2 – интестинальный гормон, также инактивируемый ферментом ДПП-4, обладает способностью ускорять рост интестинальных клеток. Установлено усиление прогрессирования кишечных неоплазий у получающих канцерогены мышей при введении ГПП-2 и отсутствие указанного эффекта при вскармливании ситаглиптина. У мышей, получавших ситаглиптин, не было обнаружено увеличения массы кишечника, а число фокусов диспластических аберрантных крипт (ACF – aberrant crypt foci) соответствовало здоровому контролю [35]. Мета-анализ 19 исследований, включивших 5429 пациентов, принимавших ситаглиптин, и 4817 больных, получавших препараты сравнения, подтвердил
сопоставимый риск развития новообразований при приеме ситаглиптина и других сахароснижающих препаратов (табл. 2).
Регенерация β-клеток и сохранение их функциональной активности, подтвержденные в серии преклинических исследований, являются важными негликемическими эффектами использования ингибиторов ДПП-4. Этот подход рассматривается как многообещающий для стабилизации
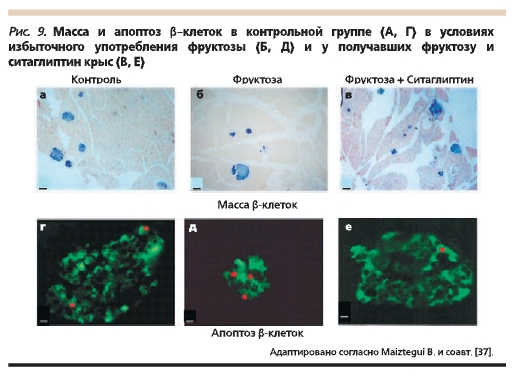
прогрессирующего развития диабета [36]. Показано, что использование ситаглиптина предотвращает ускоренный апоптоз β-клеток и развитие жирового стеатоза, индуцированных у крыс избыточным употреблением фруктозы (рис. 9) [37]. На экспериментальных животных моделях установлено, что механизм терапевтического действия ситаглиптина заключается в увеличении пролиферации β-клеток у мышей линии Akita и снижении скорости апоптоза у мышей линии db/db [38].
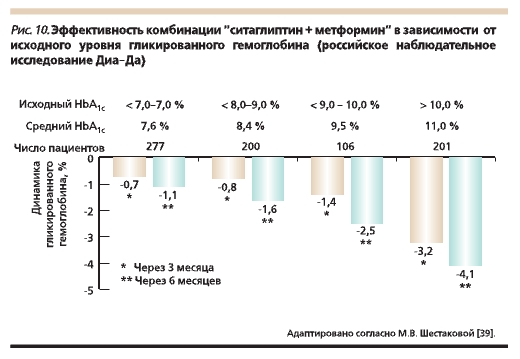
Опыт применения ситаглиптина в России первоначально основывался на проведении международных многоцентровых клинических исследований. В дальнейшем была осуществлена постмаркетинговая оценка ситаглиптина, подтвердившая эффективность и безопасность его использования. Так, в российской наблюдательной программе “Диа-Да” приняли участие 923 пациента (проживающие в 10 крупных городах России) с СД2 и неудовлетворительным гликемическим контролем на фоне только дието- или монотерапии метформином с длительностью заболевания 4,5 года. Были изучены динамика гликемических параметров (уровня гликемии натощак, HbA1c), массы тела, частота развития побочных
явлений, удовлетворенность пациентов и врачей проведенным лечением через 3 и 6 месяцев приема ситаглиптина. Установлено, что бóльшая эффективность инкретина отмечается при исходно более высоком уровне HbA1c (в среднем снижение уровня HbA1c достигало -4,1%) (рис. 10). Уровень HbA1c у
76 % пациентов к концу исследования снизился до целевых значений (< 7 %). Частота развития гипогликемических состояний на фоне приема ситаглиптина расценивалась как редкая. Кроме
того, прием глиптинов сопровождался тенденцией к снижению массы тела и повышением приверженности пациента проводимой терапии [39].
В другом проведенном на территории Москвы исследовании показано, что прием ситаглиптина способствует снижению инсулинорезистентности и повышению функциональной активности β-клеток поджелудочной железы, положительной динамике показателей липидного профиля и антропометрических параметров. У лиц, принимавших ситаглиптин через 24 недели, было установлено
снижение уровня лептина с 25,9 до 14,3 нг/мл (р < 0,05) и повышение уровня адипонектина с 20,1 до 31,9 нг/мл (р < 0,05) [40].
Заключение
• Глиптины обладают высоким сахароснижающим потенциалом, безопасны в использовании и характеризуются положительными плейотропными негликемическими эффектами.
• Мягкий и физиологичный сахароснижающий эффект ингибиторов ДПП-4 позволяет позиционировать их в качестве препаратов второй линии для пациентов, уже принимающих метформин, стартовой комбинации с метформином, а также препаратов первой линии в случае непереносимости или имеющихся противопоказаний к приему метформина. Показана перспективность сочетания глипти-
нов с инсулинотерапией.
• Продолжаются исследования по изучению других аспектов использования ингибиторов ДПП-4.
Следует отметить ряд перспективных направлений в исследованиях применения ситаглиптина:
• Продолжение оценки гликемических и негликемических эффектов использования ситаглиптина в амбулаторной практике.
• Дополнительная оценка негликемических эффектов ситаглиптина в рандомизированных клинических
исследованиях.
- Примером может быть плацебоконтролируемое рандомизированное клиническое исследование
TECOS (Sitagliptin Cardiovascular Outcome Study) с участием 14 тыс. 50 лет c предшествующими
сердечно-сосудистыми заболеваниями. В качестве первичных конечных точек рассматриваются
летальные исходы, обусловленные сердечно-сосудистыми причинами, нефатальный инфаркт миокарда, инсульт и госпитализация в связи с острым коронарным синдромом. Окончание исследования TECOS планируется в декабре2014 г.
• Создание новых лекарственных комбинаций с использованием ситаглиптина:
- комбинация ситаглиптина и метформина XR с пролонгированным высвобождением (препарат
Janumet XR) для однократного приема. Одобрена FDA в феврале 2012 г.;
- комбинация ситаглиптина и симвастатина (препараты Juvisync и Juvicor), позволяющая достигать одновременного устранения глюко- и липотоксичности, а также ряда других перспективных
комбинаций.



