Введение
Рак молочной железы (РМЖ) включает гетерогенные подтипы, отличающиеся биологией, морфологией и прогнозом. Иммунная система играет двойную роль в развитии и прогрессировании РМЖ, что лучше всего объясняется процессом иммунного редактирования, при котором опухоли подвергаются избирательному иммунному давлению, которое способствует элиминации, иммунному редактированию, в конечном итоге – к «ускользанию» от иммунорегуляторов. Лучшее понимание ранних этапов роста и прогрессирования опухоли должно способствовать разработке эффективных иммунотерапевтических препаратов, которые смещают баланс в сторону уничтожения опухоли. Выбор системной терапии рака молочной железы традиционно основывался на учете уровня экспрессии рецепторов экстрогена (ER), рецепторов прогестерона (PR) и/или HER2neu рецепторов. На основании экспрессии этих биомаркеров РМЖ можно разделить на четыре биологических (суррогатных) подтипа: люминальный (А и В), HER2-положительный, тройной негативный рак молочной железы (ТНРМЖ). Эти подтипы в большинстве случаев особые по иммуноспецифичности, различаясь по количеству опухольинфильтрирующих лимфоцитов (TILs), экспрессии PD-L1, опухоль-ассоциированными антигенами, в т.ч. опухолевой мутационной нагрузкой (TMB – tumor mutational burden) [1, 3].
Примечательно, что исследования, касающиеся иммунотерапии РМЖ, изначально шли медленнее по сравнению с другими солидными опухолями, количество некоторых исследований, посвященных изучению иммунотерапевтических средств, в последнее время серьезно увеличилось. Эти исследования проводятся параллельно на метастатических и ранних стадиях, что весьма перспективно, поскольку активность современных лекарственных средств изучалась на поздних стадиях [1].
1. Иммунный надзор рака молочной железы
1.1. РМЖ является иммуногенным
РМЖ исторически считался неиммуногенным. Однако теперь ясно, что некоторые опухоли молочной железы естественным образом индуцируют адаптивный иммунный ответ, содержат опухоль-инфильтрирующие Т-клетки (TIL) и могут также экспрессировать лиганд PD-1 белка PD-L1. Понятно, что как содержание TILs, так и экспрессия PD-L1 различаются в основных клинических подтипах (рис. 1) РМЖ. Последний с преобладанием лимфоцитов [Lymphocyte predominant breast cancers] (LPBCs) – это опухоли молочной железы, в которых стромальные или внутриопухолевые лимфоциты составляют от 50 до 60% опухолевой ткани, хотя существует линейная, а не дихотомическая связь между уровнем TILs и клиническими результатами. Присутствие TILs при постановке диагноза обеспечивает как прогностическую, так и предиктивную значимость независимо от подтипа РМЖ [4–6].
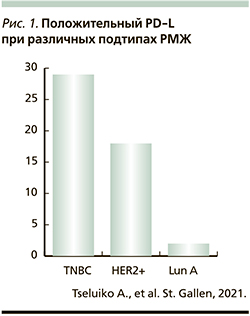
1.1. Прогностическое значение опухольинфильтрирующих лимфоцитов (TILs)
Ретроспективно-проспективный анализ данных почти 16 тыс. пациентов в пяти клинических испытаниях показал, что наличие стромальных TILs при постановке диагноза прогностическое для ТНРМЖ и HER2+ РМЖ, но не для люминального ER+/ PR+ РМЖ. У 821 пациента с ТНРМЖ в трех исследованиях наблюдалось улучшение безрецидивной выживаемости на 15–20% на каждые 10% увеличения числа стромальных TILs, определемых при окрашивании гематоксилином и эозином (H&E) (p=0,005–0,035). У 387 пациентов с HER2-позитивным РМЖ частота рецидивов снижалась на 3% на каждый 1% увеличения стромальных TIL при окрашивании H&E (p=0,002) [4]. В исследовании Ali et al. [36] оценены данные 12 366 пациентов со стромальным или внутриопухолевым CD8+TILs и продемонстрировано отсутствие значимого влияния внутриопухолевых CD8+-TIL на безрецидивную выживаемость (DFS) при ER+позивтивном РМЖ, но выявлено положительное влияние стромальноых CD8+-TILs на выживаемость при ER-/ HER2+-РМЖ железы.
1.1. TIL как предиктивный (предсказательный) фактор ответа на терапию TILs также может быть предиктивным биомаркером ответа на терапию. Высокие уровни TILs при постановке диагноза, т.е. до неоадъювантного и адъювантного лечения, связаны с большей пользой при проведении адъювантной терапии антрациклинами, что согласуется с данными, согласно которым химиотерапия на основе антрациклинов индуцирует иммуногенную гибель клеток через путь Toll-like receptor 4 (TLR-4). Данные по адъювантной терапии с применением трастузумаба противоречивы. В исследовании FinHER высокая плотность (density) TILs была связана с ответом на трастузумаб, тогда как в исследовании NCCTG N9831 таковой зависимости выявлено не было. Более того, стромальные TILs (по H&E) могут предсказывать частичный клинический ответ (cPR) на неоадъювантную химиотерапию. Величина частичного клинического ответа (cPR) при всех подтипах РМЖ приблизительно на 30% выше, когда опухоли молочной железы содержат более 60% TILs, чем когда они содержат менее или равные 60% TILs [4]. Добавление карбоплатина к стандартной неоадъювантной терапии увеличивало частоту cPR при HER2+-РМЖ и ТНРМЖ с 50 до 78% и с 43 до 74% соответственно (p<0,005). Остаточное заболевание (RD – Residual disease) после неоадъювантной химиотерапии служит отягчающим прогностическим фактором для HER2+-РМЖ и ТНРМЖ, но пациенты с TILs в остаточной опухоли имеют лучший прогноз.
2. Опухоль-инфильтрирующие лимфоциты (TILs) при различных подтипах РМЖ
Наличие инфильтрирующих опухоль лимфоцитов (TILs) служит важным прогностическим фактором при РМЖ, и TILs могут взаимодействовать с химиотерапией и ингибиторами иммунных контрольных точек для регенерации (возрождения) клинического ответа (CR). Понимание различий в лимфоцитарной инфильтрации при РМЖ может помочь в определении подтипов, более поддающихся иммуномодуляции.
Очень важно определить средний процент (удельный вес) у пациентов с отсутствием TILs, промежуточным уровнем TILs или высоким уровнем TIL и оценить вариации субпопуляций лимфоцитарных клеток при различных подтипах РМЖ. Stanton et al. [2] и Urezkova et al. [7] проанализировали исследования лимфоцитов в опухоли, СD8+и FОXPЗ+-клеточной инфильтрации, использовали многопараметрический анализ и количественные методы подсчета клеточных популяций. Отбор исследований осуществлен в соответствии с рекомендациями PRISMA и оценивался двумя независимыми патоморфологами.
В среднем 11% (диапазон – 5–26%) случаев оценены как РМЖ с преобладанием лимфоцитов (LPBC), примерно в 16% случаев не было признаков TILs. ТНРМЖ показал наибольшую частоту LPBC (20%; диапазон – 4–37%). Эти показатели аналогичны удельному весу HER2-позитивного РМЖ, равняющемуся 16% (диапазон – 11–24%). Гормон-рецептор позитивный/HER2-негативный (HR+/Her2-) РМЖ характеризуется более низкой частотой LPBC и составляет 6% (диапазон – 3–12%). Инфильтрация CD8+-T-клеток, свидетельствующая об иммунитете 1-го типа, обнаружена в 48% от всех случаев РМЖ (диапазон – 32–80%) с аналогичными уровнями, наблюдаемыми при ТНРМЖ (60%; диапазон – 40–91%) и HER2+-РМЖ (61%; диапазон – 40%–83%). Меньшее количество HR+-опухолей показало CD8+-TILs (43%; диапазон – 30–73%). Самые высокие уровни клеток FOXP3+ наблюдались при ТНРМЖ (70%; диапазон – 65–76%) и HER2+-РМЖ (67%; диапазон – 61–74%). Меньшая часть HR+-РМЖ показала высокие уровни инфильтрирующих опухоль клеток FOXP3+ (38%; диапазон – 35–41%). Значение TILs изменчиво внутри и между подтипами РМЖ. Уровни лимфоцитарных субпопуляций могут распознавать РМЖ, более адаптируемый к иммуномодуляции, и показывать дополнительные стратегии для повышения иммунитета у пациентов с низким и средним уровнем TIL.
2.1. Тройной негативный РМЖ
В 3 раза больше ТНРМЖ классифицируется как лимфоцитпреобладающий РМЖ (LPBC) по сравнению с люминальным [HR+] РМЖ. Существует множество факторов, которые могут повышать значение адаптивного иммунитета при ТНРМЖ. Во-первых, показано, что гормон-рецептор отрицательный (HR-) рак в основном имеет большую геномную и хромосомную нестабильность, чем гормон-рецептор позитивный (HR+) РМЖ. Однако, в то время как люминальный A (HR+-РМЖ) характеризуется низкой геномной нестабильностью, некоторые люминальные B HR+-опухоли действительно имеют амплифицированную геномную нестабильность. Масса мутаций увеличивает вероятность того, что мутированные белковые последовательности будут экспрессироваться и потенциально распознаваться иммунной системой как новые антигены, тем самым вызывая иммунный ответ. ТНРМЖ также связан со многими аберрантными сигнальными путями, такими как EGFR, MET и PI3K. Эти многообразные фосфорилированные белки вызывают экспрессию множества уникальных фосфопептидов, которые также могут быть распознаны иммунной системой как чужеродные и вызывать разрушающий опухоль иммунный ответ. Однако сообщалось, что ТНРМЖ по большей части инфильтрирован В-клетками. Сигнатура метагена, включающая В-клетки, была связана с улучшением выживаемости при базальном ТНРМЖ. Как известно, несколько исследований полностью характеризовали TILs для уровней в Т-лимфоцитах по сравнению с В-лимфоцитами. Возможно, более конкретное разграничение Ти В-клеток в иммунной инфильтрации может улучшать определение роли каждого типа лимфоцитов в прогнозе РМЖ.
2.2. HER2-положительный РМЖ
Пациенты с HER2+-РМЖ имеют схожий лимфоцитпреобладающий рак (LPBС), как и пациенты с ТНРМЖ, и, как правило, имеют высокий уровень инфильтрирации CD8+-T-клетками, как и при ТНРМЖ. Не доказано, что наличие LPBC и CD8+ в TILs предсказывает прогностическое преимущество при HER2+-РМЖ, как это имеет место при ТНРМЖ [8]. Иммунная инфильтрация HER2+-подтипа должна оцениваться в контексте гормон-рецепторного статуса. Одно исследование продемонстрировало, что инфильтрация CD8+ в HR-негативных/HER2+-опухолях предсказывает улучшение безрецидивной выживаемости RFS (p=0,04), но не в HR-позитивных/HER2+-опухолях, свидетельствуя о том, что иммуноопосредованное прогностическое преимущество связано с негативным статусом гормональных рецепторов, а не с гиперэкспрессией HER2+ [9].
2.3. Гормон-рецепторположительный РМЖ
Ответ на иммунотерапию необычен для ER+-РМЖ, и на сегодняшний день отсутствуют предиктивные маркеры при данном рецепторном статусе. Высокие уровни FOXP3+ в TILs предсказывают только неблагоприятный прогноз при люминальном РМЖ (HR+РМЖ). Роль T-reg в подавлении функциональных Т-клеток при других подтипах неясна.
Большинство опубликованных исследований оценивает T-reg с использованием только одного маркера и не проводит стратификации экспрессии FOXP3, CD4+или CD8+Т-клетках. Это важное отличие, поскольку FOXP3 является тем же маркером, который экспрессируется на активированных CD8+-Т-клетках. Высокие уровни FOXP3+-TIL связаны с плохой выживаемостью при HR+-РМЖ, в котором отсутствуют CD8+-TILs. Более того, опухоль-инфильтрирующие фолликулярные CD4+-T-клетки в непосредственной близости от CD8+-T-клеток были связаны с лучшим прогнозом при HR+-РМЖ [39]. Эти данные свидетельствуют о том, что оценка обеих внутриопухолевых CD4+и CD8+-Тклеток может быть необходимой для полной оценки иммунного окружения в HR+-подтипе [10]. Нацеливание как на Treg, так и на ERα может кординально изменять иммуносупрессивную среду при HR+-РМЖ, что потенциально усилит иммуномодулирующую терапию при HR+-РМЖ. Рецепторположительный РМЖ (HR+РМЖ) по сравнению с другими подтипами связан с более низкими уровнями экспрессии TILs, TMB и PDL-1. Что касается метастатического рака, то комбинация ингибитора PD-1 пембролизумаба с эрибулином не продемонстрировала дополнительных преимуществ выживаемости без прогрессирования (PFS) и общей выживаемости (OS) по сравнению с монотерапией эрибулином [37]. Напротив, в исследовании I-SPY2 комбинация пембролизумаба с неоадъювантной химиотерапией почти втрое увеличила частоту pCR для раннего гормон-рецептор-позитивного РМЖ, аналогично тому, что наблюдается и при ТНРМЖ, т.е. активность иммунотерапии может быть выше при ранних стадиях заболевания [11]. Некоторые данные определяют новую иммунную сигнатуру у пациентов с PD-L1отрицательным ER+-РМЖ, которые, вероятно, получат пользу от ингибиторов иммунной контрольной точки и ингибиторов гистоновой деацетилазы (NCT02395627) [12]. Ингибиторы гистондеацетилазы (HDACi), такие как вориностат, представляют собой эпигенетические модификаторы, которые, как было показано, «отменяют» резистентность к гормональной терапии, что приводит к длительному противоопухолевому ответу. В дополнение к их влиянию на передачу сигналов ER доклинические исследования показали, что HDACi подавляют регуляторные Т-клетки (Treg), индуцируя экспрессию PD-L1 на опухолевых клетках, а также изменяют состав TILs, индуцируя CD8+-T-клетки in vitro и in vivo в моделях при РМЖ [12].
В исследованиях F. Liu et al. [13] продемонстрировано, что прогностическое значение инфильтрирующих опухоль регуляторных Т-клеток FOXP3 (Treg) при РМЖ зависит от их относительной плотности и распределения в тканях F. Liu et al. [13] оценили изменения T-reg до и после неоадъювантной химиотерапии (НАХТ) и их взаимосвязь с ответом опухоли и выживаемостью. Изменения были значительными в тех опухолях, которые обычно отвечают на НАХТ, включая HER2+ и базальноподобные подтипы (p=0,035; p=0,004). Одномерный и многомерный анализы показали, что снижение перитуморальных T-reg было независимым предиктором полного патоморфологического ответа (pCR), в то время как внутриопухолевые T-reg после химиотерапии были связаны с результатами общей выживаемости (OS) и выживаемости без прогрессирования (PFS). Исследование показало, что опухоли с перитуморальными T-reg-клетками чувствительны к химиотерапии и связаны с достижением pCR, в то время как внутриопухолевые T-reg-клетки является независимым прогностическим предиктором для пациентов с РМЖ.
Miyashita et al. [14] изучали прогностическую значимость CD8+-TILs и FOXP3+-TILs в резидуальных опухолях после неоадъювантной химиотерапии (НАХТ) и изменения этих параметров до и после НАХТ у больных ТНРМЖ. Подклассификация TIL имеет ключевое значение, например, сообщалось, что цитотоксические Т-клетки (CD8+ Т-клетки) связаны с лучшим клиническим исходом пациентов с РМЖ, но другие исследования не смогли подтвердить эту связь. Кроме того, регуляторные Т-клетки, определенные как forkhead box белок 3 (FOXP3)+Т-клетки, играют ключевую роль в подавлении противоопухолевого иммунитета. Однако также верно и то, что прогностическое значение FOXP3 остается спорным, например, сообщалось, что РМЖ с FOXP3+-TIL менее чувствителен к цитотоксической химиотерапии и имеет худший прогноз, но другие авторы сообщали, что у пациентов с FOXP3+-TILs прогноз лучше. Результаты недавних доклинических исследований показали, что цитотоксические агенты могут проявлять свою противоопухолевую активность, индуцируя иммунный ответ против опухолевых клеток.
В исследовании Miyashita et al. [14] 5-летний показатель безрецидивной выживаемости (RFS) равнялся 72% у пациентов с высоким соотношением CD8/FOXP3 и лишь 40% у пациентов с низким соотношением CD8/ FOXP3. Исследование Miyashita продемонстрировало, что высокие уровни CD8+-TILs и соотношение CD8/ FOXP3 в остаточных (резидуальных) опухолях могут точно предсказать лучший клинический исход для пациентов с ТНРМЖ. Эти данные могут в будущем изменить стратификацию пациентов для постадъювантной терапии пациентов с резидуальной опухолью после неоадъювантной терапии. Наличие экспрессии FOXP3 при ER+РМЖ на внутриопухолевых лимфоцитах в значительной степени связано с тенденцией к снижению общей выживаемости (p=0,06). Анализ литературы также показывает, что FOXP3 является маркером неблагоприятного прогноза, особенно в группе ER+-РМЖ, но фактором благоприятного прогноза в группе HER2+/ER-.
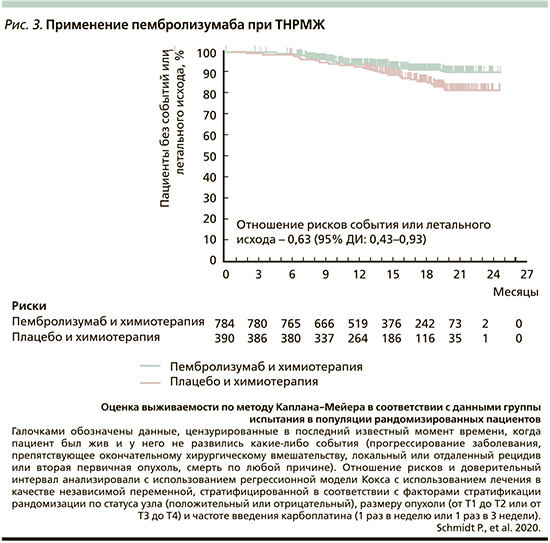
Большинство данных, посвященных химио-иммунотерапевтическим подходам, были получены при ТНРМЖ. Причины, по которым исследования были сосредоточены на этом подтипе, объясняются тем, что ТНРМЖ характеризуется более сильной иммунной инфильтрацией, более высокими уровнями экспрессии PD-L1 и наличием геномной нестабильности по сравнению с другими подтипами РМЖ [15, 16]. ТНРМЖ – это термин, используемый для описания РМЖ, который при иммуногистохимическом исследовании лишен экспрессии рецепторов эстрогена и прогестерона и не сверхэкспрессируют рецептор 2-го типа к эпидермальному фактору роста человека (HER2). Химиотерапия остается основным методом системного лечения, при этом международные рекомендации поддерживают использование монотерапии таксанами или антрациклинами в качестве терапии первой линии. У пациентов с ТНРМЖ экспрессия лиганда запрограммированной гибели клеток 1-го типа (PD-L1) происходит в основном на инфильтрирующих опухоль иммунных клетках, а не на самих опухолевых клетках и может усиливать противораковый иммунный ответ [17]. Таким образом, ингибирование PD-1 и его лиганд PD-L1 считается полезной опцией в определении стратегии лечения. Атезолизумаб избирательно нацелен на PD-L1, предотвращая взаимодействие с рецепторами PD-1 и B7-1 (костимулирующий белок клеточной поверхности), инверсируя супрессию Т-клеток [17]. Неожиданно в двух наиболее важных рандомизированных исследования III фазы метастатического или неоперабельного местно-распространенного ТНРМЖ (исследования Impassion-130 и -131), имевших схожий дизайн, получены разные результаты. В исследовании Impassion-130 рандомизированные пациенты получали наб-паклитаксел либо с атезолизумабом, либо с плацебо. Как было продемонстрировано ранее [17, 18], выживаемость без прогрессирования (PFS) статистически значимо увеличивалась в популяции как intention-to-treat (ITT), так и с положительным PD-L1 (экспрессия ≥1% на иммунных клетках в опухолевой ткани) в группе, получавшей атезолизумаб. Исследование имело иерархический дизайн для общей выживаемости, что означает, что общая выживаемость в PD-L1-позитивной популяции формально не исследовалась. Тем не менее предварительный анализ PD-L1 IC-позитивной популяции показал улучшение выживаемости в течение 7,5 месяцев при добавлении атезолизумаба [18].
В другом международном исследованим Impassion-131 оценивали атезолизумаб в комбинации с паклитакселом по сравнению с паклитаксел+плацебо у пациентов с метастатическим ТНРМЖ [19]. Из 651 пациента у 45% был PD-L1-позитивный ТНРМЖ. При анализе показателей выживаемости без прогрессирования (PFS) добавление атезолизумаба к паклитакселу не приводило к статистически значимому улучшению ВБП и PFS в PD-L1позитивной популяции. При учете окончательных данных летальный исход был зарегистрирован у 123 (42%) из 292 пациентов в PD-L1-позитивной популяции (44 против 39%) в группах атезолизумаба и плацебо соответственно. При окончательном анализе нежелательные явления степени 3/4 возникали у 53% пациентов, получавших атезолизумаб, и у 46% пациентов, получавших плацебо [19]. Результаты исследования Impassion-131 также контрастируют с недавно опубликованными результатами исследования KEYNOTE-355, в котором оценивался более широкий спектр основных химиотерапевтических препаратов (включая наб-паклитаксел и паклитаксел, а также гемцитабин/карбоплатин) с другим иммунотерапевтическим агентом – пембролизумабом [22]. Общая цель KEYNOTE-355 была в целом аналогична Impassion-131, но были важные различия в отношении приемлемости, тестирования PD-L1, основы химиотерапии и статистического дизайна. Во время окончательного анализа в исследовании оценка общей выживаемости (ОS) предполагалось влияние атезолизумаба с сохранением и даже усилением разделения кривых. В исследовании Impassion-131 нет различий между группами лечения в течение первых 7–8 месяцев лечения. Последующее отклонение кривых отражает тенденцию более высокой общей выживаемости получавших атезолизумаб. Остается неясным, почему разница между группами лечения возникает намного позже в исследовании Impassion-131 в отличие от Impassion-130. Можно предположить влияние сопутствующих стероидных гормонов во время терапии паклитакселом, которые потенциально ослабляют эффект иммунотерапии. Однако в исследовании Impassion-131 стероидные гормоны в основном использовались для профилактики аллергических и побочных реакций [20]. Таким образом, вместе с данными о эффективности как в исследовании KEYNOTE-355 [66], так и в KEYNOTE-522 [21] можно полагать, что разница была лишь только в применении стероидных гормонов, что и объясняет разные первичные результаты в Impassion-131 и в Impassion-130 [23, 24].
В исследовании NeoTRIP с участием НИИ онкологии им. Н.Н. Петрова добавление атезолизумаба к неоадъювантной химиотерапии карбоплатином и наб-паклитакселом в течение 8 циклов привело к увеличению частоты pCR на 4,2% у женщин с ТНРМЖ высокого риска [27]. Величина pCR была выше у пациентов с опухолями, экспрессирующими PD-L1, нежели чем для PD-L1-отрицательных случаев (рис. 2).
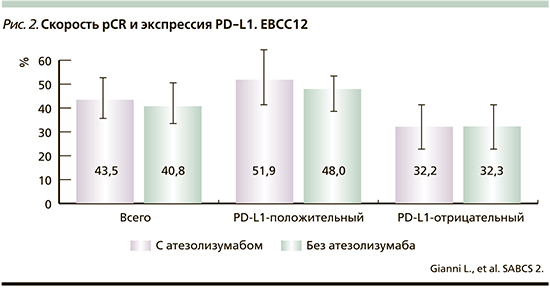
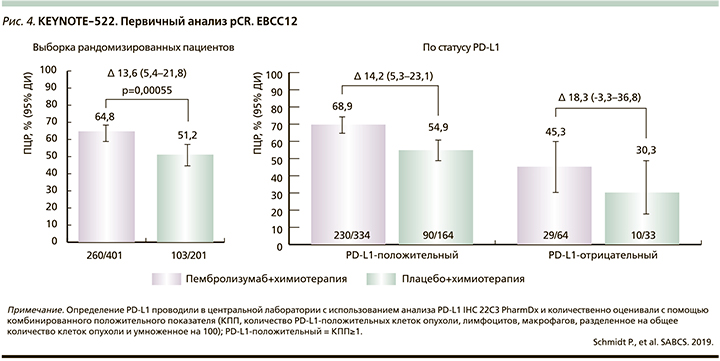
В других исследованиях сообщалось о результатах добавления чек-пойнт ингибиторов к неоадъювантной химиотерапии женщин с ТНРМЖ высокого риска. В исследовании Impassion-031 атезолизумаб увеличивал pCR с 41 до 58% при добавлении к последовательной химиотерапии наб-паклитакселом в течение 12 недель с последующим применением доксорубицина и циклофосфамида в течение пяти циклов. Интересно, что в этом исследовании повышение частоты pCR при применении атезолизумаба не зависело от экспрессии PD-L1 в опухоли, что отличалось от наблюдения в исследовании neoTRIP и противоречило результатам пациентов с метастатическим ТНРМЖ, у которых атезолизумаб имел положительный эффект с наб-паклитакселом при PD-L1+пациентов [17]. В исследовании KEYNOTE522 при применении неоадъювантного лечения доцетакселом с последующей химиотерапией антрациклиновой группы добавлен пембролизумаб, направленный непосредственно на белок PD-1, были получены результаты со значительно более высокой частотой pCR (на 13,8%) в анализе первых 602 пациентов (рис. 3), хотя разница в пользу пембролизумаба снизилась до 7,4%, когда произошел учет всех пациентов, включенных в исследование.
В рассмотренных неоадъювантных исследованиях участвовали разные популяции пациентов. В NeoTRIP у 49% пациентов было местнораспространенное заболевание, в то время как в Impassion-031 и KEY-NOTE-522 приблизительно 75% имели стадию II и 25% – стадию III [21]. Таким образом, пациенты, включенные в NeoTRIP, имели более высокий риск рецидива, чем в двух других неоадъювантных клинических исследованиях III фазы. Еще одно существенное различие в результатах, собранных по настоящее время в NeoTRIP, заключается в том, что PD-L1+ имеет более высокую вероятность достижения pCR, чем PD-L1негативные опухоли. В Impassion-031 также PD-L1-положительная подгруппа имеет более высокую вероятность pCR только в контрольной группе неоадъювантной химиотерапии. Однако в последнем исcледовании улучшенная противоопухолевая активность, связанная с применением чек-поинт ингибиторов, статистически имело место независимо от статуса PD-L1.
Возможно, что очень высокая экспрессия PD-L1 отражает высокую инфильтрацию опухоли иммунными клетками, взаимодействующими с химиотерапией, независимо от иммунотерапии, тогда как при более низкой экспрессии атезолизумаб играет важную иммуномодулирующую роль [33]. Другое различие между испытаниями заключается в том, что в Impassion-031 и KEYNOTE-522 применялись последовательные неоадъювантные схемы, включавшие комбинацию антрациклина, тогда как в NeoTRIP использовалась неоадъювантная схема без антрациклинов. Антрациклины индуцируют мощную иммуногенную гибель клеток, что может увеличивать вероятность ответа PD-L1-негативных опухолей. Поскольку TILs положительно коррелируют с вероятностью pCR, дисбаланс мог повлиять на результаты. Еще одно предостережение относительно значимости pCR связано с недавними результатами, показывающими, что безрецидивная выживаемость (EFS) значительно улучшилась при применении чек-поинт-ингибиторов в неоадъювантных схемах в KEYNOTE-522 (рис. 4), в т.ч. у пациентов, не достигших pCR [30], и в GeparNUEVO, несмотря на отсутствие значимо более высокой частоты pCR при применении дурвалумаба [28]. Результаты подтверждают мнение, согласно которому pCR может быть не самой подходящей конечной точкой для оценки роли чек-поинт-ингибиторов (ICI) в неоадъювантных схемах для ТНРМЖ.
Основной конечной точкой neoTRIP является безрецидивная выживаемость (EFS), и отсутствие улучшения pCR может вводить в заблуждение относительно влияния атезолизумаба на эффективность и выживаемость при ТНРМЖ высокого риска.
Внедрение ICI изменило подход вариантов лечения при постоянно растущем числе онкологических показаний и быстро продвигается к установлению новых стандартов терапии ТНРМЖ на ранних стадиях заболевания [32], как это уже было сделано при метастатических стадиях. Текущий отчет neoTRIP является вкладом в продолжающееся понимание использования ICIs при ТНРМЖ и подчеркивает необходимость надежных предикторов активности и эффективности ICI. Последующее наблюдение за исследованием, анализ и оценка огромного архива образцов опухолевой ткани, а также исследование крови в исследовании neoTRIP продолжаются и внесут дополнительный вклад в будущее.
6. Новая комбинированная стратегия
Zhang et al. [34] исследовали эффективность и безопасность последовательной комбинации химиотерапии (режимы на основе антрациклинов или таксанов) и иммунотерапии аутологичными цитокин-индуцированными клеткамикиллерами (CIK) пациентов с ТНРМЖ. В группе CIK интервалы DFS и OS были значительно длиннее, чем в контроле (DFS: p=0,047; OS: p=0,007). Стратегия клеточной терапии CIK после адъювантной химиотерапии предполагает снижение риска рецидиваов и метастазов у пациентов после радикального лечения ТНРМЖ, тем самым увеличивая выживаемость с минимальными побочными эффектами. Таким образом, иммунотерапия CIK-клетками может стать потенциально новой стратегией в системной адъювантной терапии послеоперационных пациентов с ТНРМЖ в ближайшем будущем.
Заключение
Экспрессия иммунных регуляторных контрольных точек, таких как PD-1 и его лиганд B7-H1 (или PD-L1), отрицательно влияет на результаты лечения. Эти данные свидетельствуют о том, что у части пациентов наблюдается постоянный иммунный ответ в микроокружении опухоли и что экспрессия PD-L1 служит адаптивным методом устойчивости опухоли к инфильтрирующим опухоль лимфоцитам, в свою очередь необходимые для ответа на химиотерапию. В целом данные свидетельствуют о роли иммунной регуляции ответа на химиотерапию и поддерживают концепцию, согласно которой блокада иммунных контрольных точек может способствовать достижению стойкого ответа за счет самих иммунных механизмов и в сочетании с классической химиотерапией. Внедрение ICI изменило стратегию лечения при постоянно растущем числе онкологических показаний и быстро продвигается к установлению новых стандартов терапии при ТНРМЖ и HER2-позитивных РМЖ на ранних стадиях, как это уже было сделано при метастатических стадиях. Однако все одобренные диагностические маркеры, включая экспрессию PD-L1, не всегда предсказывают ответ на ICI. Некоторым больным РМЖ (особенно с гормон-позитивным РМЖ) терапия этими препаратами не помогает. Следовательно, необходимо определить биомаркеры для лучшей стратификации PD-L1-позитивных пациентов с РМЖ, потенциально чувствительных к иммунотерапии. За последние 2 года [35] идентифицирован новый иммунодепрессивный иммуномаркер – «leukemia inhibitory factor» (LIF). Высокий уровень LIF был связан с более низкой выживаемостью пациентов после анти-PD-L1терапии. Напротив, низкий уровень фактора ингибирования лейкемии (LIF) был связан с высоким уровнем TIL и высокими показателями CD8+в Т-лимфоцитах. Хорошо известно, что наличие TIL является высокопрогнозирующим фактором улучшения исходов у онкологических больных, получавших ICI. Таким образом, изучение LIF в будущем может представлять собой надежный маркер для определения эффективности терапии ICI у пациентов с РМЖ PD-L1+.



