Введение
Мигрень является распространенным дезадаптирующим неврологическим расстройством группы первичных головных болей [1–3]. Различные сочетания болевых и неболевых симптомов определяют многообразие клинических фенотипов (форм) мигрени и оказывают негативное влияние на качество жизни пациентов [4, 5]. Как сам пациент и его семья, так и общество в целом испытывают значительное финансовое бремя из-за прямых медицинских и косвенных затрат в связи с пропуском работы и снижением работоспособности вследствие повторяющихся приступов мигрени [6, 7].
Стратегии лечения мигрени включают:
1) поведенческую терапию, направленную на модификацию образа жизни пациента;
2) купирование приступа;
3) профилактическое лечение, включающее медикаментозные и немедикаментозные методы [8, 9].
Выбор терапии индивидуален и определяется особенностями клинических проявлений мигрени, коморбидными нарушениями и предпочтениями пациента [8, 10]. Несмотря на доступность и надежную доказательную базу традиционных подходов к терапии мигрени (β-адреноблокаторы, антиконвульсанты, антидепрессанты, антагонисты рецепторов ангиотензина II, ботулинотерапия и другие), во многих случаях лечение остается трудной задачей из-за недостаточной эффективности, нежелательных явлений, а также из-за низкой приверженности пациентов к длительным (от 6 до 12 месяцев) схемам профилактического лечения [11–17].
За последние 5 лет возможности помощи пациентам с мигренью значительно расширились в связи с появлением нового класса препаратов, влияющих на специфичную для мигрени биологическую «мишень», – кальцитонин-ген родственный пептид (CGRP): низкомолекулярные антагонисты рецепторов CGRP (гепанты) и моноклональные антитела к лиганду CGRP или его рецептору (Анти-CGRP(r) мАТ) [18, 19].
Широко и успешно применяемые в мире Анти-CGRP(r) мАТ представляют собой новый класс препаратов, специально разработанных для таргетной (патогенетически обоснованной) профилактической терапии эпизодической (ЭМ) и хронической мигрени (ХМ) у взрослых [20, 21]. В отличие от вышеупомянутых традиционных превентивных средств Анти-CGRP(r) мАТ прицельно блокируют основной болевой медиатор мигрени CGRP или его рецептор, при этом не вовлекают в изменения иммунную систему [22, 23]. Это объясняет низкую частоту нежелательных лекарственных реакций и высокую безопасность таргетной терапии [19, 24–26].
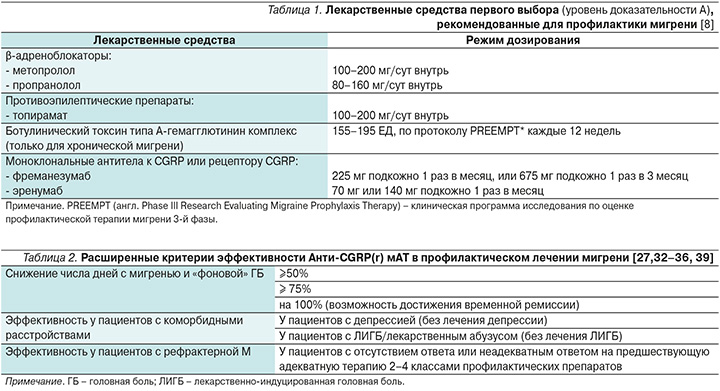
Многочисленные клинические исследования и более чем пятилетний мировой опыт практического использования показывают, что Анти-CGRP(r) мАТ высокоэффективны в терапии ЭМ и ХМ [19, 27, 28]. В РФ зарегистрированы и с 2020 г. успешно применяются два препарата этого класса: фреманезумаб и эренумаб [27]. На основании высокой эффективности (уровень доказательности А) и надежного профиля безопасности эти препараты наряду с традиционными средствами в 2021 г. включены в Клинические рекомендации МЗ РФ «Мигрень (взрослые)» как препараты первой линии для профилактической терапии мигрени [8]. В соответствии российскими рекомендациями Анти-CGRP(r) мАТ могут применяться пациентами, имеющими 4 и более дней с мигренью в месяц [8] (табл. 1).
Эффективность Анти-CGRP(r) мАТ
Таргетная терапия может быть назначена длительностью от 6 до 12 месяцев и более в зависимости от эффективности и переносимости лечения. Хотя улучшение может быть заметно уже в первые дни после первой инъекции, эффективность профилактической терапии следует оценивать через 3 месяца после ее начала (т.е. после трех ежемесячных последовательных подкожных инъекций) [27, 29].
Важно отметить, что при раннем назначении профилактической терапии Анти-CGRP(r) мАТ пациентам с тенденцией к учащению приступов мигрени (например, 6–8 дней с мигренью в месяц) возможно замедление прогрессирования заболевания. Другими словами, своевременно начатая таргетная терапия позволяет предотвращать трансформацию ЭМ в ХМ [21, 23, 28, 30].
Известно, что основным критерием эффективности превентивного лечения мигрени является снижение числа дней с головными болями (ГБ) в месяц на 50% от исходного уровня через 3 месяца терапии [31]. Долгосрочное применение Анти-CGRP(r) мАТ как в рандомизированных клинических исследованиях (РКИ), так и в реальной клинической практике показало, что таргетная терапия позволяет существенно расширять критерии эффективности профилактической терапии мигрени [19, 26–28, 32–35, 39]. Расширенные критерии эффективности приведены в табл. 2.
Как видно из табл. 2, на терапии Анти-CGRP(r) мАТ возможно снижение числа дней с головной болью в месяц не только на ≥50%, но на ≥75 и 100%, т.е. возможно достижение временной ремиссии у пациентов как с ЭМ, так и с ХМ. Продолжительность периода полной свободы пациента от приступов мигрени может колебаться от 1 месяца и более [37]. Этот аспект требует дальнейшего изучения, как и тактика ведения пациента в случае прекращения приступов.
Исследования показали, что мАТ к CGRP эффективны в профилактике мигрени даже при наличии у пациентов сопутствующей депрессии и избыточного применения лекарств для купирования приступа ГБ (лекарственного абузуса (ЛА)/ЛИГБ, даже если лечение депрессии и ЛИГБ не проводится [32–35, 37, 38]. Однако некоторыми исследователями высказывается мнение, согласно которому наличие коморбидного нарушения, ухудшающего качество жизни пациента с мигренью (например, депрессии, тревожного расстройства или диссомнии), должно рассматриваться как показание к сочетанию Анти-CGRP(r) мАТ с другими адекватными профилактическими средствами (антидепрессантами, в т.ч. нормализующими ночной сон, противотревожными препаратами) [39, 40].
Аналогично при наличии у пациента с мигренью ЛА, особенно в случае длительно существующей тяжелой ЛИГБ, все-таки необходимо проводить мероприятия по преодолению абузуса и лечить ЛИГБ [34, 39]. Это важно в первую очередь потому, что сохраняющийся ЛА как известный фактор хронизации мигрени будет продолжать способствовать учащению ГБ и, возможно, снижать эффективность дорогостоящей таргетной терапии. Нельзя исключать, что нелеченые актуальные коморбидные нарушения и ЛИГБ могут рассматриваться как предикторы недостаточной эффективности Анти-CGRP(r) мАТ [39].
Кроме того, в РКИ и клинической практике показано, что Анти-CGRP(r) мАТ «работают» даже у самой тяжелой категории пациентов – при рефрактерной мигрени, когда оказалось неэффективным предшествовавшее адекватное лечение 2–4-мя классами средств с доказанной эффективностью в профилактике мигрени, назначенных в правильных дозах и с достаточной продолжительностью применения [19, 28, 40, 41].
Наконец, в литературе нередко обсуждается тактика ведения пациентов при недостаточной эффективности терапии Анти-CGRP(r) мАТ после первых 3 месяцев их применения. Наряду с изменением режима дозирования (например, для эренумаба – переход с дозы 70 мг в месяц на 140 мг в месяц) обсуждается возможность «переключения» пациента с одного на другой препарат этого класса [42–44]. Например, в недавнем исследовании показано, что пациенты, не ответившие на первый препарат Анти-CGRP(r) мАТ, на другом препарате через 6 месяцев его применения достигали снижения числа дней с мигренью на ≥50% [45].
При недостаточной эффективности возможен и третий путь: присоединение к терапии Анти-CGRP(r) мАТ традиционных средств профилактики: β-адреноблокаторов, антидепрессантов, антиконвульсантов, ботулинотерапии и др. [19, 27, 28, 44].
Переносимость таргетной терапии
В ходе РКИ и в течение многолетнего применения в реальной практике Анти-CGRP мАТ продемонстрировали надежный профиль безопасности: не было отмечено значимых нежелательных явлений, в т.ч. со стороны сердечно-сосудистой системы, а также дополнительных лекарственных взаимодействий, кроме связывания с CGRP или его рецептором [32]. В исследовании D.C. Buse et al. [46] показано, что более 90% пациентов с ЭМ и ХМ, ранее получавших терапию традиционными пероральными профилактическими средствами (β-адреноблокаторами, антиконвульсантами, антидепрессантами) и затем перешедших на Анти-CGRP мАТ, предпочитали таргетную терапию традиционной.
Таким образом, с учетом высокой эффективности и отличной переносимости как при ЭМ, так и при ХМ применение препаратов класса Анти-CGRP(r) мАТ в России может рассматриваться как терапия первого выбора, в т.ч. у пациентов, ранее не получавших адекватной профилактики мигрени [8].
Для иллюстрации эффективности таргетой терапии мигрени, в т.ч. тактики ведения пациента с переключением с одного Анти-CGRP(r) мАТ на другой, ниже приводим случай из реальной практики.
Клинический случай
Жалобы
В марте 2019 г. в Университетскую клинику головной боли Москвы с жалобами на частые ГБ обратилась пациентка Елена Х. 45 лет (менеджер, замужем, имеет дочь 20 лет). Болевые приступы обычно начинались с пульсации в одной точке виска, чаще справа, постепенно распространялись на всю половину головы, достигая 8–9 баллов по визуальной аналоговой шкале (ВАШ); обычно длились 3 суток и сопровождались фото- и фонофобией, тошнотой и редко рвотой, болезненностью при прикосновении и парестезиями волосистой части головы – больше на стороне боли, шумом в ушах. Большинство приступов успешно купировались приемом внутрь 50–100 мг/табл. суматриптана; иногда дополнительно принимался ибупрофен 400 мг/табл. или комбинированный анальгетик в таблетках (ацетилсалициловая кислота 240 мг, парацетамол 180 мг, кофеин 30 мг); иногда по две дозы различных препаратов в день с ГБ. Среди провоцирующих факторов пациентка отмечала стресс, интенсивные занятия спортом, массаж шейно-воротниковой зоны, употребление алкоголя и шоколада, а также связь с менструальным циклом (приступы могли начинаться в дни овуляции и/или менструации). Число дней с ГБ за последние 3 месяца, со слов пациентки (дневник ГБ женщина не вела), было не менее 3 в неделю, т.е. не менее 12 дней с ГБ в месяц, из которых большинство имели типичные характеристики мигрени; число дней с приемом препаратов для купирования приступа – также не менее 12 в месяц.
Сопутствующие жалобы: повышенная тревожность, нарушения ночного сна (трудности засыпания, поверхностный сон, отсутствие восстановления сил после сна).
Семейный анамнез: дочь пациентки примерно с 15 лет испытывает аналогичные приступы ГБ, которые имеют меньшую интенсивность и хорошо купируются ибупрофеном. По линии отца отмечались сердечно-сосудистые заболевания (гипертоническая болезнь, ИБС).
Анамнез
Описанные приступы ГБ беспокоят примерно с 17 лет (см. рисунок), однако в первые годы ГБ возникала не чаще 2 раз в месяц, не сопровождалась тошнотой и шумом в ушах, хорошо купировалась простыми анальгетиками.
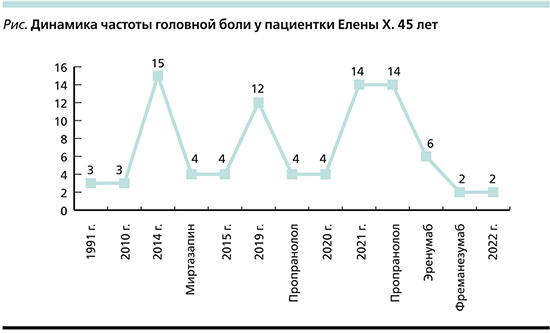
Пять лет назад на фоне стресса ГБ участились до 15 дней в месяц, снизилось настроение. Невролог поставил диагноз депрессивного расстройства (мигрень не была диагностирована) и назначил миртазапин в дозе 30 мг/сут., который пациентка принимала на протяжении полугода. На фоне лечения частота приступов ГБ снизилась до 3–4 дней в месяц. Однако в период лечения пациентка значительно прибавила в весе (+10 кг), стала жаловаться на дневную сонливость, снижение концентрации внимания и работоспособности. Необходимо отметить, что в связи с этими побочными явлениями пациентка в дальнейшем отказывалась от приема любых антидепрессантов.
Через 2 месяца после отмены миртазапина приступы ГБ вновь участились, стали более продолжительными (сутки и более), присоединилась рвота на высоте ГБ. На протяжении последних 5 лет женщина неоднократно получала курсы «сосудистой» и ноотропной терапии, которые давали незначительное и кратковременное облегчение состояния; адекватная терапия мигрени не проводилась. В связи с ухудшением состояния (не менее 12 дней с ГБ в месяц, повышенная тревожность и диссомния) в 2019 г. пациентка впервые за всю историю своего заболевания обратилась к цефалгологу – специалисту по диагностике и лечению ГБ.
Объективный осмотр. В неврологическом статусе отклонений обнаружено не было; отмечена легкая болезненность при пальпации перикраниальных мышц с обеих сторон, аллодиния кожи головы, признаки повышенной тревожности пациентки во время беседы; артериальное давление – 115/75 мм рт.ст.; частота пульса – 74 в минуту.
Параклинические исследования. На протяжении последних 7 лет дважды проводилась МРТ головного мозга и 1 раз МР-ангиография артерий и вен головного мозга, при которых не было выявлено отклонений от нормы.
Во время консультации проведено тестирование по Госпитальной шкале тревоги и депрессии (Hospital Anxiety and Depression Scale/HADS): субшкала «тревога» – 12 баллов, субшкала «депрессия» – 7 баллов; результаты соответствовали «клинически выраженной тревоге».
Диагноз – «Частая эпизодическая мигрень без ауры. Тревожное расстройство. Диссомния».
История лечения (см. рисунок). Проведена поведенческая терапия, которая включила разъяснение механизмов развития приступов мигрени (в т.ч. роли болевого медиатора CGRP), необходимости избегания стрессов, других триггеров приступов и преодоления ЛА. Особое внимание уделено разъяснению роли факторов, которые способствовали прогрессирующему течению мигрени у пациентки (стресс, ЛА, тревога) и необходимости их контроля в будущем. Даны советы по модификации образа жизни: рекомендованы фитнес, вытеснение стрессов, положительные эмоции, водные процедуры, прогулки, хобби, полноценный отдых, посещение косметолога, снижение рабочих нагрузок.
Профилактическая терапия. С учетом жалоб пациентки и сопутствующих коморбидных нарушений цели лечения включали: 1) облегчение течения мигрени (снижение числа дней с ГБ, тяжести и продолжительности приступов); 2) лечение тревожного расстройства; 3) улучшение качества ночного сна; 4) преодоление ЛА.
Пациентке были предложены на выбор два вида терапии: а) традиционная пероральная профилактика мигрени и б) новая таргетная терапия Анти-CGRP(r) мАТ. Были разъяснены преимущества, возможные побочные эффекты и клинические перспективы каждого вида лечения. Необходимо отметить, что из-за повышенной тревожности и предшествовавшего негативного опыта применения миртазапина пациентка с недоверием относилась не только к антидепрессантам, но к любым видам терапии, особенно для нее не знакомым. В связи с тем что, по ее словам, она «не готова к новой терапии», женщина предпочла традиционную терапию пероральными препаратами.
Первая попытка лечения. В качестве базового профилактического средства был выбран пропранолол в целевой дозе 160 мг/сут (с постепенным титрованием дозы от 20 мг 2 раза в день до 80 мг 2 раза в день); при избыточном снижении АД рекомендовано уменьшить дозу до 40 мг (но не менее 20 мг) 2 раза в день. В связи со стойким нежеланием пациентки принимать антидепрессанты применение амитриптилина, венлафаксина и других средств было невозможным. Поэтому для лечения тревоги и улучшения ночного сна был назначен гидроксизин с постепенным в течение недели титрованием дозы от ½ таблетки 2 раза в день (25 мг/сут) до ½ таблетки утром и днем и 1 таблетки (50 мг/сут) в течение 2 месяцев с последующим постепенным снижением дозы и отменой препарата.
Преодоление ЛА включило следующие подходы: а) детоксикация в виде отмены суматриптана и других «виновных» обезболивающих на 3 недели; б) медикаментозная поддержка периода отмены. В связи с отказом пациентки от внутривенного лечения ГБ было применено альтернативное обезболивание пероральными средствами: целекоксиб по 100 мг/табл. 2 раза в день в течение 5 дней, затем в течение 3 дней также по 200 мг/сут, но только при возникновении умеренной или сильной ГБ (≥5 баллов по ВАШ); слабую ГБ было настоятельно рекомендовано не купировать. Далее до конца периода отмены было разрешено вместо триптанов и других привычных обезболивающих использовать и чередовать не чаще 2 раз в неделю простые анальгетики, который пациентка ранее не принимала (кетопрофен 150 мг, диклофенак 100 мг, диспергируемая форма ацетилсалициловой кислоты аспирин-экспресс 1000 мг).
Анализ эффективности терапии через 2 месяца по данным телефонного визита показал положительный эффект в виде снижения частоты приступов мигрени до 3 в месяц (не более 4 дней с ГБ в месяц) и их продолжительности (лишь один приступ за тот период длился более суток, остальные успешно купировались предложенными обезболивающими препаратами в течение нескольких часов). Необходимо отметить, что хорошо переносилась доза пропранолола 40 мг 2 раза в день (80 мг/сут.), большие дозы вызывали падение АД и общую слабость. На фоне приема гидроксизина пациентка отметила улучшение сна, а также снижение тревоги; назначенный курс пропила полностью (2 месяца) и постепенно отменила. Профилактическую терапию пропранололом в дозе 40 мг 2 раза в день пациентка принимала на протяжении еще 2 месяцев, затем в течение 1 месяца в дозе 20 мг 2 раза в день, после чего препарат был отменен. Пациентке рекомендовано связываться с врачом в случае ухудшения состояния.
Примерно через год пациентка обратилась повторно в связи с учащением приступов (до 14 дней с ГБ в месяц), увеличением приема триптанов и анальгетиков (повторный риск развития ЛИГБ), нарушением внимания и работоспособности. Ухудшение состояния женщина связывала с сильным стрессом (напряженная ответственная работа и болезнь матери).
Вторая попытка лечения. Пациентке вновь была разъяснена необходимость модификации жизни (снижение рабочих нагрузок, избегание и вытеснение стрессов, релаксация, фитнес и т.д.) и ограничения приема обезболивающих. Повторное назначение пропранолола 80 мг/сут. в сочетании с препаратом магния (магния цитрат 1855 мг/сут., что соответствовало 300 мг/сут. магния (Mg2+), было мало эффективным: через 2 месяца терапии число дней с ГБ существенно не изменилось, кроме того, даже на небольшой дозе β-адреноблокатора в тот раз возникало снижение АД и предобморочные состояния, из-за чего препарат был отменен.
В связи с отказом пациентки принимать антидепрессанты и риском ухудшения когнитивных функций в случае назначения топирамата пациентке повторно предложена терапия Анти- CGRP(r) мАТ, на которую в этот раз она согласилась.
Третья попытка лечения. Во время визита в клинику ГБ выполнена первая подкожная инъекция эренумаба в дозе 70 мг; рекомендованы еще две последовательные ежемесячные инъекции.
Через месяц после 1-й инъекции число дней с ГБ снизилось до 12 в месяц, после 2-й – до 8 и после 3-й – до 6 дней в месяц. Однако сохранялась значительная интенсивность ГБ и дезадаптация во время приступов. Кроме того, в конце второго месяца лечения пациентка отметила появление запоров.
С учетом эффективности тагретной терапии и в связи с развившимся нежелательным явлением принято решение о «переключении» с эренумаба на фреманезумаб – другой препарат класса Анти-CGRP(r) мАТ: в ближайшие 3 месяца были рекомендованы три последовательные ежемесячные подкожные инъекции препарата в дозе 225 мг. В течение первых 2 месяцев от начала лечения фреманезумабом наметилась устойчивая тенденция к снижению частоты приступов мигрени, а в течение 3-го месяца терапии пациентка отметила лишь 2 приступа, которые в течение 2 часов купировались суматриптаном. На терапии фреманезумабом побочных эффектов не возникло; пациентка выразила желание продолжить эту терапию еще в течение 3 месяцев.
Через 6 месяцев положительный эффект сохранялся: пациентка имела не более 2 непродолжительных приступов мигрени в месяц умеренной или легкой интенсивности. В связи с высокой эффективностью и отличной переносимостью пациенткой совместно с лечащим врачом принято решение о продолжении курса лечения до 12 месяцев.
Заключение
Новый метод лечения мигрени путем блокирования биологических эффектов CGRP является результатом более чем 30-летних исследований в области нейробиологии этого распространенного дезадаптирующего расстройства [23]. Разработка и внедрение в клиническую практику Анти-CGRP(r) мАТ принципиально изменили парадигму лечения мигрени, позволив прицельно (таргетно) влиять исключительно на периферические патофизиологические механизмы развития приступов посредством длительной блокады эффектов СGRP в тригемино-васкулярной системе [22]. Это принципиально отличает новый метод лечения от традиционных подходов к профилактике мигрени, в основном воздействующих на центральные аспекты патофизиологии заболевания [8, 23].
Более чем 5-летний мировой опыт применения нового метода в условиях реальной клинической практики доказал ряд преимуществ лечения Анти-CGRP(r) мАТ: быстрое начало обезболивающего действия в течение первых недель после введения и высокую эффективность, которая сохраняется длительное время после введения препарата даже у пациентов с отсутствием ответа на предшествовавшую профилактическую терапию и у пациентов с избыточным приемом обезболивающих лекарств; а также безопасность (профиль нежелательных явлений Анти-CGRP(r) мАТ сравним с плацебо), возможность применения в качестве моно- и в составе комбинированной терапии с пероральными препаратами или ботулинотерапией [19]. Требует дальнейшего изучения вопрос о целесообразности сочетания таргетной терапии с другими профилактическими средствами с целью прео-доления коморбидных нарушений и повышения эффективности лечения мигрени [39].
Применение Анти-CGRP(r) мАТ позволяет решать трудные задачи при длительном профилактическом лечении пациентов с мигренью, включая «переключение» с одного Анти-CGRP(r) мАТ на другой препарат этого класса при развитии нежелательных явлений или при «истощении» клинического эффекта после нескольких месяцев высокой эффективности [36, 44].
Приведенный в статье клинический случай подтверждает целесообразность «переключения» с одного Анти-CGRP(r) мАТ на другой. Этот клинический прием у описанной нами пациентки с частой ЭМ позволил значительно снизить частоту и тяжесть приступов, преодолеть злоупотребление обезболивающими препаратами, в конечном итоге – предотвратить развитие ЛИГБ и дальнейшую хронизацию мигрени. Кроме того, смена одного Анти-CGRP(r) мАТ на другой препарат того же класса позволила сохранять эффективность тагретной профилактической терапии в течение длительного времени [42–44].
Несмотря на появление в арсенале врачей новейших методов высокоэффективного лечения мигрени, разработанных на основе открытий в нейробиологии заболевания, остается не до конца решенной «старая» проблема своевременной диагностики мигрени и назначения адекватного лечения. Данный клинический случай еще раз подтверждает актуальность этой проблемы, поскольку правильный диагноз пациентке был впервые установлен только через 28 лет от дебюта заболевания. Отсутствие правильного диагноза и адекватного лечения привело к существенному ухудшению течения мигрени, формированию ЛА и высокому риску развития хронической ежедневной головной боли.
Таким образом, класс Анти-CGRP(r) мАТ является новым высокоэффективным и безопасным подходом к профилактике мигрени, в т.ч. у труднокурабельных пациентов. Применение Анти-CGRP(r) мАТ расширяет возможности успешного решения сложных клинических задач и повышает эффективность профилактического лечения мигрени в условиях реальной клинической практики.



