Современные достижения в изучении патогенеза и фармакотерапии сахарного диабета 2 типа (СД2) несомненно улучшили качество и прогноз жизни больных, страдающих данным заболеванием. Однако более чем двум третям пациентов с СД2 не удается достичь целевых значений гликемии [1]. Хроническая гипергликемия способствует быстрому прогрессированию всех осложнений СД, прежде всего сердечно-сосудистых, которые являются причиной не только преждевременной инвалидизации, но и смерти больных [1, 2]. Высокая распространенность хронической декомпенсации углеводного обмена имеет объективные и субъективные причины. Так, поздняя диагностика СД2 остается причиной
низкой эффективности большинства пероральных сахароснижающих препаратов. Практически все традиционные сахароснижающие средства не предотвращают потерю массы функционирующих ß-клеток, что сокращает период их эффективности при лечении больных СД2. Пациенты долгие
годы получают терапию, которая не обеспечивает целевых значений гликированного гемоглобина (HbA1c). Инсулинотерапию назначают значительно позже реальной потребности в данном виде лечения. Обоснованная тревога врачей и больных за опасность развития гипогликемии и прибавки
массы тела в сочетании с неудовлетворительным самоконтролем снижает эффективность титрации дозы инсулина до цели и замедляет сроки своевременной интенсификации инсулинотерапии.
Таким образом, на фоне неэффективной терапии, хронической гипергликемии и глюкозотоксичности
функциональная активность ß-клеток поджелудочной железы прогрессивно снижается, что в свою очередь еще более затрудняет приближение к цели терапии, а достижение стойкой ком-пенсации СД2 по-прежнему остается крайне сложной задачей.
В 1932 г. La Barre впервые предложил термин “инкретин” для гормона, выделенного из слизистой оболочки верхнего отдела кишечника и обладающего сахароснижающим эффектом [3]. Теперь очевидно, что именно тогда была заложена база для создания в будущем группы сахароснижающих
препаратов, основанных на эффектах инкретина. Феномен “инкретинового эффекта” получил свое подтверждение в 1960-е гг., когда было обнаружено, что секреция инсулина в ответ на пероральную нагрузку глюкозой в 1,5–2,0 раза превышает таковую в ответ на ее внутривенное введение при достижении одинакового уровня гликемии [4].
Двадцать пять лет назад был открыт один из основных инкретинов человека – глюкагоноподобный пептид-1 (ГПП-1), который немедленно выделялся в кровь из клеток кишечника при приеме пищи, оказывая мощное глюкозозависимое действие на секрецию инсулина и ингибирующее – на секрецию глюкагона. Многолетние исследования доказали эффективность этого гормона в плане не только
снижения гликемии, но и его положительного воздействия на ряд факторов риска атеросклероза у данного контингента больных. Полученные в процессе изучения ГПП-1 результаты легли в основу разработки и внедрения в клиническую практику двух новых групп препаратов: агонистов рецепторов глюкагоноподобного пептида-1 (ГПП-1) и ингибиторов дипептилпептидазы-4 (ДПП-4).
Последние международные и национальные стандарты лечения СД2, принятые в большинстве развитых стран, в т. ч. и в России, рекомендуют использовать препараты, основанные на эффектах инкретинов, в частности агонисты рецепторов ГПП-1, сразу при выявлении заболевания в качестве альтернативы традиционным сахароснижающим препаратам [5, 6]. Подобные рекомендации обусловлены не только высокой эффективностью последнего, но и безопасностью агонистов рецепторов ГПП-1 в плане развития гипогликемий. Кроме того, в отличие от ингибиторов ДПП-4 и тем более остальных групп сахароснижающих препаратов (кроме метформина) терапия агонистами ГПП-1-рецепторов позволяет существенно снижать вес пациентов с избыточной массой тела и ожирением [7].
Лираглутид (Виктоза®) – первый аналог человеческого ГПП-1, одобренный к применению в клинической практике в большинстве стран Европы, Северной Америки, Азии, в Мексике, России и Японии.
Высокая эффективность и безопасность терапии лираглутидом на разных стадиях СД2 как в монотерапии, так и в комбинации с одним или несколькими пероральными сахароснижающими препаратами подтверждена результатами масштабной программы клинических исследований 3-й фазы
LEAD (Liraglutide Effect and Action in Diabetes), в которой приняли участие более 4500 пациентов [8–13], и данными прямых сравнительных исследований с другими инкретиновыми препаратами, такими как эксенатид и ситаглиптин [13–16].
Сахароснижающаяэффективность лираглутида
Результаты рандомизированных клинических исследований и метаанализа программы LEAD доказывают
высокую сахароснижающую эффективность лираглутида [8–18]. Так, терапия лираглутидом в дозах 1,2 и 1,8 мг как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами приводит к достоверному снижению уровня HbA1c независимо от его исходного уровня (рис. 1). При этом наиболее выраженная положительная динамика (снижение уровня HbA1c на 2,5 %) отмечена в
группе пациентов, получавших лираглутид в дозе 1,8 мг и имевших худшие показатели гликемии в начале исследования [15–17, 19].
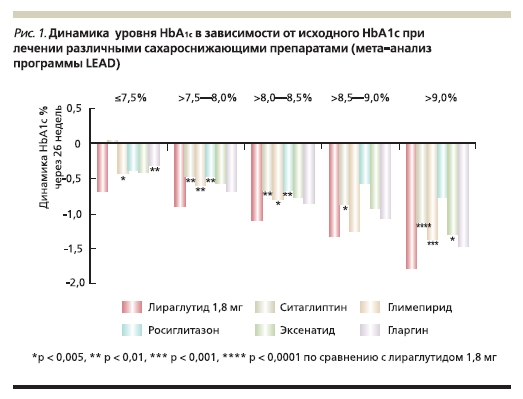
Применение лираглутида позволяет достигать целевого уровня HbA1c < 7,0 % более чем половине пациентов уже к 26-й неделе лечения. Так, целевого значения HbA1c достигли 56 и 65 % больных СД2 , получавших лираглутид в дозах 1,2 и 1,8 мг/сут соответственно, по сравнению с 30–53 % пациентов, получавших другие сахароснижающие препараты (p < 0,05 во всех случаях).
Результаты прямых сравнительных исследований лираглутида с эксенатидом (дважды в сутки) доказали его более высокую эффективность. Так, у больных, получавших лираглутид, уровень HbA1c снизился на 1,12 % от исходного, тогда как при лечении эксенатидом – всего на 0,7 % (p < 0,0001) [13]. Целевого значения HbA1c < 7,0 % при использовании лираглутида достигли 54 %, эксенатида – 43 % ( р< 0,005) пациентов [13]. Важно отметить, что перевод пациентов, не достигших цели лечения, с эксенатида
на лираглутид сопровождался дополнительным снижением уровня HbA1с (на -0,32 %, p < 0,0001) и увеличением числа пациентов, достигших целевого значения HbA1c < 7,0 %, с 43 до 57 % (рис. 2) [15].
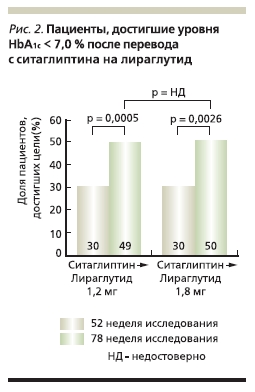
Аналогичные результаты были получены при прямом сравнении лираглутида с ситаглиптином [14]. Так,
целевого уровня HbA1c < 7,0 % при введении лираглутида достигли 43 % (1,2 мг/сут) и 55 % (1,8 мг/сут) больных, тогда как при лечении ситаглиптином – лишь 22 % (p < 0,0001) [14]. При этом наиболее выраженные различия в динамике уровня HbA1c отмечены у пациентов с исходным уровнем
HbA1c, превышавшим 10 %. Как и в прямом сравнительном исследовании с эксенатидом, перевод на лираглутид пациентов, не достигших цели лечения на фоне приема ситаглиптина, также сопровождался дополнительным снижением уровня HbA1c и увеличением числа пациентов, достигших значения HbA1c < 7,0 до 50 % (рис. 2) [16].
По данным мета-анализа всех завершенных и опубликованных прямых и непрямых сравнительных исследований, монотерапия больных СД2 препаратами, действие которых основано на инкретиновом эффекте, приводит к следующему среднему снижению уровня HbA1c [20]:
• лираглутид – на 1,03 % (95 % доверительный интервал [ДИ]: с -1,16 до -0,90; p < 0,001);
• эксенатид – на 0,75 % (95 % ДИ: с -0,83 до -0,67; p < 0,001);
• ситаглиптин – на 0,79% (95% ДИ: -0.93 до -0.65, p< 0.001);
• вилдаглиптин – на 0,67 % (95 % ДИ: с -0,83 до -0,52; p < 0,001).
Таким образом, лираглутид обладает выраженным эффектом в отношении снижения гликемии, превосходит не только традиционные сахароснижающие средства, но и другие доступные препараты, действие которых основано на эффектах инкретинов.
Влияние лираглутида на массу тела
Чрезвычайно важным дополнительным эффектом терапии агонистами рецепторов ГПП-1 является снижение массы тела в среднем на 1–4 кг от исходной [21–22]. Ингибиторы ДПП-4 не оказывают подобного влияния на массу тела больных СД2 [14, 22, 23]. Возможность снижения массы тела обеспечивается ГПП-1, концентрация которого при лечении агонистами рецептора ГПП-1 значительно
выше, чем при лечении ингибиторами ДПП-4.
Мета-анализ клинических исследований 3-й фазы LEAD показал, что применение лираглутида пациентами с СД2 имеет неоспоримое преимущество в отношении снижения массы тела по сравнению со всеми другими сахароснижающими препаратами (рис. 3) [7, 24].
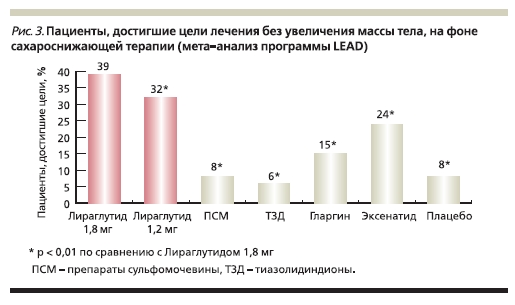
Снижение массы тела больных сопровождалось снижением объема талии (p < 0,0001), что свидетельствует об уменьшении количества висцерального жира (рис. 4). Как правило, наибольшая динамика в снижении массы наблюдалась среди пациентов с исходно более высоким индексом массы тела (ИМТ). Так, у 25 % больных с самым высоким исходным ИМТ на фоне терапии лираглутидом
масса тела снизилась в среднем на 7,7 кг [9].
Рисунок 4. Динамика ИМТ и объема талии на фоне терапии лираглутидом (мета-анализ программы LEAD) [24].
При прямом сравнении эффективности применения лираглутида и эксенатида снижение массы тела значимо не различалось и составило в среднем -3,2 и -2,9 кг соответственно (р = 0,2235) [13]. Однако перевод пациентов, ранее получавших эксенатид, на лираглутид сопровождался дополнительным снижением массы тела в среднем на 0,9 кг через 14 недель наблюдения (р < 0,0001) [15].
Влияние на частоту и выраженность гипогликемий
Уникальный глюкозозависимый механизм действия препаратов, основанный на эффектах инкретинов, сводит риск развития гипогликемических состояний на фоне их приема к минимуму.
В программе 3-й фазы клинических исследований LEAD на фоне терапии лираглутидом тяжелые гипогликемии, потребовавшие посторонней помощи, отмечались крайне редко, исключительно на фоне применения лираглутида в комбинации с препаратами сульфонилмочевины (зарегистрированы у 0,3 % пациентов, частота – 0,06 эпизода/пациенто-года) 8–12].
Частота легких гипогликемий на фоне терапии лираглутидом была сопоставимой с таковой при лечении ингибиторами ДПП-4 (ситаглиптином) и составляла 0,178 эпизода/пациенто-года для лираглутида (1,2 мг/сут) и 0,106 эпизода/пациенто-года для ситаглиптина [14]. Различий в частоте
легких гипогликемий между сравниваемыми препаратами не было (по 5 % в обеих группах).
Таким образом, терапия лираглутидом как эффективна, так и безопасна в плане развития гипогликемий. Комбинация лираглутида с производными сульфонилмочевины не только бессмысленна с точки зрения механизма действия обоих препаратов, но и может провоцировать возникновение
гипогликемических состояний.
Внепанкреатические эффекты лираглутида
Лираглутид оказывает положительное влияние на уровень систолического артериального давления – АД [8–13, 25], а также на другие маркеры сердечно-сосудистого риска (уровни общего холестерина, триглицеридов, липопротеидов низкой плотности, свободных жирных кислот, мозгового натрийуретического пептида и C-реактивного белка высокой чувствительности) [10–12].
Безопасность и переносимость лираглутида
Результаты клинических испытаний, а также данные клинической практики доказали, что терапия лираглутидом прекрасно переносится и имеет высокий профиль безопасности. Самый частый побочный эффект от лечения лираглутидом – тошнота, которая обычно наблюдается в самом начале терапии, слабо выражена, носит кратковременный, преходящий характер и не требует коррекции терапии. При
прямом сравнении с ингибиторами ДПП-4 через полгода лечения лираглутидом частота жалоб на тошноту не отличается от таковой при приеме ситаглиптина [14].
В целях предупреждения этого возможного побочного эффекта при старте терапии агонистами ГПП-1 необходимо следовать рекомендациям по постепенному увеличению дозы. Так, согласно одобренной инструкции по медицинскому применению, стартовая доза лираглутида составляет 0,6 мг один раз в сутки с последующим ее увеличением через неделю до 1,2 мг/сут. В случае отсутствия возможности
достижения цели терапии на этом режиме лечения доза лираглутида может быть увеличена до 1,8 мг/сут.
Таким образом, врачи и пациенты наконец получили реальную возможность эффективного многофакторного и безопасного управления диабетом.
Ниже представлено два клинических случая терапии СД2 препаратом Виктоза®, подтвердивших эффективность и безопасность его применения в условиях реальной клинической практики.
Больной Б. 56 лет. Сахарный диабет выявлен три года назад случайно. Гликемия натощак соответствовала 8,5 ммоль/л, НbА1с – 7,8 %. Были даны рекомендации по изменению образа жизни и назначен метформин в дозе 850 мг перед сном. Через 2 недели самостоятельно отменил метформин по
причине побочных гастроэнтеральных явлений. Никаких сахароснижающих препаратов не получал. При обращении на консультацию в декабре 2010 г. масса тела – 112 кг, ИМТ – 33,9 кг/м2, объем талии – 132 см, НbА1с – 8,1 %, гликемия натощак – от 7,5 до 9,5 ммоль/л, после еды – от 8,0 до 11,5
ммоль/л, холестерин – 7,8 ммоль/л, АД – 150/100 мм рт. ст. По поводу артериальной гипертензии пациент получает индапамид 2,5 мг, лозартан 50 мг. С целью улучшения гликемического контроля больному была рекомендована Виктоза® в дозе 0,6 мг/сут в течение первой недели. C учетом прекрасной переносимости назначенной терапии со второй недели доза препарата была увеличена до 1,2 мг/сут. Через три месяца лечения уровень НbА1с снизился на 1,2 % и достиг 6,8 %. За это время
масса тела снизилась на 7 кг (при контроле: масса тела – 105 кг, ИМТ – 31,8 кг/м2, объем талии – 128 см). Несмотря на отсутствие коррекции дозы антигипертензивных препаратов, АД стойко снизилось до 140/85 мм рт. ст. Больной отмечает хорошую переносимость препарата Виктоза®. За весь период лечения ни одной гипогликемической реакции зарегистрировано не было. При этом сам пациент отме-
чает, что терапия препаратом Виктоза® позволила ему изменить стереотип питания. Через 2 года монотерапии препаратом Виктоза® в дозе 1,2 мг/сут пациенту удается поддерживать уровень НbА1с 6,2 %, массу тела – 98 кг, ИМТ – 29,7 кг/м2, объем талии – 120 см, АД – не выше 130/80 мм рт. ст., холестерин – 5,1 ммоль/л (противолипидемическую терапию не получает).
Больная Ф. 69 лет. СД2 выявлен около 7 лет назад. Постоянно получает метформин в дозе 2000 мг/сут.
В течение первых четырех лет заболевания постпрандиальную гликемию корригировала производными сульфонилмочевины, в последующие два года – ингибиторами ДПП-4 (вилдаглиптином, ситаглиптином). Больная мотивирована на лечение, проводит регулярный самоконтроль гликемии в
домашних условиях. Основной жалобой больной является постоянная прибавка массы тела, которую она объясняет хроническим чувством голода, с которым не может справиться. Так, за время лечения СД2 прибавила около 10 кг. Год назад услышала от знакомой о препарате Виктоза®, обсудила целесообразность и возможность перехода на терапию препаратом.
Получает метформин в дозе 2000 мг/сут и ситаглиптин в дозе 100 мг/сут. На этом фоне уровень НbА1с – 7,7 %, масса тела – 88 кг, ИМТ – 31,9 кг/м2, объем талии – 92 см. Гликемия натощак обычно выше 7,0 ммоль/л. Постпрандиальная гликемия четко зависит от характера питания и, как правило, не превышает 10,0 ммоль/л. При переводе на лечение препаратом Виктоза® (0,6 мг/сут, далее 1,2 мг/сут)
ситаглиптин был отменен, а метформин оставлен в той же дозе. В начале лечения пациентка отмечала чувство легкой тошноты, которое абсолютно не отразилось на качестве ее жизни, но
помогло резко сократить объем принимаемой пищи и облегчило соблюдение рекомендуемой диеты.
Через месяц лечения препаратом Виктоза® больная обнаружила, что у нее изменились пищевые предпочтения. Так, животный белок, который ежедневно присутствовал в пищевом рационе, был вытеснен продуктами растительного происхождения.Через год лечения препаратом Виктоза® и метформином уровень НbА1с снизился до 5,8 %. Гликемия натощак не превышает 6,0 ммоль/л, а после еды – 7,0 ммол/л. Масса тела снизилась на 16 кг (до 72 кг), ИМТ – 26,1 кг/м2. Объем талии уменьшился на 10 см (82 см). Пациентка прекрасно переносит препарат Виктоза®. За весь период лечения не было ни одного эпизода гипогликемического состояния. Больная воодушевлена результатами лечения, настроена на дальнейшую терапию и снижение массы тела.
Итак, сахароснижающие препараты, механизм действия которых основан на эффектах инкретинов, представляют собой совершенно новый и уникальный класс лекарственных средств, обеспечивающих патогенетически обоснованный комплексный терапевтический подход к лечению больных СД2. Результаты завершенных клинических исследований и опыт применения в реальной клинической практике убедительно показали, что в настоящее время Виктоза® – это наиболее эффективное и безопасное лекарственное средство для достижения целей терапии больных СД2 на ранних этапах его лечения. Тонкий глюкозозависимый механизм действия препаратов этой группы позволяет большинству больных СД2 достигать цели лечения без увеличения риска развития гипогликемий. Безопасность лираглутида существенно увеличивает шансы безопасного достижения оптимального контроля, улучшения долгосрочного прогноза и снижения сердечнососудистого риска, особенно для
лиц пожилого возраста и пациентов с сердечно-сосудистыми заболеваниями. Возможность эффективного и стойкого снижения массы тела при использовании лираглутида является важным аргументом в пользу его назначения при выборе терапии больных СД2 с избыточной массой тела
или ожирением.



