Введение
В настоящее время псориаз и псориатический артрит объединены в одно понятие «псориатическая болезнь», которая представляет собой распространенное (~2–3% популяции) хроническое рецидивирующее воспалительное заболевание, поражающее кожу и суставы и связанное с рядом коморбидных сопутствующих заболеваний сердечно-сосудистой, нервной, выделительной, эндокринной систем и с метаболическими нарушениями. Сложные этиопатогенетиеские процессы псориаза связаны с аберрантным иммунным ответом вследствие генетической предрасположенности и воздействия триггерных экзогенных факторов (травмы, инфекции, лекарственные препараты). Изучение молекулярных и клеточных путей патогенеза псориаза с идентификацией цитокинов (фактор некроза опухоли-α – ФНО-α), интерлейкин-17 – ИЛ-17, -23, -22, -12), играющих роль в процессах аутовоспаления, привело к разработке высокоэффективных таргетных терапевтических препаратов, включающих ингибиторы ФНО-α, ИЛ-17, -23, -12 или -36, низкомолекулярные препараты, такие как ингибиторы фосфодиэстеразы-4 (апремиласт), ингибиторы янус-киназы (JAK), ингибиторы RORγt. Более того, прогресс в изучении патогенеза псориатической болезни не останавливается и нацелен на эпигенетические механизмы (такие, как метилирование ДНК, модификации хроматина и регуляция некодирующих РНК), что приводит к открытию потенциально новых терапевтических мишеней для лечения псориаза [1].
Патогенез псориаза включает механизм воспаления с прямой связью, включающий в первую очередь T-хелперные клетки типа 17 (TH17) и путь ИЛ-23 [2].
Рассмотрим препараты, воздействующие на данные пути патогенеза, опытом применения которых мы хотели бы поделиться в данной статье. Начальным препаратом выбора для терапии больного псориазом тяжелого течения и псоритическим артритом стал ингибитор ИЛ-17 (секукинумаб), далее вследствие ускользания эффекта и развития осложнения в виде хронического кандидоза складок пациент переведен на ингибитор ИЛ-23 (гуселькумаб).
ИЛ-17 играет одну из ключевых ролей в патогенезе псориаза, он действует как двигатель воспаления и индуцирует выработку цитокинов, таких как ФНО-а, которые рекрутируют нейтрофилы и моноциты в месте активации Т-клеток, приводит к самоподдерживающейся гиперпролиферации кератиноцитов. Среди многих подтипов уровни ИЛ-17A, в частности, повышены при псориатических поражениях и могут действовать непосредственно на кератиноциты, индуцируя экспрессию других провоспалительных молекул [3].
Секукинумаб представляет собой моноклональное антитело иммуноглобулина G1k (IgG1k) человека, которое избирательно нейтрализует ИЛ-17A. По результатам клинических испытаний фаз I–III частота побочных эффектов существенно не различалась между группами, получавшими секукинумаб в дозах 300 и 150 мг, плацебо и этанерцепт. Наиболее частыми побочными эффектами, связанными с секукинумабом, были назофарингит, диарея и острые респираторные вирусные инфекции (ОРВИ). Объединенный анализ 10 клинических исследований фаз II и III секукинумаба показал, что назофарингит и ОРВИ значительно чаще встречались у пациентов, получавших длительную терапию секукинумабом, по сравнению с теми, кто принимал плацебо. Кроме того, у пациентов, получавших секукинумаб, наблюдалось дозозависимое увеличение числа несерьезных инфекций, вызванных грибами рода Candida и вирусом герпеса. Частота серьезных побочных эффектов была сопоставимой между пациентами, получавшими секукинумаб в дозе 300 и 150 мг и плацебо (2,0%, 2,0, 1,7%).
Побочным эффектом секукинумаба, представляющим особый интерес, является воспалительное заболевание кишечника (ВЗК). Объединенный анализ данных всех пациентов с псориазом, получивших по крайней мере одну дозу секукинумаба, показал, что частота ВЗК с поправкой на экспозицию на 100 пациенто-лет была сопоставимой между пациентами, получавшими секукинумаб в дозах 300 и 150 мг и этанерцепт (0,26, 0,35 и 0,34 соответственно). Тем не менее предыдущиее рандомизированное двойное слепое плацебо-контролируемое клиническое исследование секукинумаба при болезни Крона выявило значительно более высокий индекс активности болезни Крона (CDAI) и частоту побочных эффектов в группе лечения секукинумабом по сравнению с плацебо. Начало болезни Крона наблюдалось у пациентов с индивидуальной или семейной историей ВЗК.
Секукинумаб продемонстрировал низкую иммуногенность как в экспериментах in vitro, так и в клинических испытаниях. В клинических испытаниях фазы III у 10 (0,4%) из 2842 субъектов, получавших секукинумаб, вырабатывались антилекарственные антитела, большинство из которых были не нейтрализующими.
ИЛ-23 активируется при псориатической болезни и считается основным регулятором пути Th17, участвующего в патогенезе псориаза. ИЛ-23 в основном продуцируется антиген-презентирующими клетками, индуцирует, и поддерживает дифференцировку клеток Th17 и Th22, которые продуцируют провоспалительные цитокины, такие как ИЛ-17 и -22, которые опосредуют воспаление и процессы гиперплазии эпидермиса. ИЛ-23 состоит из субъединиц p19 и p40, которые связываются с рецепторами ИЛ-23 (ИЛ-23R) и ИЛ-12b1 (ИЛ-12Rb1), что приводит к активации провоспалительной янускиназы-2 (JAK2), тирозинкиназа-2 (TYK2) и сигнальные молекулы преобразователя сигнала и активатора транскрипции (STAT). Антагонизм к ИЛ-23 блокирует нижестоящие эффекторные цитокины, наблюдаемые при псориазе, такие как ИЛ-17A, -17F, -22, и ФНО, секретируемый Т-клетками, естественными клетками-киллерами, врожденными лимфоидными клетками 3-го типа, нейтрофилами и тучными клетками.
Гуселькумаб представляет собой полностью человеческое λ-антитело IgG1, которое связывается с субъединицей p19 ИЛ-23 и ингибирует ИЛ-23специфическую внутриклеточную и нижестоящую передачу сигналов.
В клинических испытаниях фаз I, II и III гуселькумаба частота побочных эффектов была сопоставимой между группами гуселькумаба, плацебо и адалимумаба (только фазы II и III) на протяжении всего периода испытаний. Не было доказательств связи между дозой гуселькумаба и частотой побочных эффектов. В исследованиях фазы III наиболее частыми побочными эффектами у пациентов, получавших гуселькумаб, были назофарингит, головная боль и ОРВИ. Частота серьезных инфекций, злокачественных новообразований и серьезных побочных эффектов со стороны сердечнососудистой системы (MACE) не увеличивалась у пациентов, получавших гуселькумаб, по сравнению с плацебо и адалимумабом. ОРВИ чаще встречались у пациентов, получавших адалимумаб, по сравнению с гуселькумабом. Было пять случаев немеланомного рака кожи, четыре из которых были в группе гуселькумаба (2 БКК и 3 ПКК), а один – в группе адалимумаба.
Антитела к гуселькумабу были обнаружены у 5,3 (VOYAGE 1) и 6,6% (VOYAGE 2) пациентов до 48-й недели. Титры, как правило, были низкими (81% 1:320), и не наблюдалось связи между образованием антител и снижением эффективности или возникновением побочных эффектов [4].
Клинический случай
В 2018 г. в ФГБУ «Поликлиника № 1» УДП РФ в отделение дерматовенерологии и косметологии обратился пациент Г., мужчина 63 лет, страдавший псориазом в течение 25 лет, из которых 10 лет беспокоят боли в суставах. Характер заболевания непрерывно рецидивирующий с тяжелым течением. Кожный процесс носит распространенный хронический воспалительный характер, представлен типичными псориатическим папулами и бляшками, расположенными на коже туловища, верхних и нижних конечностях, на волосистой части головы, отмечаются поражение ногтевых пластин стоп и кистей, изменения по типу «масляного пятна» и «наперстка». Индекс PASI – 53,9 (рис. 1–4).
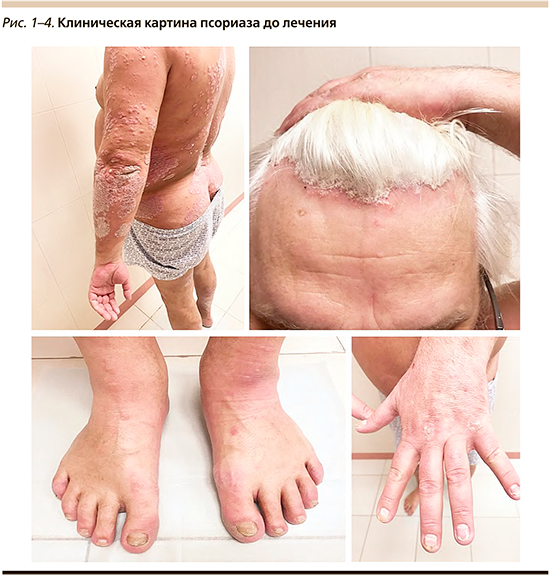
Ранее пациент получал наружную гормональную терапию метотрексатом без выраженного эффекта.
Пациент длительно наблюдается у терапевта, эндокринолога, гастроэнтеролога, ревматолога. Сопутствующие заболевания: ишемическая болезнь сердца: атеросклеротическая болезнь сердца, гипертоническая болезнь (ГБ) II стадии 2-й степени, риск очень высокий, гипертрофия левого желудочка, нарушение ритма и автоматизма сердца: повторные эпизоды сино-атриальной блокады без гемодинамически значимых пауз; одиночная желудочковая экстрасистолия. Недостаточность кровообращения I, стенозирующий обструктивный билатеральный каротидный атеросклероз, инсулиннезависимый сахарный диабет 2 типа (СД2) без осложнений, нетоксический узловой зоб до 1 см, ожирение 2-й ст., НПВС (нестероидные протвовоспалительные средства)-гастропатия: эрозивный гастрит, эрозивный бульбит, ремиссия. Стеатогепатит умеренной степени активности, фиброз печени, хронический некалькулезный холецистит, ремиссия, дискинезия желчевыводящих путей, долихосигма, хронический поверхностный колит, спондилоартрит с преимущественным поражением грудного отдела позвоночника, сакроилеит 2-й ст. ФН 1, подагра. Пациент получает соответствующую базисную терапию.
В связи с тяжелым течением псориаза, поражением суставов, неэффективностью базисной противовоспалительной терапии с декабря 2018 г. пациенту назначено лечение ингибитором ИЛ-17 секукинумабом по стандартной схеме (300 мг в виде подкожной инъекции в качестве начальной дозы на 0, 1-й, 2-й, 3-й неделях с последующим ежемесячным введением в качестве поддерживающей дозы начиная с 4-й недели) с положительным эффектом.
После 5-й инъекции отмечен регресс боли в суставах, псориатических высыпаний на коже туловища и конечностей, сохраняются высыпания в области паховых и подмышечных складок, на коже волосистой части головы и изменения ногтевых пластин стоп (рис. 5–9).
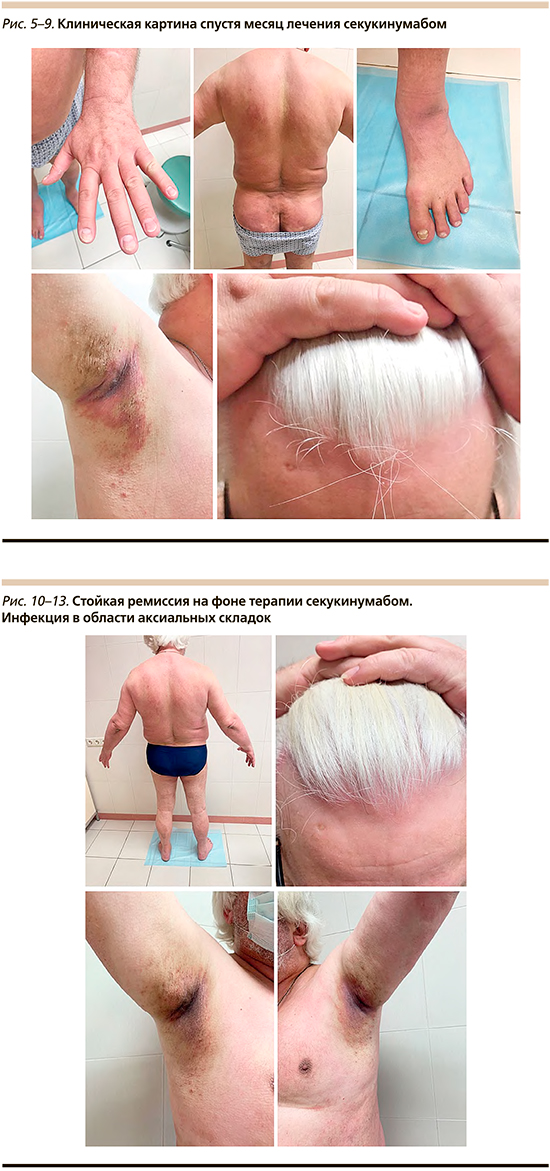
С декабря 2018 по 2021 г. получал терапию препаратом секукинумаб с положительным эффектом по PASI-100. На фоне терапии отмечено развитие побочных эффектов в виде высыпаний в области аксиальных и паховых складок. Высыпания в области подмышечных впадин и паховых складок пациент впервые отметил в феврале 2019 г. (рис. 10–13).
Субъективно беспокоили болезненность и жжение. При двукратном микологическом исследовании Candida не обнаружена, возможно на фоне постоянной мазевой терапии комбинированными глюкокортикостероидными препаратами. Грибковая инфекция была подтверждена после перерыва в наружном лечении. При БАК-посеве получен рост Staphylococcus aureus и Proteus mirabilis. Наружная терапия комбинированными противогрибковыми и антибактериальными препаратами давала положительный эффект.
В 2021 г. на 3-й год лечения секукинумабом отмечено развитие вторичной неэффективности терапии ингибитором ИЛ-17, которая проявилась в виде возобновления псориатических высыпаний на коже туловища, волосистой части головы и конечностей, складок кожи и изменений ногтевых пластин (рис. 14–17).
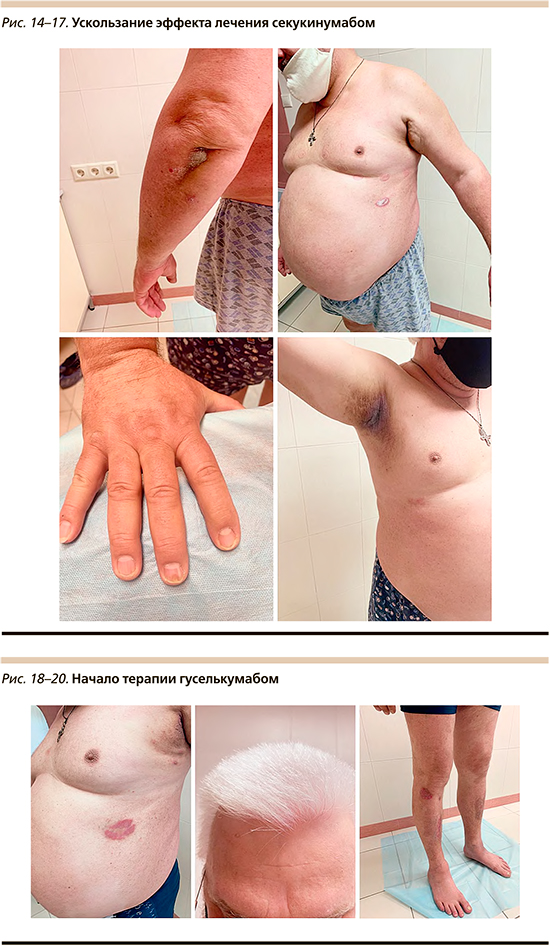
В связи с ускользанием терапевтического эффекта блокатора ИЛ-17 рекомендовано переключение на другой класс генно-инженерной биологической терапии – блокатор ИЛ-23 (гуселькумаб). Пациент получал препарат гуселькумаб в дозировке 100 мг в виде подкожной инъекции, вторая инъекция осуществлялась через 4 недели после первой с последующими введениями 1 раз каждые 8 недель. На фоне лечения отмечены улучшение клинической картины, хорошая переносимость, уменьшение высыпаний в складках (рис. 18–20).
Оценивая динамику течения сопутствующих заболеваний с 2017 г., можно отметить, что ухудшение наблюдается преимущественно со стороны углеводного обмена (в 2017 г. – нарушение толерантности к глюкозе, в 2021 г. – инсулиннезависимый СД2 без осложнений) и состояния печени (с 2019 г. новый диагноз – фиброз печени). В феврале 2020 г. пациент перенес окклюзивный тромбоз поверхностной вены левой верхней конечности. Остальные состояния без выраженной отрицательной динамики.
Обсуждение
В настоящее время доказана роль ИЛ-17 в патогенезе многих иммуноопосредованных заболеваний, в их число входят ревматоидный артрит, болезнь Бехтерева, рассеянный склероз, хронические воспалительные заболевания кишечника и псориаз. Основными мишенями для ИЛ-17 являются кератиноциты, эндотелиальные клетки и клетки врожденного иммунитета. Было обнаружено, что уровни ИЛ-17A, -17C и -17F значительно повышены у больных псориазом, при этом ИЛ-17A наиболее биологически активен [5].
Помимо патологического действия на иммунокомпетентные клетки ИЛ-17 играет важную роль в иммунных реакциях против инфекций слизистых оболочек и кожи, в первую очередь ИЛ-17-опосредованный иммунитет необходим для защиты кожи и слизистых оболочек против Candida albicans. Рецидивирующий и персистирующий кандидоз кожи и слизистых оболочек зарегистрирован у пациентов с генетическими дефектами, вызывающими иммунные нарушения, связанные с ИЛ-17. Поэтому стоит ожидать увеличения частоты кандидозных инфекций у пациентов, получавших антагонисты ИЛ-17A [6].
Инфекции, вызванные Candida spp., были зарегистрированы у 4,0% пациентов, получавших бродалумаб, 1,7% – секукинумаб и 3,3% – иксекизумаб по сравнению с 0,3%, 2,3 и 0,8% пациентов, получавших плацебо, устекинумаб или этанерцепт соответственно. Выявлено, что частота возникновения кандидозной инфекции дозозависима и риск ее развития увеличивается во время анти-ИЛ-17-терапии, осложнение характеризуется легким или среднетяжелым течением, склонным к самостоятельному разрешению, чувствительно к стандартной терапии [7]. Также установлено, что пациенты, страдающие среднетяжелым и тяжелым псориазом, имеют потенциально более высокие риски развития инфекционных осложнений. Однако механизм, с помощью которого псориаз предрасполагает к инфекции, до сих пор не ясен. Возможно определенную роль играет иммунная дисрегуляция, характеризующаяся повышением уровней ФНО и ИЛ-17, а также применение системных иммунодепрессантов [8, 9]. Z.Z. Yiu et al. выявили, что у пациентов с псориазом риск развития серьезных осложнений выше (20,5% на 1000 человеко-лет) по сравнению с таковыми без псориаза (16,5% на 1000 человеко-лет), особенно в дыхательной системе и мягких тканях/коже [10]. Более высокий риск оппортунистических инфекций и опоясывающего герпеса выявлен у пациентов, которые получали лечение от умеренного до тяжелого псориаза, и был связан с иммуносупрессивной терапией [11]. Кроме того, ИЛ-17 и -23 являются провоспалительными цитокинами, участвующими в защите от внеклеточных бактерий и грибков. Следовательно, когда продукция ИЛ-17 снижена, могут наблюдаться рецидивирующие инфекции S. aureus и C. albicans. Фазы II и III исследований анти-IL-17 и анти-ИЛ-23 не выявили повышенного риска серьезных инфекций. Однако постмаркетинговые исследования выявили повышенный риск оппортунистических инфекций, таких как кандидоз пищевода, опоясывающий герпес, пневмония и даже комплексные инфекции Mycobacterium avium, особенно при использовании анти-ИЛ-23 препаратов [12, 13].
C. albicans – наиболее распространенный вид, вызывающий наиболее распространенную грибковую инфекцию у людей, является микроорганизмоммишенью для ИЛ-17-опосредованного иммунного ответа. C. albicans входит в состав микобиоты здорового человека, колонизируя несколько участков тела человека, в т.ч. слизистую оболочку полости рта. У иммунокомпетентных пациентов грибок существует в гармонии с другими представителями микробиома. Однако дисбиоз микробиоты и нарушение этого баланса могут приводить к увеличению количества C. albicans и вызывать инфекцию. В ротовой полости β-глюканы, экспонированные гифами Candida, регулируют активацию пути Dectin-1/CARD9, что приводит к продукции ИЛ-1, -6 и -23 антигенпрезентирующими популяциями, находящимися в эпителии. Кандидализин, пептидаза, секретируемая гифальной формой C. albicans, повреждает эпителиальные клетки, что приводит к секреции ИЛ-1 и -36. Эти сигналы управляют экспрессией ИЛ-17, который управляет несколькими иммунными событиями, индуцирующими фунгицидные β-дефенсины, а также нейтрофил-активирующие хемокины CXC и гемопоэтин G-CSF [14].
Заключение
В настоящее время установлено, что пациенты, страдающие псориазом, особенно среднетяжелого и тяжелого течения, находятся в группе риска по развитию инфекционных осложнений вследствие нарушения иммунной защиты от бактериальных и грибковых агентов. Чаще всего пациенты с псориазом имеют ряд сопутствующих коморбидных заболеваний, например сахарный диабет, нефропатию, которые делают пациентов более уязвимыми в отношении оппортунистических и условно-патогенных микроорганизмов. Более того, риск сопутствующих инфекций может повышаться при применении некоторых иммуносупрессивных препаратов, поэтому при подборе препарата для лечения пациента с псориазом рекомендуется тщательно его обследовать на возможные латентные системные инфекции и учитывать наличие сопутствующих заболеваний.



