Введение
Статины относятся к часто назначаемым препаратам [1–3]; они используются как для первичной, так и для вторичной профилактики, способствуя снижению сердечно-сосудистой и общей смертности [3, 4]. Широкое применение статинов актуализирует проблему их неблагоприятных побочных эффектов, в т.ч. в отношении поперечнополосатой мускулатуры. Среди факторов риска статининдуцированных миопатий (СИМ) наряду с возрастом, женским полом, приемом алкоголя, заболеваниями печени и почек, высокими дозами статинов [5–7] и полиморфизмом гена SLCO1B1*5 (c.521T>C) [8] также выделяется гипотиреоз [7, 9], который и сам по себе служит одной из причин возникновения мышечных нарушений.
Гипотиреоз, являясь распространенным заболеванием [10], может вносить существенный вклад в увеличение сердечно-сосудистого риска [11–14]; в свою очередь именно пациенты с высоким риском сердечно-сосудистых заболеваний (ССЗ) чаще всего получают статины. С этой точки зрения клиническая ситуация, когда больной гипотиреозом нуждается в терапии статинами и получает ее, достаточно типична.
Известно, что при наличии некомпенсированного гипотиреоза риск возникновения СИМ возрастает. Так, E. Bruckert и соавт. (2005) установили, что нелеченый гипотиреоз увеличивает возможность развития СИМ в 1,7 раза [15]. В работе D. Craig было выявлено, что наличие гипотиреоза может увеличивать риск непереносимости статинов в 1,58 раза, повышая вероятность возникновения побочных эффектов, в т.ч. со стороны поперечнополосатой мускулатуры, сокращая при этом возможность их использования [16].
Однако вопрос, в какой степени наличие компенсированного гипотиреоза влияет на частоту и тяжесть возникновения статинассоциированных мышечных поражений, остается открытым. Прямых исследований в литературе не описано.
В ряде же инструкций к лекарственным препаратам группы статинов встречаются предупреждения о риске их приема при гипотиреозе, что нередко вызывает настороженность у пациентов и врачей, может негативно влиять на приверженность лечению, тем самым существенно ухудшая прогноз ССЗ.
Все это определяет актуальность дальнейшего изучения всех нерешенных вопросов, касающихся риска и клинико-патогенетических особенностей возникновения мышечных проявлений у пациентов с компенсированным гипотиреозом, принимающих статины.
Цель настоящего исследования – оценить частоту мышечных симптомов и их связь с биохимическими маркерами мышечных поражений у пациентов, находящихся на статинотерапии, в зависимости от наличия или отсутствия компенсированного гипотиреоза.
Материал и методы
Проведено одномоментное поперечное сравнительное исследование с включением 120 женщин, распределенных в 3 группы численностью по 40 пациенток в каждой. Первую (основную) группу составили женщины с гипотиреозом, получавшие терапию статинами. Вторая группа была представлена пациентками без гипотиреоза, принимавшими статины. В третью группу вошли больные гипотиреозом, не принимавшие статины.
Таким образом, основная группа наблюдения (лица с гипотиреозом, получающие статины) сравнивалась с двумя контрольными группами («только статины» и «только гипотироз»).
Показания к назначению статинов в группах 1 и 2, как и их дозы, определялись лечащими врачами и в большинстве случаев представляли собой вторичную профилактику ишемической болезни сердца (ИБС). В обеих группах все включенные в исследование пациентки принимали статины в низких и средних дозах (аторвастатин и симвастатин до 40 мг и розувастатин до 20 мг) и имели продолжительность терапии от 6 месяцев до 2 лет, что соответствует времени наиболее частого проявления СИМ [17, 18].
В исследование не включались пациентки с сахарным диабетом, злокачественными новообразованиями и врожденными миопатиями.
Во всех группах было проведено общеклиническое обследование с использованием стандартных лабораторных и инструментальных методик, выполнена оценка липидного спектра (общий холестерин – ХС, липопротеиды высокой плотности – ЛПВП, липопротеиды низкой плотности – ЛПНП, триглицериды – ТГ), а также маркеров мышечного поражения (креатининфосфокиназа – КФК, лактатдегидрогеназа – ЛДГ, миоглобин крови). Исследования проводились на базах клинико-диагностических лабораторий ГБУЗ НО «Клинический диагностический центр» и ГБУЗ НО «ГКБ № 5» Нижнего Новгорода.
Для оценки клинической симптоматики поражения мышечной ткани использовали валидизированные общепризнанные опросники.
Для оценки тяжести болевого синдрома, его локализации и влияния на качество жизни пациенток применялся «краткий опросник боли» BPI (Brief Pain Inventory), первоначально разработанный для исследования боли у больных раком [18, 19]. Он доказал свою эффективность при оценке боли, вызванной широким спектром причин, в т.ч. и нейромышечной боли [20–22]. Все пункты BPI оценивались с помощью рейтинговых шкал. Первые четыре шкалы оценивали интенсивность боли. При анализе последующих семи шкал оценивали влияние болевого синдрома на основные параметры качества жизни, характеризующие различные аспекты повседневной жизни пациенток (общая активность, настроение, способность ходить, работоспособность, сон и способность радоваться жизни), с использованием баллов от 0 (отсутствие влияния) до 10 (максимально возможное влияние боли какой-либо из показателей). В свою очередь все шкалы объединялись в два интегральных параметра: 1) индекс тяжести боли PSI (Pain severity index) – среднее арифметическое из суммы баллов четырех шкал, описывающих боль, 2) индекс интерференции (вмешательства) PII (Pain interference index) – среднее арифметическое семи шкал, оценивавших уровень вмешательства боли в повседневную жизнь пациента [23]. Кроме того, опросник содержал диаграмму для учета локализации боли.
Жалобы на слабость оценивались с помощью валидизированного «краткого опросника слабости» BFI (Brief Fatigue Inventory), разработанного в 1999 г. C.S. Cleeland, T.R. Mendoza и соавт. (M.D. Anderson Cancer Center, Houston Texas) [24–26]. Опросник заполнялся соответственно ощущениям пациентки, испытываемым за последние 24 часа, и содержал 9 рейтинговых шкал. Первые 3 вопроса характеризовали слабость (усталость, утомление) на данный момент и оценивались по аналоговой шкале в баллах от 0 (отсутствие слабости) до 10 (наивысшая степень слабости). Следующие 6 вопросов определяли вмешательство слабости в повседневную деятельность, включая настроение, способность ходить, выполнять ежедневные обязанности на работе и дома, отношение с людьми и способность радоваться жизни. Оценка осуществлена также в баллах (0 – отсутствие влияния слабости на ту или иную составляющую жизнедеятельности, 10 – наивысшая мера вмешательства слабости в один из аспектов жизни больного). Затем рассчитывались три интегральных параметра: 1) индекс тяжести слабости FSI (Fatigue severity index) – среднее арифметическое из суммы баллов трех шкал, характеризующих слабость, 2) индекс интерференции (вмешательства) FII (Fatigue interference index) – среднее арифметическое шести шкал, оценивающих уровень вмешательства слабости в жизнедеятельность пациента, 3) суммарный индекс слабости FTI (Fatigue total index) – среднее арифметическое всех шкал.
По данным медицинских карт и выписок уточнялось наличие ряда заболеваний, которые могли бы приводить к появлению похожих жалоб, а именно: наличие полиневропатии нижних конечностей, варикозной болезни и заболеваний, сопровождающихся вертеброгенным синдромом. В отсутствие данных, но при наличии болей в мышцах больной консультировался неврологом.
Статистическая обработка результатов исследования проведена с помощью системы статистического анализа данных Statistica 6.0. При анализе количественных показателей в двух группах использовали критерий Манна–Уитни, для множественных количественных сравнений – критерий Краскела–Уоллеса. Для сравнения качественных характеристик использовали Хи-квадрат. Для оценки корреляционных взаимосвязей качественных и количественных характеристик использовали критерий Спирмена. Для описания выборок применяли среднее и его стандартное отклонение. Качественные характеристики описывались в %. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
В табл. 1 представлена сравнительная характеристика демографических и общеклинических показателей трех сформированных групп. Статистически значимых различий по возрасту (р=0,2) и индексу массы тела (р=0,11) выявлено не было.
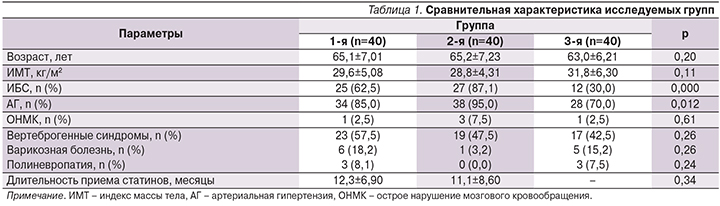
Между группами 1 и 2 не было различий по частоте ИБС (р=0,08) и АГ (р=0,61). В группе 3 распространенность сердечно-сосудистой патологии была достоверно ниже по сравнению с группами 1 и 2 (р<0,05 для частоты выявления ИБС и АГ), что представляется закономерным.
Все группы были сопоставимыми по частоте ОНМК в анамнезе, по распространенности вертеброгенных синдромов, варикозной болезни и полиневропатии. Соответственно, сопутствующие неврологические заболевания и/или венозная недостаточность не могли обусловить возможные межгрупповые различия по показателям мышечной боли и слабости.
Структура причин гипотиреоза групп 1 и 3 не различалась. Так, гипотиреоз в результате хронического аутоиммунного тиреоидита составил 92,5 и 87,5% (р=0,36), послеоперационный гипотиреоз – 5,0 и 12,5% (р=0,22), кордарониндуцированный гипотиреоз – 2,5 и 0% случаев соответственно. Все пациентки с гипотиреозом в группах 1 и 3 были медикаментозно компенсированными (тиреотропный гормон – ТТГ 3,5±2,8 и 2,61±1,59 мкЕД/л; р=0,15 и свТ4 14,5±2,74 и 14,7±2,75 пмоль/л соответственно; р=0,92). Кроме того, группы 1 и 3 не различались в плане доз заместительной терапии левотироксином (64,4±27,23 и 77,2±33,73 мкг соответственно; р=0,12).
Краткий опросник боли BРI (табл. 2) показал, что мышечные боли достоверно чаще беспокоили пациенток группы 1 по сравнению с группами 2 и 3 (64,9%, 25,6 и 32,5% соответственно; р=0,0006). При этом среди пациенток, имевших данную жалобу и относившихся к разным группам наблюдения, межгрупповых различий по интенсивности боли, характеризуемой PSI, не было. В то же время негативное влияние боли на способность ходить было достоверно выше у пациенток группы 1 (р=0,033).
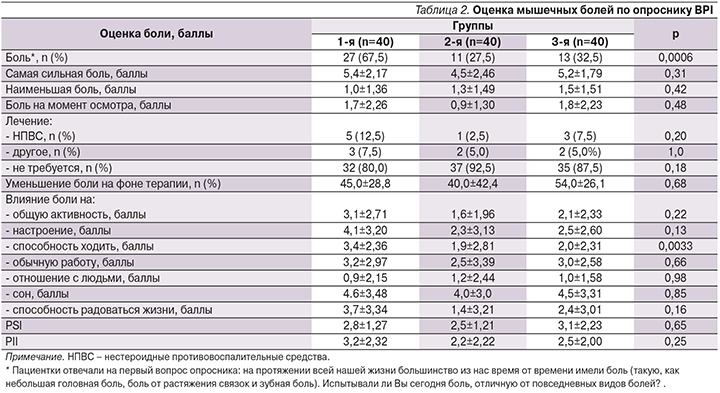
При анализе данных диаграммы BPI по локализации боли было установлено, что в группе 1 боль чаще локализовывалась по передней поверхности голени в отличие от групп 2 и 3 (51,9%, 9,1 и 46,2% соответственно; р=0,03), что считается характерным для СИМ [27].
Согласно результатам анализа краткого опросника слабости BFI, прослеживается близкая к статистически значимой тенденция к более частой встречаемости жалоб на слабость в конечностях в группе 1, т.е. среди пациенток, имевших гипотиреоз и принимавших статины, по сравнению с группами 2 и 3 (67,6%, 51,3, 55,0% соответственно; р=0,056). Однако интенсивность слабости (FSI) и влияние ее на различные аспекты жизни (FII) оставались сопоставимыми во всех трех группах (4,3±2,28, 4,3±2,27, 4,4±1,59; р=0,95 и 3,1±2,62, 3,7±3,00, 3,5±1,31; р=0,21 соответственно).
При анализе лабораторных данных (табл. 3) показатели липидограммы указывали на достоверно более высокий атерогенный потенциал крови в группе 3, что безусловно отражает корригирующее влияние терапии статинами на обмен липидов. При этом группы 1 и 2 не имели достоверных различий по длительности статинотерапии и по структуре принимаемых статинов: аторвастатин принимали 62,5 и 74,4% пациенток (р=0,33), симвастатин – 7,5 и 5,1% (р=1,0); розувастатин – 30,0 и 20,5% (р=0,44) соответственно. Группы не различались по уровню трансаминаз (аланинаминотрансферазы – АЛТ и аспартатаминотрансферазы – АСТ) и по таким маркерам мышечного поражения, как ЛДГ и миоглобин крови (хотя средние значения всех перечисленных показателей были несколько выше в группе 1).
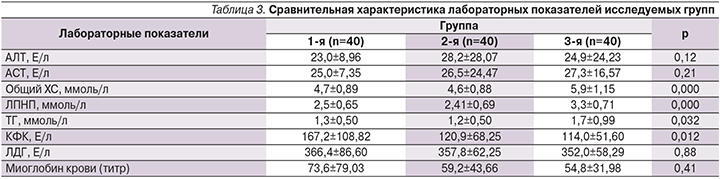
В то же время уровень КФК был статистически значимо выше у пациенток, имевших компенсированный гипотиреоз и получавших статины, т.е. при наличии обоих факторов риска мышечных нарушений (табл. 3).
Итак, в группе 1 чаще выявлялись мышечные боли с характерной для СИМ локализацией, а также мышечная слабость. При этом выраженность данных проявлений, а также распространенность сопутствующих заболеваний с похожей симптоматикой (неврологическая патология, хроническая венозная недостаточность) не демонстрировали межгрупповых различий.
Для уточнения клинических и патогенетических особенностей мышечных симптомов, возникавших у пациенток разных групп наблюдения, было важно оценить степень ассоциации этих жалоб с биохимическими маркерами повреждения миоцитов, используя в т.ч. и анализ корреляционных взаимосвязей (табл. 4).
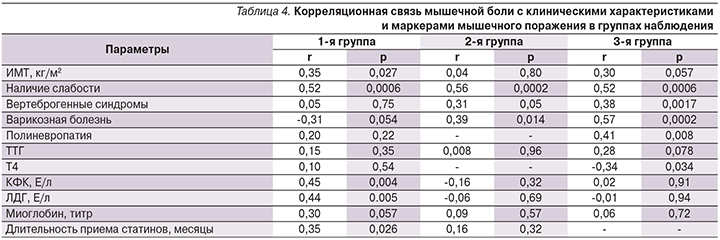
Во всех группах наблюдалась сильная корреляция между наличием боли и наличием слабости.
В группе 1 очевидна четкая ассоциация мышечной боли с биохимическими маркерами мышечного поражения. Лишь в этой группе была отмечена сильная прямая корреляция наличия мышечных болей с повышением уровней КФК и ЛДГ, а также слабая, но близкая к статистически значимой корреляция с уровнем титра миоглобина. В группе 1 в отличие от группы 2 наблюдалась достоверная прямая корреляционная связь с длительностью приема статинов. При этом средняя продолжительность приема статинов пациентками, имевшими боль, составила 13,9 месяца, что характерно для статин-ассоциированного мышечного поражения [21, 28]. Это позволяет предположить, во-первых, связь изучаемых жалоб с действительным повреждением миоцитов и, во-вторых, не исключает особую патогенетическую роль СИМ в развитии мышечных симптомов у лиц с гипотиреозом, получающих статины.
Судя по литературным данным, возможность акселерации мышечных симптомов у таких больных базируется на нескольких теоретических предпосылках:
- наличие общих звеньев патогенеза, а именно митохондриальной дисфункции с развитием энергетического дефицита и окислительного стресса, что может оказывать негативное влияние на миоциты [29];
- замедление на фоне гипотиреоза метаболизма в организме, а следовательно, и катаболизма принимаемых лекарственных средств, в т.ч. статинов, с их кумуляцией и усилением побочных эффектов [30];
- ингибирующее влияние статинов на синтез селенопротеинов, которые участвуют в метаболизме тиреоидных гормонов, что ведет к снижению их эндогенной продукции и усугублению гипотиреоза [31].
Обращает на себя внимание и тот факт, что в группах 1 и 3 имеется корреляционная взаимосвязь большего ИМТ с наличием мышечных болей, чего не наблюдается в группе 2.
Важно отметить факты, которые подтверждают различный генез мышечных болей всех трех групп:
- во-первых, мышечные симптомы имеют прямую корреляцию с ТТГ и обратную с Т4 лишь в группе 3, что подразумевает наличие гипотиреоидной миопатии у пациенток данной группы;
- во-вторых, наличие мышечной боли имеет четкую сильную корреляционную связь с выявлением вертеброгенных синдромов, варикозной болезни и полиневропатии в группе 3 и в меньшей степени – в группе 2, чего не наблюдается в группе 1.
Вероятно, в генезе болевого синдрома у больных групп 2 и 3 значительную роль играла сопутствующая патология (неврологические заболевания и болезни вен нижних конечностей), а в случае гипотиреоза (группа 3) – еще и степень компенсации последнего. При этом не было признаков значимого повреждения миоцитов, которое подтверждалось бы соответствующими изменениями биохимических маркеров.
Хочется подчеркнуть следующее:
- мышечные боли у больных группы 1 наблюдались чаще;
- по клинико-биохимическим проявлениям они имели иной характер, чем у пациенток других групп;
- исходя из особенностей локализации симптомов, лабораторных данных и длительности приема статинов, боли в большей степени сопряжены с СИМ у пациенток группы 1.
По-видимому, повышение риска СИМ у больных компенсированным гипотиреозом не исключено, хотя и не является драматическим при использовании малых и средних доз.
Полученные данные представляют практический интерес, поскольку в большинстве источников [8, 9] лишь недиагностированный и некомпенсированный гипотиреоз рассматривается как возможный фактор риска СИМ. В связи с тем что одной из причин вторичной дислипидемии является гипотиреоз, целесообразно проводить скрининг на гипотиреоз у пациентов с нарушением липидного обмена, а также компенсировать гипотиреоз при его наличии перед назначением статинов.
В отношении компенсированного гипотиреоза проблема безопасности статинотерапии представляется не до конца решенной и в рекомендациях по ведению пациентов с дислипидемией практически не упоминается.
В ходе нашего исследования показана справедливость предостережения некоторых инструкций по применению статинов в отношении возникновения неблагоприятных побочных эффектов со стороны мышечной ткани при наличии гипотиреоза.
Ограничениями настоящего исследования являются его одномоментный (поперечный) характер и использование пациентами различных препаратов группы статинов (при наибольшей частоте назначения аторвастатина).
Выводы
У больных компенсированным гипотиреозом на фоне терапии статинами возрастает частота мышечных болей с характерной для СИМ локализацией. Боль патогенетически связана с повреждением миоцитов, подтвержденным изменениями биохимических маркеров (особенно КФК). Наличие мышечной симптоматики прямо коррелирует с длительностью приема статинов, указывая на особую патогенетическую роль СИМ в ее развитии. Использование статинов при компенсированном гипотиреозе требует более тщательного мониторинга клинико-биохимических признаков миопатий.
В генезе болевого синдрома у лиц без тиреоидной дисфункции, получающих терапию статинами, большую роль играет сопутствующая патология (вертеброгенные синдромы и заболевания вен нижних конечностей).
У больных гипотиреозом, не получавших статины, мышечные симптомы ассоциировались как с сопутствующей патологией, так и со степенью компенсации тиреоидной недостаточности. При этом не было признаков значимого повреждения миоцитов, которое подтверждалось бы соответствующими биохимическими изменениями.



