Введение
Депрескрайбинг (de‐prescribing) – это процесс уменьшения, прекращения или отмены лекарств с целью управления полипрагмазией и улучшения результатов лечения [1]. Он направлен на уменьшение использования определенных лекарств конкретным пациентом в силу того, что они могут причинять вреда больше, чем пользы.
Таким образом, целью депрескрайбинга служит уменьшение бремени лекарств, включая непосредственный вред здоровью, сохраняя или улучшая качество жизни.
Термин «деспескрайбинг» впервые появился в Australian hospital pharmacy journal в 2003 г. в статье под названием «Депрескрайбинг: достижение лучших результатов в отношении здоровья пожилых людей за счет сокращения приема лекарств», в которой были изложены принципы отмены назначения, определены препараты, которые могут быть отменены, заменены или сокращены, план проведения отмены [2].
Депрескрайбинг имеет особенно большое значение для категории пациентов пожилого и старческого возраста, имеющих коморбидные состояния и сочетание нескольких заболеваний, что зачастую приводит к необходимости полипрагмазии [3]. В клинической практике врачи разных специальностей делают назначение лекарственных средств (ЛС) пожилым пациентам по своему профилю заболеваний и при этом относительно мало уделяют внимания согласованию или сокращению препаратов во избежание полипрагмазии. В то же время риски полипрагмазии включают увеличение частоты лекарственных взаимодействий и побочных эффектов, которые могут приводить к усилению тяжести заболеваний, госпитализации и даже смерти [4]. В систематическом обзоре A.T. Page et al. определено несколько типов неоптимального применения ЛС у пожилых пациентов, которые приводят к развитию лекарственнообусловленных состояний: 1) полипрагмазия как одновременное применение более 5 ЛС; 2) гиперполипрагмазия как одновременное применение более 10 ЛС; 3) недостаточное назначение как необоснованное отсутствие ЛС, которое клинически показано для текущего состояния; 4) ненужные ЛС как неэффективные лекарства, отсутствие показаний, терапевтическое дублирование и субтерапевтические дозы; 5) каскад назначений как использование одного лекарства для лечения побочного действия другого лекарства, которое ошибочно идентифицируется как новое состояние и для его лечения назначается новое лекарство; 6) назначение ЛС с высокой степенью риска, для которых потенциальный вред или побочные эффекты могут превысить потенциальные выгоды (например, ЛС, оказывающие вторичный седативный или антихолинергические эффекты) [3].
Существует корреляция между полипрагмазией и неблагоприятными или ятрогенными эффектами для здоровья, особенно в популяции пожилых людей. Клинически значимые неблагоприятные последствия для здоровья пожилых пациентов, связанные с полипрагмазией, включают падение, истощение, хрупкость (слабость), когнитивные нарушения, инвалидизацию, смертность [5]. Эти негативные последствия возникают при использовании от 3,5 до 6,5 препаратов, и риск вреда увеличивается с каждым дополнительным назначением лекарства.
Депрескрайбинг является одним из способов противодействия полипрагмазии и неправильного использования ЛС. Сокращение общего количества лекарств и прекращение применения препаратов, которые больше не требуются, снижают риск потенциального вреда, связанного с полипрагмазией.
Есть несколько предпосылок, обосновывающих процесс депрескрайбинга у пациентов пожилого возраста. Во-первых, клинические исследования ЛС проводятся преимущественно в одной популяции и экстраполируются для использования в разных популяциях. При этом в клинические исследования часто не включаются пациенты пожилого и старческого возраста, устанавливается максимальный возрастной предел для участников и исключаются сопутствующие заболевания или сопутствующее лечение, что создает неопределенность в отношении преимуществ и вреда для пожилых людей [6]. Во-вторых, в популяции пожилых людей присутствуют хрупкие люди, представляющие особо уязви-мую группу со сниженным резервом и повышенной подверженностью стрессам. Этот фенотип характеризуется непреднамеренной потерей массы тела, истощением и накоплением дефицита [7, 8]. В-третьих, при старении происходят физиологические изменения в общем составе тела, органах и клеточных мишенях, где действуют лекарства, что изменяет реакцию пожилых людей на ЛС и делает невозможной экстраполяцию результатов клинических исследований у более молодой возрастной группы [9]. В-четвертых, повышен риск побочных эффектов у пожилых пациентов; их возникновение может недооцениваться или приниматься за симптомы заболевания, требующие лечения, при этом препарат может улучшать одно состояние, но потенциально отрицательно влиять на другое заболевание.
Депрескрайбинг направлен на прекращение/отмену/остановку применения препарата, при этом используется термин «процесс», что предполагает этапность выполнения, включая уменьшение дозы и мониторирование исходов. Таким образом, «депрескрайбинг – это процесс отмены неподходящего ЛС, контролируемый медицинским работником с целью управления полипрагмазией и улучшения результатов лечения» [10].
К настоящему времени накоплены большой клинический материал, посвященный изучению влияния депрескрайбинга на исходы лечения, и руководящие принципы по этому подходу.
Доказательная база по депрескрайбингу
Один из первых систематических обзоров клинических исследований (за период с 1966 по 2007 г.), посвященных отмене или прекращению применения отдельных классов ЛС в популяции пациентов с возрастом старше 65 лет, был представлен S. Iyer et al. [11].
В этот обзор было включено 31 исследование (n=8972 пациентам) только по отмене разных фармакологических классов ЛС и последующим периодом наблюдения, в т.ч. 4 рандомизированных и плацебо-контролируемых исследования (n=448) по отмене диуретиков, 9 проспективных наблюдательных исследований (n=7188) по отмене антигипертензивных препаратов (включая диуретики), 16 исследований (n=1184) по отмене психотропных препаратов (седативных, антипсихотических препаратов, антидепрессантов и ингибиторов холинэстеразы) и 2 исследования по отмене нитратов и дигоксина. Так, отмена диуретиков проводилась у 51–100% пациентов за 6–52 недели. Клинически значимые неблагоприятные последствия отмены встречались редко, уменьшалась частота гипокалиемии, азотемии и гиперлипидемии, но отмена была безуспешной почти в 25% у пациентов при наличии хронической сердечной недостаточности. После отмены антигипертензивной терапии у 20–85% пациентов за период 4–260 недель у многих пациентов сохранялось нормотензивное состояние или они не нуждались в возобновлении терапии в течение от 6 месяцев до 5 лет, при этом не было отмечено увеличения частоты сердечно-сосудистых исходов. Отмена психотропных препаратов сопровождалась достоверным снижением частоты падений (ОР=0,34). Отмена бензодиазепинов приводила к увеличению дневной активности и улучшению когнитивных способностей у пожилых, при этом не наблюдалось ухудшения качества сна или развития синдрома отмены (отмена проводилась в течение года). Постепенная отмена антидепрессантов, преимущественно селективных ингибиторов обратного захвата серотонина (СИОЗС), также была успешной в 53% и не сопровождалась синдромом отмены. При отмене гликозидов восстанавливался уровень калия, уменьшались симптомы интоксикации, но 56% пациентов, преимущественно с фибрилляцией предсердий, потребовалось возобновление терапии в течение 4–11 месяцев.
В наиболее крупный мета-анализ A.T. Page et al. (2015) было включено 116 клинических исследований с применением депрескрайбинга у 34 143 пациентов в среднем возрасте 73,8±5,4 года, в т.ч. 38 исследований с участием 4833 пациентов старше 80 лет [12]. В большинстве исследований проводилась отмена одного ЛС, в небольшой части – двух или более ЛС; фармакологические классы препаратов, которые подвергали депрескрайбингу, включали очень широкий спектр: антигипертензивные (диуретики, β-адреноблокаторы и др.), психотропные (антипсихотики, бензодиазепины, СИОЗС и др.), ингибиторы протонной помпы (ИПП), дигоксин, бисфосфонаты, препараты для лечения хронической обструктивной болезни легких, доброкачественной гиперплазии предстательной железы и пр. В нерандомизированных исследованиях показано, что депрескрайбинг при полипрагмазии значительно снижает смертность (ОР=0,32; доверительный интервал [ДИ] – 0,17–0,60), но в рандомизированных исследованиях снижение риска смертности не достигло статистической достоверности (ОР=0,82; ДИ – 0,61–1,11), а в подгруппе пациентов до 80 лет риск смертности составил ОР=0,64 (р=0,07).
Таким образом, анализы показали отсутствие значительного вреда при отмене таких препаратов, как антигипертензивные, бензодиазепины и другие психотропные средства, для 20–100% пожилых людей.
Депрескрайбинг бензидиазепинов и других психотропных препаратов
Бензодиазепины широко применяются для лечения бессонницы в разных возрастных группах, а также тревожных состояний у пожилых лиц. Однако в клинических рекомендациях предлагается короткий курс их применения [13]. Вместе с тем длительное применение препаратов сопровождается развитием физической и психологической зависимости. Кроме того, длительное использование бензидиазепинов связано с повышенным риском падений, дорожно-транспортных происшествий, когнитивных расстройств, седацией в дневное время, которые значительно увеличены у пожилых людей. Таким образом, долгосрочное и ненадлежащее применение бензидиазепинов остается проблемой.
В ряде мета-анализов исследований по изучению разных методов отмены бензодиазепинов, включая популяцию пожилых пациентов, было показано, что постепенное снижение доз в дополнение с психологической поддержкой имеют наилучшие результаты по эффективности [14–16].
Наиболее крупный систематический анализ включил 139 исследований по депрескрайбингу бензодиазепинов и Z-гипнотиков для снижения неблагоприятных последствий, таких как падения, когнитивные нарушения и седативный эффект у пожилых пациентов в общей практике [17]. Изучали преимущества для разных методов отмены терапии бензодиазепином или Z-гипнотиками, включая фармакологические, психологические и смешанные методы. В 80% исследований наиболее частым режимом была постепенная отмена препаратов (снижение дозы на 25% в неделю или медленнее) с фармакологической поддержкой; психологические методы изучались только в 14% исследований и смешанные методы – в 16%.
Антипсихотические препараты (нейролептики, фенотиазины, бутирофеноны) часто используются для лечения психоневрологических симптомов у пожилых пациентов, хотя их эффективность ограничена, и существует потенциальный риск неблагоприятных последствий (цереброваскулярные побочные эффекты, экстрапирамидные симптомы, нарушения походки и падения, сонливость, отеки), в т.ч. риск более высокой смертности при длительном применении. Возможной стратегией по снижению использования антипсихотиков может быть депрескрайбинг, направленный на отмену антипсихотических препаратов у пожилых людей с деменцией.
Оценка эффективности депрескрайбинга антипсихотиков для разных групп пожилых пациентов с деменцией проводилась в Кокрейновском мета-анализе [18]. Было проанализировано 6 рандомизированных плацебо-контролируемых исследований с участием 606 пациентов. Первичными результатами эффективности были успех отмены и контроль психоневрологических симптомов. Депрескрайбинг предусматривал проведение резкой отмены или постепенного режима отмены антипсихотиков с последующим наблюдением от 1 до 12 месяцев.
В 8 исследованиях не было получено значимой разницы по первичным исходам между группами вмешательства и контроля (продолжение лечения), что показывает возможность проведения отмены терапии без значимых последствий или ухудшения состояния пациентов, особенно с более легкой симптоматикой. Хотя в двух исследования у пациентов с психозом и возбуждением, получавших терапию рисперидоном или галоперидолом, наблюдался повышенный риск рецидива или укорочение времени до рецидива после отмены терапии. Вместе с тем сделан вывод, согласно которому многим пожилым с деменцией и психоневрологическими симптомами могут быть отменены антипсихотические препараты без вреда или с незначительным влиянием на поведенческие и психологические симптомы, что возможно для проведения в повседневной клинической практике. В 2018 г. было проведено обновление Кокрейновского мета-анализа по депрескрайбингу антипсихотических препаратов в 10 клинических исследованиях с участием 632 пациентов, которое подтвердило полученные ранее данные [18].
Проведен систематический анализ данных пяти мета-анализов (включая три Кокрейновских) и два клинических исследований по оценке влияния отмены психотропных препаратов на риск падений и когнитивных нарушений у пожилых пациентов [19]. Так, постепенная ступенчатая отмена психотропных препаратов снижает риск падения на 39–66%, а также сопровождается улучшением когнитивной функции.
Депрескрайбинг ингибиторов протонной помпы
Ингибиторы протонной помпы (ИПП) представляют собой класс препаратов для лечения многих кислотозависимых заболеваний желудочно-кишечного тракта. Они показаны при диспепсии, гастроэзофагеальной рефлюксной болезни (ГЭРБ), рефлюкс-эзофагите, язвенной болезни, стресс-язве и синдроме Золлингера–Эллисона, а также в составе эрадикационной антихеликобактерной терапии. Для большинства этих состояний обычно рекомендуется кратковременное использование ИПП (от 2 до 12 недель), однако зачастую их продолжают применять в течение длительных периодов или даже неопределенно долго. Таким образом, около 25–70% людей используют ИПП ненадлежащим образом. Однако длительный прием ИПП способствует полипрагмазии и повышает риск лекарственных взаимодействий и побочных эффектов (диарея, пневмония, дефицит витамина B12, гипомагниемия и переломы, особенно у пожилых). В связи с этим ИПП могут быть включены в процесс депрескрайбинга с помощью нескольких методик: одномоментная или постепенная отмена, уменьшение доз препаратов, переход на прием «по потребности» или замена на Н2-блокаторы [20].
Возможности проведения депрескрайбинга ИПП были проанализированы в нескольких современных систематических обзорах и мета-анализах. В Кокрейновский мета-анализ было включено 6 клинических исследований с участием 1758 пациентов среднего возраста (от 48 до 57 лет) с эзофагитом или неэрозивной рефлюксной болезнью, только одно исследование было с участием пожилых (средний возраст – 73 года) [21]. Депрескрайбинг проводился путем постепенного уменьшения числа таблеток (дозы) ИПП, переход на прием «по потребности» и прекращение применения, длительность наблюдения составила до 6 месяцев. Депрескрайбинг ИПП приводил к ухудшению контроля симптомов (ОР=1,71; ДИ – 1,31–2,21) и рецидиву воспаления по данным эндоскопии (ОР=3,42) на фоне среднего снижения числа таблеток ИПП на 3,79 в неделю. Удовлетворенность лечением пациентами была также не в пользу депрескрайбинга (ОР=1,82; ДИ – 1,26–2,65). Детальный анализ пяти исследований с применением метода депрексрайбинга путем перехода с постоянной терапии ИПП на прием «по потребности» показал бóльшую частоту случаев неудач эффективности, чем в контроле (16,3 против 9,2%; р<0,0001). Таким образом, результаты этого мета-анализа не показали положительного воздействия депрескрайбинга ИПП.
Несмотря на столь негативные общие результаты депрескрайбинга ИПП, в последующих систематических обзорах проводилась попытка анализа разных методик в процессе депрескрайбинга.
Так, в систематическом обзоре P. Haastrup et al. проанализировано шесть клинических исследований по депрескрайбингу ИПП у пациентов с ГЭРБ и неязвенной диспепсией [22]. В целом депрескрайбинг был эффективен для 14–64% пациентов без возврата симптомов и ухудшения качества жизни в течение 1 года или более. Большим числом пациентов (30–50%) эффективность была достигнута за счет уменьшения дозы ИПП, у меньшего числа – за счет полной отмены препаратов.
В систематическом обзоре T.D. Wilsdon et al. проводилась оценка результатов депрескрайбинга ИПП у пожилых пациентов (возраст от 65 до 87 лет) в 21 исследовании; из-за разнородности дизайнов исследований выполнить мета-анализ было невозможно [23]. Результаты 6 исследований показали эффективность депрескрайбинга, 11 исследований не показали значимых изменений, а 4 имели отрицательные результаты.
Таким образом, проведенные систематические обзоры и анализы исследований по депрескрайбингу ИПП показали неоднозначные результаты – часть была с позитивными, а часть с негативными результатами. Вместе с тем в исследованиях использовались разные методологии проведения депрескрайбинга и достижение положительных результатов, возможно, имеет отношение к конкретным методам (например, не полная отмена, а снижение доз препаратов ИПП).
Депрескрайбинг антигипертензивных препаратов
Не всегда отмена определенных фармакологических классов ЛС может улучшать клиническое состояние и исходы для пожилых пациентов. Интерес представляют результаты о возможности депрескрайбинга антигипертензивных препаратов у пожилых пациентов с полипрагмазией. В соответствии с международными клиническими рекомендациями, применение антигипертензивных препаратов пациентами с артериальной гипертензией (АГ) обычно продолжается в течение длительного периода времени, если только нет неблагоприятных эффектов, которые перевешивают потенциальную пользу. Между тем эти рекомендации не охватывают лечения АГ в группе хрупких пожилых пациентов и людей с деменцией, которые часто исключаются из клинических исследований, но остаются частыми потребителями антигипертензивных средств. Зачастую антигипертензивное лечение у пациентов этой категории может приводить к ортостатической гипотензии, падению и увеличению антихолинергических эффектов. Кроме того, в нескольких когортных наблюдательных исследованиях в популяции пациентов старше 70 лет была показана тенденция к снижению уровня систолического артериального давления (САД)<120 мм рт.ст. независимо от наличия и объема антигипертензивной терапии, особенно в возрастной группе старше 75–80 лет, что может повышать риск смертности [24, 25]. Снижение САД у пожилых пациентов оказалось линейным с 10 до 3 лет до смерти, с более резким снижением за последние 2 года жизни [26].
Было отмечено, что у некоторых пожилых пациентов уровень АД остается устойчиво нормальным после прекращения приема антигипертензивной терапии и хорошо переносится, что служит поводом для возможного депрескрайбинга. Такая попытка отмены антигипертензивного препарата может быть особенно желательна для пациентов с полипрагмазией и желающих уменьшить лекарственную нагрузку.
В рандомизированном двойном слепом клиническом исследовании DANTE study (Discontinuation of Antihypertensive Treatment in Elderly people) с участием 385 пациентов старше 75 лет показано небольшое, но значимое повышение САД (на 7,36 мм рт.ст.; р=0,001) и диастолического АД на 2,63 мм рт.ст. (р=0,03) после прекращения приема антигипертензивного препарата, при этом не было отмечено значимых изменений когнитивных функций, симптомов апатии и депрессии по сравнению с контролем [27]. Депрескрайбинг помог в снижении только одного из возможных побочных эффектов – ортостатической гипотензии у пожилых пациентов. Это исследование показало, что не все возможные побочные эффекты, связанные с приемом антигипертензивных препаратов можно устранить.
В другом крупном 4-месячном многоцентровом рандомизированном кластерном исследовании COSMOS study (COmmunication, Systematic pain assessment and treatment, Medication review, Organization of activities, and Safety) с участием 295 пожилых пациентов старше 65 лет с деменцией из домов престарелых, получавших фармакотерапию со средним числом 9,2 препарата и 1,6 антигипертензивного препарата, проводилась пациент-ориентированная оптимизация антигипертензивной терапии с последующим 9-месячным наблюдением [28]. У пациентов оценивали уровень АД, пульса, анализы крови, психоневрологические симптомы, когнитивный статус по шкале MMSE, боль, повседневную жизнедеятельность, самочувствие и качество жизни. Проводили снижение дозы или отмену препаратов в течение 4 месяцев, если уровень АД был ниже рекомендуемого предела. Количество антигипертензивных препаратов было снижено у 43 (32%) пациентов группы вмешательства, чаще отменялись диуретики и β-адреноблокаторы. После отмены препаратов в группе вмешательства имело место небольшое увеличение уровня САД на 14,95% через 4 месяца (с 128±19,5 до 143±25,5 мм рт.ст.) и последующим снижением на 6,95% к 9-му месяцу (до 134 мм рт.ст.); аналогична тенденция по уровню диастолического АД. При этом частота госпитализаций была достоверно меньшая за весь период наблюдения (р<0,05) и смертность, сопоставимая с группой контроля; не было выявлено значимого влияния на частоту пульса и когнитивную функцию.
В специальном мета-анализе, посвященном депрескрайбингу антигипертензивных препаратов, оценивали долю пациентов, оставшихся нормотензивными в течение 6 месяцев или дольше после прекращения антигипертензивной терапии (28 исследований) и безопасность (49 исследований) [29]. Проводили отмену препаратов разных классов основных и дополнительных антигипертензивных средств. Средняя доля нормотензивных пациентов составила 38% через 6 месяцев после отмены, 40% через 1 год и 26% через 2 года. То есть у каждого четвертого пациента антигипертензивная терапия может быть прекращена. Проводился анализ факторов, способствовавших успешной отмене антигипертензивных препаратов, среди них были монотерапия, низкий уровень АД и более низкая масса тела. Именно эти факторы могут быть использованы как предикторы при проведении депрескрайбинга антигипертензивных препаратов. Вместе с тем после отмены антигипертензивных препаратов преимущественно центрального механизма действия чаще встречались побочные эффекты (в основном легкие), такие как головная боль, боль в суставах, сердцебиение, отеки, недомогание. Следует рассмотреть возможность для пациентов с хорошо контролируемой АГ отмену антигипертензивного лечения с последующим регулярным мониторингом АД.
Депрескрайбинг статинов
Статины эффективны для вторичной профилактики сердечно-сосудистых исходов и смертности при высоком кардиоваскулярном риске, включая пожилых пациентов, что включено в соответствующие клинические рекомендации. NNT (numbers needed to treat) для лечения с целью вторичной профилактики находятся в диапазоне 32–56 [30, 31]. Однако эффективность статинов для первичной профилактики у пациентов без сердечно-сосудистых заболеваний остается дискутабельной. В отношении пациентов старших возрастных групп применение статинов для первичной профилактики достоверно снижает риск инфарктов и инсультов, но не влияет на смертность [32]. Кроме того, эффективность статинов и соотношение польза/риск у пациентов старше 75–80 лет менее очевидна [(32, 33]. Применение высоких доз или высокоэффективных статинов пожилыми людьми может не повышать эффективность, но увеличивать риск побочных эффектов, таких как мышечные боли (миалгия, миопатия) и слабость. В дополнение к уже известным побочным эффектам статинов в 2012 г. FDA (Food and Drug Administration) опубликовало заключение о редких постмаркетинговых данных о развитии когнитивных нарушений, связанных с приемом статинов, обратимых при прекращении приема статинов [34]. Еще одним неблагоприятным эффектом статинов является повышение риска развития новых случаев сахарного диабета, причем предиктором развития служат высокая активность и дозы препаратов, а также пожилой возраст пациентов [35, 36]. Эти данные способствуют снижению приверженности применения статинов и прекращению лечения.
Еще одним важным аргументом в пользу депрескрайбинга является факт длительного поддержания профилактического эффекта статинов после отмены. Так, в популяции пациентов исследования ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial), получавших в течение 3,3 года приема статинов, в течение последующих 8 лет после отмены было показано достоверное снижение общей смертности (ОР=0,86; р=0,02) и недостоверное снижение сердечно-сосудистой смертности (ОР=0,89) [37].
Таким образом, применение статинов пожилыми людьми требует частого пересмотра и рассмотрения их терапевтических целей с учетом факторов ожидаемой продолжительности жизни, качества жизни, соотношения риск–польза [38]. Если риски перевешивают потенциальную пользу, возможно применение депрескрайбинга.
К настоящему времени доказательная база по депрескрайбингу статинов представлена исследованиями пациентов с ограниченным сроком жизни (чаще в связи с раком) [39]. Так, в ряде клинических исследованиях с включением пожилых пациентов с ограни-ченной продолжительностью жизни (от 1 месяца до 1 года) проводилась отмена терапии статинами [40–42]. Результаты наблюдения в течение года не показали различия в смертности и сердечно-сосудистых исходах в группе отмены по сравнению с группой контроля (продолжение терапии статинами), но отмечалось достоверное улучшение качества жизни (р=0,04).
Депрескрайбинг в госпитальной практике
Полипрагмазия и использование потенциально неподходящих ЛС распространены среди пожилых людей в госпитальной практике, что также влечет развитие неблагоприятных исходов, включая побочные эффекты на лекарства, падения, спутанность сознания, повторные госпитализации и смерть. Депрескрайбинг в госпитальных условиях может уменьшить нежелательную полипрагмазию и улучшить исходы. К настоящему времени выполнено два мета-анализа по изучению исходов депрескрайбинга у госпитализированных пациентов пожилого возраста. В первый Кокрейновский мета-анализ 2016 г. включили 10 клинических исследований с участием 3575 пациентов старше 65 лет, в которых проводилась оптимизация и коррекция фармакотерапии во время госпитализации [43]. Среднее число ЛС в фармакотерапии пациентов варьировалось от 7 до 11; в 2 исследованиях коррекция фармакотерапии проводилась на основе технологии STOPP/START, в остальных – на основании консилиума специалистов. Период наблюдения для оценки исходов варьировался от 30 дней до 1 года. Первичным исходом служила смертность при госпитализации, вторичными исходами – частота повторной госпитализации, госпитализации в отделение неотложной терапии, в т.ч. по причине побочных эффектов лекарств. После оптимизации фармакотерапии во время госпитализации не было выявлено существенного снижения риска смерти (ОР=1,02; ДИ – 0,87–1,19), риска повторной госпитализации (ОР=0,95; ДИ – 0,87–1,04) или риска госпитализации в отделение неотложной терапии (ОР=0,73; ДИ – 0,52–1,03), что могло быть связано с короткими сроками госпитализации. В другом систематическом обзоре J. Thillainadesan et al. проводилось изучение эффективности депрескрайбинга потенциально неподходящих ЛС для госпитализированных пожилых пациентов и влияния на клинические результаты [44]. В анализ было включено 9 клинических исследований с участием 2522 пациентов старше 65 лет (средний возраст в исследованиях варьировался от 74,5 до 86,7 года). В качестве первичных исходов оценивали снижение неподходящих ЛС по индексу лекарственной нагрузки, критериям STOPP, Бирса и некоторым другим; вторичные исходы включили оценку смертности, падений, когнитивных функций, качества жизни и госпитализаций; период наблюдения после госпитализации составил до 1 года.
Результаты показали, что при поступлении число неподходящих ЛС варьировалось от 0,29 до 1,4 на пациента в основной группе и от 0,35 до 1,5 в контроле, а при выписке – 0,03–0,9 и 0,04–1,7 соответственно в группах. Уменьшение числа неподходящих ЛС в половине исследований было статистически значимым. Депрескрайбинг не приводил к значимому влиянию на смертность и частоту повторных госпитализаций, но достоверно уменьшал частоту падений и улучшал функциональное состояние и качество жизни. Таким образом, заметного вреда в результате проведения депрескрайбинга госпитализированным пациентам после выписки не наблюдалось.
Алгоритмы по проведению депрескрайбинга
Таким образом, консенсус специалистов определяют депрескрайбинг как «систематический процесс выявления и прекращения приема ЛС в случаях, когда потенциальный вред перевешивает существующую или потенциальную пользу в целях ухода за конкретным пациентом, текущего уровня функционирования, ожидаемой продолжительности жизни и предпочтений» [45]. Депрескрайбинг – это часть непрерывного назначения ЛС, которое охватывает начало терапии, титрование дозы, изменение или добавление других ЛС, а также замену или прекращение лекарственной терапии. Депрескрайбинг – это не отказ от назначения эффективного ЛС, а позитивное, ориентированное на пациента вмешательство, которое требует совместного принятия решений, информированного согласия пациента и тщательного мониторинга эффектов на основе принципов качественного назначения ЛС. Зачастую депрескрайбинг направлен на уменьшение частоты побочных эффектов, связанных с использованием ЛС, улучшение функционального состояния и предупреждение преждевременной смертности. Кроме того, проведение депрескрайбинга позволяет уменьшить лекарственную нагрузку на пациента и улучшить приверженность фармакотерапии.
Постоянный пересмотр фармакотерапии пожилых пациентов необходим для обеспечения оптимального использования ЛС. С течением времени ЛС могут переходить из категории показанных в соответствии с клиническим состоянием в категорию неподходящих или ненужных. Такие пересмотры лекарств должны проводиться с учетом индивидуальных обстоятельств и целей пожилого человека, чтобы гарантировать, что каждый используемый препарат остается в соответствии с целями ухода за человеком. Лекарства с неопределенным показанием или обоснованием для лечения пожилых пациентов могут быть рассмотрены для отмены назначения.
На основании имеющихся доказательных данных был предложены ряд алгоритмов для принятия решений по проведению депрескрайбинга. Важно, чтобы процесс депрескрайбинга сопровождался тщательным мониторингом пациентов в течение определенного периода времени в соответствии с клинико-фармакологическими характеристиками ЛС (период полувыведения, синдром отмены или последействие и т.п.).
Протокол депрескрайбинга, разработанный в Австралии, может состоять из пяти этапов [3, 45]:
- выявить все лекарства, которые пациент в настоящее время принимает, и свойства каждого из них;
- учитывать общий риск лекарственного вреда (число ЛС, потенциально опасные ЛС, токсичность ЛС) и категории риска пациентов (факторы риска: возраст>80 лет, когнитивные нарушения, множественные сопутствующие заболевания, злоупотребление психоактивными веществами, неприверженность лечению);
- оценить каждое ЛС с точки зрения его потенциальной или будущей пользы по сравнению с текущим или будущим вредом;
- определить приоритетность препаратов для отмены, которые имеют наименьшее соотношение пользы и вреда и наименьшую вероятность побочных эффектов или синдромов при отмене (например, ЛС, имеющие наибольший вред; ЛС, которые легче всего отменить без последствий; ЛС, которые пациент сам хочет отменить);
- разработать режим отмены и мониторинга за пациентами для улучшения результатов или появления побочных эффектов (рис. 1).
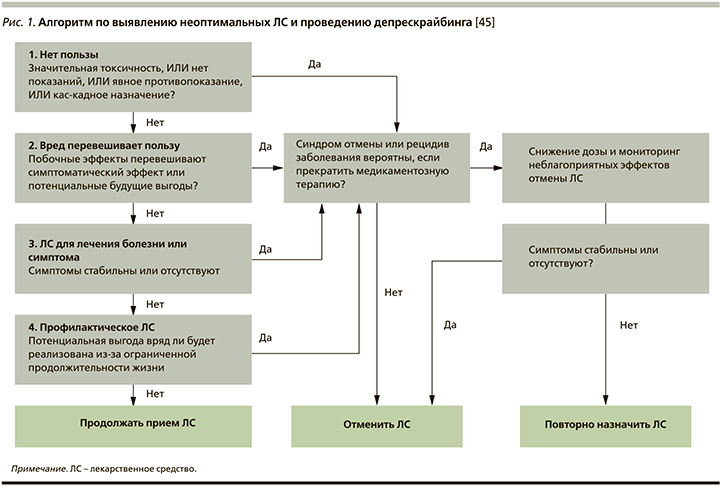
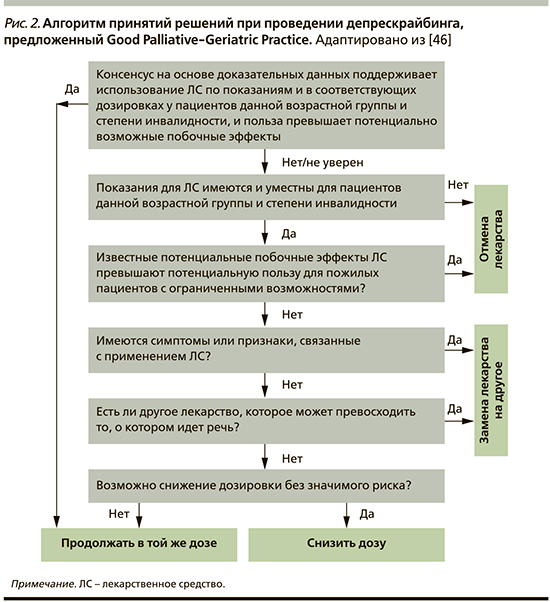
Данный алгоритм согласуется с таковым Good Palliative-Geriatric Practice (Израиль) для принятия решений по применению ЛС пожилыми пациентами (рис. 2) [46].
Также на основе имеющейся доказательной базы было подготовлено несколько руководств по депрескрайбингу назначения для отдельных фармакологических групп ЛС (бензодиазепинов, антипсихотиков, ИПП, статинов, антигипертензивных, антитробоцитарных средств, бисфофсфонатов) в Канаде и Австралии [47–49]. В марте 2018 г. исследовательская группа Bresyère Research Institute Deprescribing Guidelines, используя строгие международные стандарты, утвердила основополагающую методологию для разработки руководств по проведению депрескрай-бинга [50].
Заключение
Таким образом, накоплена доказательная база и разработана методология для ис-пользования депрескрайбинга в клинической практике у пожилых пациентов, в большинстве случаев депрескрайбинг проводился путем отмены необоснованных ЛС или уменьшения доз ЛС. Результаты исследований показывают, что полипрагмазия у пожилых пациентов может быть уменьшена путем отмены определенных лекарств с использованием такого подхода. Депрескрайбинг является дополнительным методом к существующим инструментам (критерии Бирса, STOPP/START и др.) для борьбы с полипрагмазией и уменьшением риска применения неподходящих ЛС, особенно в популяции пожилых пациентов [51].



