Системная склеродермия (ССД) (согласно МКБ-10, прогрессирующий системный склероз, М 34.0) – стадийно протекающее полиорганное заболевание с характерными вазоспастическими сосудистыми реакциями по типу синдрома Рейно (СР) и прогрессирующей генерализованной васкулопатией с ишемическими нарушениями, при котором развиваются специфические аутоиммунные расстройства, сопровождающиеся активацией фиброзообразования и избыточным отложением коллагена и других компонентов экстрацеллюлярного матрикса в тканях. Прогрессирующее течение ССД приводит к развитию фиброзных изменений кожи и внутренних органов, вызывающих нарушение их функции, определяющих высокую инвалидизацию и общий плохой прогноз болезни. Первичная заболеваемость составляет 2,7–12,0 случаев на 1 млн населения в год.
Патогенез болезни изучен недостаточно. Полагают, что к самым ранним проявлениям относятся нарушения микроциркуляции, которые возникают на фоне повторяющихся вазоспазмов периферических мелких артерий. Эти нарушения инициируют развитие системных аутоиммунных и воспалительных изменений, приводящих к активации фиброзирующих процессов и развитию облитерирующей васкулопатии. С учетом сложности патогенеза возможно только комплексное воздействие на его различные звенья. При этом воздействие на ранние этапы развития болезни представляется наиболее перспективным, т.к. формирующийся на более поздних этапах фиброз кожи и внутренних органов, по-видимому, является необратимым процессом.
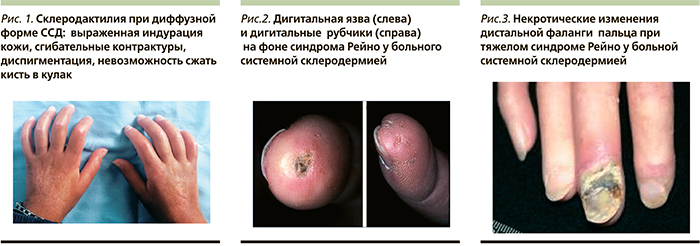
Клиническая картина ССД характеризуется стадийностью и в развернутой стадии достаточно характерна [1]. Поражение кожи – ведущий симптомокомплекс, отдельные проявления которого сменяют друг друга во времени. Ранний симптом – плотный отек кожи кистей (из-за отечности пальцев кисть плохо сжимается в кулак). По мере прогрессирования развиваются индурация кожи (увеличение плотности и толщины и уменьшение эластичности), гипер- и диспигментация, затем атрофия. В мягких тканях появляются кальцинаты (которые могут вскрываться с выделением творожистой массы и образованием длительно незаживающих язв) и телангиоэктазии («сосудистые звездочки» – сгруппированные в пучок расширенные капилляры и венулы). Количество телеангиоэктазий увеличивается со временем, локализуются они на лице, руках, зоне декольте и др. Вокруг рта формируются радиальные складки («кисет»), заостряется кончик носа, лицо становится амимичным. Типичен акроостеолиз – резорбция концевых отделов дистальных фаланг кистей вследствие длительной ишемии; проявляется уменьшением объема мягких тканей кончиков пальцев, укорочением и деформацией пальцев. Из-за фиброза кожи и околосуставных тканей формируются склеродактилия (рис. 1) и сгибательные контрактуры как мелких, так и крупных суставов. Существует корреляция распространенности кожных изменений с выраженностью висцеральных проявлений, скоростью прогрессирования заболевания и прогнозом.
Сосудистая патология занимает важное место в клинической картине болезни. Синдром Рейно – симметричный пароксизмальный спазм дигитальных артерий, артериол, вызванный холодом, эмоциональным стрессом; характеризуется последовательным изменением окраски кожи: побеление, цианоз, покраснение. Эпизоды вазоспазма сопровождаются онемением, болью, бывают асимметричными и ассоциируются с ишемическими повреждениями кожи – дигитальными рубчиками или язвочками, некрозом или гангреной (рис. 2, 3). Дигитальные рубчики – точечные участки западений и атрофии кожи в области дистальных фаланг. Дигитальные язвы – изъязвления на коже дистальных фаланг пальцев кистей и/или стоп. Язвенное поражение кожи может появляться на участках, подвергающихся механическому воздействию (над коленными, локтевыми суставами, в области лодыжек, пяток). Сухая гангрена – некроз кожи и подкожных мягких тканей, начинается с дистальных фаланг пальцев, может распространяться на средние фаланги с последующей самоампутацией.
При ССД часто поражаются суставы и мышцы. Характерны упорные полиартралгии, нередко развивается полиартрит с выраженным синовитом (в дебюте может протекать по типу ревматоидного артрита), а также теносиновиты. При хроническом течении преобладают склерозирующие теносиновиты и поражение других периартикулярных тканей, приводящих к суставным контрактурам. Типична невоспалительная фиброзная миопатия, проявляющаяся незначительной слабостью проксимальных групп мышц и небольшим повышением уровня креатинфосфокиназы (КФК). Может встречаться и воспалительная миопатия, которая проявляется миалгиями, проксимальной мышечной слабостью, значительным повышением уровня КФК, воспалительными изменениями на электромиографии и в биоптатах. При диффузной форме склеродермии развивается атрофия мышц вследствие нарушения подвижности и появления контрактур.
При ССД закономерно поражаются органы пищеварения, сердце, легкие и почки. Гипотония пищевода встречается среди 75–90 % больных и проявляется изжогой, дисфагией. Часто появляются эрозии и язвы пищевода, являющиеся следствием гипотонии нижнего сфинктера пищевода и гастроэзофагеального рефлюкса.
В результате длительного течения рефлюксной болезни может происходить метаплазия эпителия пищевода в эпителий, напоминающий слизистую оболочку желудка или тонкой кишки (пищевод Барретта). Это состояние считают предраковым и предрасполагающим к развитию аденокарциномы пищевода. Поражение тонкого и толстого кишечника сопровождается поносами и/или запорами. Иногда развивается синдром мальабсорбции, проявления которого усиливаются при избыточном росте патогенной флоры кишечника на фоне замедления пассажа пищевых масс. Несостоятельность сфинктеров прямой кишки проявляется недержанием кала.
У 80 % больных в первые годы болезни начинается интерстициальное поражение легких (ИПЛ), которое обычно имеет медленнопрогрессирующее течение, эволюционирует в фиброз легочной ткани разной степени тяжести. Самым адекватным неинвазивным методом выявления ИПЛ при ССД является компьютерная томография высокого разрешения, которая позволяет не только выявлять поражение паренхимы легких, но и оценивать выраженность и стадию фиброзирующего процесса. Информативными, особенно для динамического наблюдения, являются функциональные легочные тесты: спирометрия и метод однократного вдоха с задержкой дыхания для определения диффузионной способности легких. При ИПЛ функциональный профиль выявляет рестриктивный тип вентиляционных нарушений.
Легочная гипертензия – повышение давления в легочной артерии выше 25 мм рт. ст. в покое – развивается среди 5–10 % больных и либо обусловлена поражением артериального русла легких, либо является следствием тяжелого поражения паренхимы легких и/или левых отделов сердца. Несмотря на то что ЭХО-кардиография позволяет с высокой достоверностью предполагать наличие легочной гипертензии, «золотым» стандартом диагностики, позволяющим определять вид гипертензии, является катетеризация правых отделов сердца. Только с помощью этого инвазивного метода возможно подтвердить наличие легочной артериальной гипертензии (ЛАГ), требующей специфической терапии. При развитии висцеральной патологии у больных ССД прогноз жизни ухудшается, поэтому своевременное выявление органной патологии – это существенная часть курации больных ССД.
В настоящее время ИПЛ наряду с прогрессирующей ЛАГ определяет основные причины смерти ССД.
Поражение почек проявляется в виде острой или хронической нефропатии. Острая нефропатия (склеродермический почечный криз [СПК] – висцеральное проявление характерной для болезни васкулопатии), встречается редко (у 2–5 % больных), но сопровождается высокой летальностью (40–50 %). Основные проявления острой нефропатии – внезапное и стремительное развитие острой почечной недостаточности и артериальная гипертензия, быстро принимающая злокачественный характер. Для склеродермического поражения сердца наиболее характерно развитие фиброза с вовлечением обоих желудочков и характерным «пятнистым» (некоронарогенным) распределением очагов фиброза. Этот процесс во многих случаях протекает бессимптомно и выявляется инструментально (аритмии, признаки ишемии миокарда до очагово-рубцовых изменений на ЭКГ, снижение сократительной способности и зоны гипо- и акинезии, расширение полостей сердца на ЭХО-ГК).
Основные цели терапии ССД: снижение активности и подавление прогрессирования болезни, а также профилактика и лечение СР, сосудистых осложнений и висцеральных проявлений болезни [2]. В случае развития нарушений функций внутренних органов лечение проводится с привлечением специалистов других медицинских специальностей (кардиологов, нефрологов, пульмонологов, гастроэнтерологов, физиотерапевтов, психологов и др.) и основывается на тесном взаимодействии врача и пациента. Пациентам со склеродермией строго противопоказано курение. Необходимо длительное лечение – всегда многолетнее, а иногда и пожизненное.
В соответствии с версией Европейской лиги по борьбе с ревматизмом (EULAR) рекомендации по фармакологическому лечению ССД сгруппированы по системам органов или наиболее тяжелым клиническим синдромам [3]. Основное место в лечении ССД занимают сосудистые, противовоспалительные, иммуносупрессивные и антифиброзные препараты, а также локальная, реабилитационная и симптоматическая терапия. В таблице приведены основные фармакологические препараты, которые применяют при лечении отдельных проявлений ССД.
Клинические рекомендации, предложенные EULAR в 2009 г., посвящены фармакотерапии ССД и основаны на анализе литературы по 2006 г. включительно [3]. Согласно методике создания рекомендаций EULAR, в анализ включены в первую очередь данные, основанные на доказательствах, т.е. качественных клинических испытаниях. С учетом редкости ССД, полиморфизма клинических проявлений, плохого прогноза болезни проведение формальных контролируемых испытаний связано с большими трудностями. Поэтому создать доказательные рекомендации оказалось очень сложно.
В связи с этим в целом уровень доказательств невысок и основан на одном-двух рандомизированных клинических (РКИ) или открытых клинических испытаниях. В этих рекомендациях не нашли отражения некоторые важные аспекты терапии, в частности по применению глюкокортикоидов (кроме СПК), ДПА, аминохинолиновых препаратов, основных иммуносупрессантов и др. В целом в современных рекомендациях по лечению ССД суммирован и проанализирован большой опыт зарубежных специалистов на определенном этапе, что в сочетании с опытом отечественной ревматологии, обобщенным в Национальных рекомендациях по ревматологии, должно помочь практическому врачу в эффективной курации больных и улучшению прогноза болезни.
Лечение больных ССД должно быть по возможности ранним, комплексным (с учетом сложного патогенеза заболевания) и определяться в зависимости от течения, клинической формы и характера органной патологии.
При поражении кожи основные усилия направлены на уменьшение распространенности и степени ее уплотнения. В рекомендации EULAR включено два препарата, эффективность воздействия которых на кожный синдром показана в РКИ. Для лечения ранней диффузной ССД рекомендуется МТХ в дозах 10–15 мг/сут длительным курсом (не менее 6 месяцев) и ММФ в терапевтической дозе 2 г/день [4–8]. В национальные рекомендации ревматологов России включен также ДПА (Купренил), рекомендуемый на ранней стадии болезни (в течение первых 3–5 лет болезни) или при нарастании выраженности и распространенности уплотнения кожи во время обострения. На основании того, что в РКИ не было показано различий влияния на кожный процесс высокой и низкой дозы ДПА, оптимальным считают прием 250–500 мг в сутки в зависимости от распространенности уплотнения кожи [9].
Кортикостероиды давно и успешно применяются при ССД. Они показаны при прогрессирующем диффузном поражении кожи и других клинических признаках воспалительной активности (серозит, миозит, ИПЛ, рефрактерный синовит и/или теносиновит) в небольших дозах – до 15 мг в сутки. Имеются достаточно веские основания полагать, что прием КС в бòльших дозах увеличивает риск развития СПК («склеродермической почки»). Поэтому превышение этой дозировки, особенно при остром течении диффузной формы и у больных с небольшой давностью болезни, опасно [10, 11].

Сосудистая терапия при ССД хорошо разработана и имеет наиболее весомую доказательную базу. Всем больным ССД с СР следует проводить длительную лекарственную терапию [12, 13]. Препаратами первой линии лечения СР, ассоциированного с ССД, служат блокаторы кальциевых каналов (антагонисты кальция) группы дигидропиридина, главным образом нифедипин [14, 15]. Для уменьшения частоты и выраженности побочных реакций предпочтительны длительно действующие антагонисты кальция. При неэффективности антагонистов кальция для лечения выраженного СР назначают простаноиды для внутривенного применения – илопрост или алпростадил (Вазапростан)[16]. Илопрост в/в не только снижает частоту и выраженность атак СР по сравнению с плацебо, но и оказывает положительный эффект на заживление, поэтому рекомендуется для лечения активных дигитальных язв [17]. У больных, леченных простаноидами, значительно чаще отмечаются ишемические кардиоваскулярные осложнения, поэтому перед назначением этой группы препаратов следует тщательно оценивать кардиоваскулярный риск [18]. Антагонисты кальция и простаноиды могут вызывать одинаковые гемодинамические эффекты, что требует повышенного внимания к мониторингу возможных побочных эффектов при комбинированном применении препаратов этих классов. При неэффективности антагонистов кальция и простаноидов, а также для лечения множественных и рецидивирующих дигитальных язв применяют блокаторы эндотелиновых рецепторов [19, 20]. Такой трехступенчатый подход с усилением терапии в соответствии с тяжестью периферических нарушений рекомендуется EULAR.
За последние годы все шире в лечении выраженного СР и дигитальных язв при неэффективности антагонистов кальция и простаноидов применяются ингибиторы ФДЭ-5, в частности силденафил [21, 22]. Клиническое улучшение в виде уменьшения длительности, частоты и выраженности атак СР наблюдалось и после лечения ингибитором ФДЭ-5 пролонгированного действия – варденафилом. Показано заживление дигитальных язв и меньшая частота появления новых дигитальных язв по сравнению с плацебо после лечения тадалафилом [23]. Одновременно с вазодилататорами рекомендуется прием препаратов, подавляющих агрегацию тромбоцитов. Для уменьшения болей при дигитальных язвах применяют нестероидные противовоспалительные препараты: парацетамол и слабые опиоиды в адекватных дозах. Для снижения риска желудочно-кишечного кровотечения и нефротоксичности следует применять минимальную эффективную дозу нестероидных противовоспалительных препаратов. Инфицированные дигитальные язвы требуют местного и/или системного применения антибиотиков широкoго спектра.
Основное место в лечении ИПЛ при ССД занимает циклофосфамид (ЦФ) в сочетании с КС [24–26]. Циклофосфамид – единственный препарат, рекомендованный EULAR для лечения ИПЛ при ССД. Доказана эффективность ЦФ после приема в течение 6 месяцев по сравнению с плацебо [27]. Пятилетняя выживаемость больных, получивших терапию ЦФ, была выше, чем у больных, получавших плацебо. Циклофосфамид назначают внутривенно в дозах 500–750 мг/м2 в месяц или перорально в дозах 1–2 мг/кг/день в зависимости от эффективности и переносимости препарата. Способ введения ЦФ (пероральный или внутривенный) значимо не влияет на изменения показателей функциональных легочных тестов. Длительность курса ЦФ должна быть не менее 6 месяцев. Имеются данные о лучшей эффективности более длительных курсов (12–24 месяца) ЦФ с большей его кумулятивной дозой. Применение ЦФ в больших дозах (600–750 мг/м2) в болюсном режиме может оказывать кардиотоксическое действие, особенно на больных пожилого возраста, при этом кардиотоксическое действие наиболее выражено в течение 4–6 дней после введения ЦФ. До начала и во время лечения ЦФ (через 5–7 дней после каждого в/в введения и 1 раз в 7 дней при пероральном приеме в начале лечения) необходимо определение уровня гемоглобина, числа лейкоцитов (общее, дифференциальное), тромбоцитов, азота мочевины, билирубина, креатинина, концентрации мочевой кислоты, активности АЛТ, АСТ, ЛДГ, измерение диуреза, удельной плотности мочи, выявление микрогематурии. При уменьшении числа лейкоцитов менее 2,5 × 109/л и/или тромбоцитов менее 100 × 109/л и повышении концентрации АЛТ/АСТ более чем в 3 раза от верхней границы нормы лечение необходимо прекратить до устранения симптомов токсичности. Для профилактики геморрагического цистита (может развиваться в течение нескольких часов или спустя несколько недель после введения) перед терапией ЦФ и в течение 72 часов после его применения рекомендуется потребление большого количества жидкости (2–3 литра в сутки) и применение средств, подщелачивающих мочу. При появлении первых признаков геморрагического цистита лечение ЦФ прекращается.
В случае неэффективности или непереносимости терапии ЦФ возможно применение других иммуносупрессивных препаратов: ММФ, азатиоприна, циклоспорина А, однако эффективность их при ССД не доказана. Перспективным в лечении ИПЛ при ССД представляется применение ММФ. Подтверждена способность ММФ эффективно стабилизировать, а в ряде случаев и улучшать показатели форсированной жизненной емкости и диффузной способности легких у пациентов ССД с ИПЛ [28]. Ретроспективный анализ показал улучшение 5-летней выживаемости на фоне приема ММФ. Длительность курса ММФ должна быть не менее 6 месяцев. В ретроспективных и открытых проспективных исследованиях ММФ назначался пациентам ССД в течение 6–33 месяцев. Микофенолата мофетил назначают с дозы 1000 мг/сут (в два приема), увеличивая ее до 2000 мг/сут (в два приема) в случае хорошей переносимости. Основные побочные эффекты ММФ наблюдаются со стороны желудочно-кишечного тракта (диарея, тошнота, рвота, повышение печеночных ферментов). Кроме того, встречаются гематологические нарушения: лейкопения, анемия (у 25 %) и тромбоцитопения. Микофенолата мофетил повышает восприимчивость больных к инфекции. При лечении ССД препарат не вызывал тяжелых случаев гепатотоксичности, клинически выраженных инфекций и лейкопении.
Для лечения ИПЛ при ССД в сочетании с иммуносупрессантами применяются КС преднизолон перорально в дозах 10–15 мг/сут. Не выявлено достоверной ассоциации между улучшением показателей легочной функции и применением высоких доз КС по сравнению с низкими [29].
Лечение ЛАГ включает средства традиционной терапии: диуретики, антикоагулянты, блокаторы кальциевых каналов и сердечные гликозиды в терапевтических дозировках. Терапия блокаторами кальциевых каналов показана только больным с позитивным вазореактивным тестом (проведенным при катетеризации правых отделов сердца). К препаратам выбора относятся дигидроперидиновые производные и дилтиазем. Пациентам с признаками сердечной недостаточности блокаторы кальциевых каналов противопоказаны, таким больным назначают петлевые диуретики в сочетании с антагонистами альдостерона. При возникновении наджелудочковых нарушений ритма возможно применение сердечных гликозидов. При глубокой гипоксемии (сатурация менее 90 %) показана кислородотерапия. Антикоагулянты назначают при тромботических осложнениях. За последние годы в практику введена т.н. ЛАГ-специфическая терапия – антагонисты рецепторов эндотелина (бозентан), простаноиды (илопрост) и ингибиторы ФДЭ-5 (силденафил) [30–32]. Специфическая терапия зависит от клинического состояния и тяжести, которые классифицируются по функциональной шкале ВОЗ.
В I функциональный класс (ФК) включают бессимптомных пациентов или с симптомами, минимально ограничивающими обычную физическую активность, а к IV ФК относят пациентов с наибольшими ограничениями физической активности, которые возникают даже в покое. Специфическая ЛАГ-терапия назначается с целью улучшения переносимости физических нагрузок, она замедляет прогрессирование болезни, вызывает регресс изменений в легочных сосудах, улучшает качество жизни и прогноз выживаемости. У больных I–III ФК препаратами первой линии счтаются бозентан и силденафил. Кроме этих препаратов к больными III ФК может быть применен ингаляционный илопрост. При развитии IV ФК, как правило, назначается комбинированная терапия этими препаратами. Бозентан рекомендуется в стартовой дозе 62,5 мг 2 раза в сутки; через 4 недели при хорошей переносимости увеличивают дозы до 125 мг 2 раза в сутки. Рекомендуется ежемесячно контролировать уровни трансаминаз и билирубина. Женщинам, принимающим бозентан, необходима надежная контрацепция с учетом возможного тератогенного эффекта. Силденафил назначают по 25 мг 2 раза в день, при хорошей переносимости дозу увеличивают до 100 мг в сутки. Удобной формой является силденафила цитрат (Ревацио), который назначают по 20 мг 3 раза в сутки. Ингаляционный илопрост эффективно снижает давление в легочной артерии. В сутки требуется от 6 до 12 ингаляций для поддержания стабильного эффекта. Период полувыведения илопроста составляет 20–25 минут, продолжительность действия – 45–60 минут. При использовании ультразвукового небулайзера продолжительность ингаляции составляет 5 минут.
Наиболее тяжелое проявление поражения почек при ССД – острая нефропатия (СПК, или «острая склеродермическая почка»). Как правило, развитие почечного криза сопровождается упорной артериальной гипертензией, поэтому основное место в лечении СПК занимает агрессивная гипотензивная терапия, которая может стабилизировать или улучшить функцию почек [33]. Препаратом первой линии в лечении СПК остаются иАПФ [24]. Лечение рекомендуется начинать с быстродействующих препаратов первого поколения каптоприла, назначая по 6,25–12,5 мг каждые 8 часов, и при сохранении высокой гипертензии постепенно увеличивать дозу до максимальной (50 мг 3 раза в сутки). В начале лечения ежедневное увеличение дозы иАПФ должно снижать уровень систолического АД на 10–20 мм рт. ст., т.к. слишком быстрое снижение АД (так же как и гиповолемия) может приводить к нежелательному снижению почечной перфузии (усугублению ишемии). При стабилизации АД можно перейти на прием иАПФ более длительного действия. Если на фоне максимальной дозы каптоприла АД не нормализуется в течение 72 часов, добавляют блокаторы кальциевых каналов, нитраты (особенно при появлении застойных явлений в легких) или другие вазодилатирующие средства. При сохранении олигурической стадии острой почечной недостаточности рассматривается вопрос о гемодиализе. Восстановление или улучшение функции почек после СПК происходит медленно – в течение 2 лет. Если после этого срока сохраняется потребность в гемодиализе, следует ставить вопрос о трансплантации почки. Наряду с СПК при ССД могут развиваться ишемическая нефропатия на фоне стеноза почечных артерий (исключается с помощью УЗИ); АНЦА-ассоциированный гломерулонефрит; нефропатия, ассоциированная с антифосфолипидными антителами; тромботическая ангиопатия после трансплантации гематопоэтических стволовых клеток. Поэтому при развитии острой нефропатии при ССД необходим дифференциально-диагностический поиск, особенно при подозрении на ишемическую нефропатию, при которой иАПФ противопоказаны.
Прием КС больными ССД оказывает провоцирующее действие на развитие СПК и ассоциируется с более высоким риском развития СПК, чем у больных, не получающих КС [34, 35]. Поэтому при назначении КС необходим тщательный контроль АД и функции почек. Следует с большой осторожностью назначать КС больным ССД с факторами риска развития СПК. К факторам риска СПК относят диффузную форму болезни, раннюю стадию заболевания (особенно первый год), быстрое прогрессирование кожного синдрома, быстрое формирование суставных контрактур, мужской пол, пожилой возраст, наличие антител к РНК-полимеразе III, прием больших доз КС.
При поражении желудочно-кишечного тракта при ССД качественные клинические испытания лечения больных ССД с желудочно-пищеводным рефлюком и гастроэзофагеальной рефлюксной болезнью (ГЭРБ) не проводились. Поскольку имеется обширная доказательная база, основанная на изучении этих состояний при других нозологиях и в общей популяции, полагают, что данные могут быть экстраполированы и на больных ССД. В качестве общих рекомендаций показано дробное питание, сон на кровати с приподнятым головным концом, нежелательно ложиться в течение двух часов после приема пищи, нужно отказаться от приема жирной пищи, алкоголя и курения. При желудочно-пищеводном рефлюксе, ГЭРБ, язвах и стриктурах пищевода применяют антисекреторные препараты, в первую очередь ингибиторы протонной помпы (омепразол 20–40 мг) [36]. Блокаторы протоновой помпы эффективнее снижают кислотность желудочного сока и уменьшают проявления ГЭРБ по сравнению с применением блокаторов H2-гистаминовых рецепторов. Гастроэзофагеальная рефлюксная болезнь, проявляющаяся клинически и эндоскопически, требует постоянного лечения ингибиторами протоновой помпы. Длительное лечение рефлюкса у больных ССД ингибиторами протоновой помпы в высоких дозах, по-видимому, безопасно и эффективно как в отношении симптомов, так и в предотвращении эзофагита и стриктур. При нарушении моторики (дисфагия, ГЭРБ, раннее насыщение, отрыжка, псевдо-обструкция и др.) назначают различные прокинетики – метоклопрамид, домперидон, эритромицин, которые увеличивают давление нижнего пищеводного сфинктера, ускоряют эвакуацию содержимого из желудка и увеличивают перистальтику тонкого кишечника. Применение прокинетиков ограничено наличием побочных эффектов, в т.ч. неврологического характера. Преимущества отдаются домперидону, антагонисту дофамина, аналогично метоклопрамиду и некоторым нейролептикам обладающему противорвотными свойствами. Прокинетический эффект имеет и эритромицин, применение которого в дозе 100–150 мг 2 раза в день или азитромицина по 400 мг 1 раз в день в течение 4 недель уменьшает тошноту, рвоту и приступы болей в эпигастральной области. Комбинация прокинетиков и антисекреторных препаратов улучшает состояние пациентов с рефлюкс-эзофагитом.
При развитии синдрома мальабсорбции, обусловленного избыточным бактериальным ростом, показано проведение антибиотикотерапии. Применяются следующие антибактериальные препараты: тетрациклин 250 мг 4 раза в сутки, доксициклин 0,1 мг 2 раза в сутки, миномицин 100 мг 2 раза в сутки, амоксиклав 875 мг 2 раза в сутки, цефалексин 250 мг 4 раза в сутки, ципрофлоксацин 500 мг 2 раза в сутки, норфлоксацин 400 мг 2 раза в сутки, метронидазол 250 мг 3 раза в сутки и др. Длительность курса – 10 дней, при недостаточной эффективности курс продлевают до 3–4 недель. В ряде случаев возникает необходимость использования парентерального питания и хирургических вмешательств. Хирургическое вмешательство, эффективное для лечения идиопатической ГЭРБ, при ССД показано пациентам с наиболее тяжелым течением этого состояния.
Проявления кардиальной патологии при ССД обусловлены как собственно склеродермическим поражением сердца, так и ассоциацией с легочной артериальной гипертензией, системной артериальной гипертензией на фоне поражения почек, гипертонической болезни или других сопутствующих коморбидных состояний с вовлечением сердца (ИБС, атеросклероз и др.). Нередко это создает полиморфную картину выраженной кардиопатии сложного генеза, для интерпретации которой необходимо детальное обследование и совместное ведение больных с кардиологом. Развитие склеродермического поражения сердца (перикардит, миокардит, нарушения ритма и проводимости) ухудшает прогноз заболевания в целом. Клинически манифестное поражение сердца редко бывает изолированным, часто возникает в ранней стадии диффузной формы болезни или в сочетании с миопатическим синдромом.
Лечение проводится с применением КС, иммуносупрессантов, широко применяют антиаритмические препараты, а также весь арсенал сердечно-сосудистых препаратов с учетом их индивидуальных возможностей снижать потребление миокардом кислорода, оказывать противоаритмическое и вазодилатирующее действия, улучшать диастолическую функцию миокарда и повышать толерантность к физическим нагрузкам без снижения сердечного выброса.
Лечение поражения суставов при ССД сходно с терапией суставного синдрома при ревматоидном артрите. В зависимости от выраженности артрита назначаются гидрохлорохин, МТХ (с осторожностью при одновременном поражении легких!) или сульфосалазин в виде монотерапии при общей низкой активности болезни или в сочетании с низкими дозами КС.
При воспалительных миопатиях назначают КС как монотерапию или в сочетании с МТХ. Дозы КС, необходимые для курации пациентов с ССД, могут быть ниже, чем при идиопатических воспалительных миопатиях, особенно у пациентов, позитивных по PM/Scl-антителам. Тактика ведения больных с тяжелой миопатией и факторами риска развития СПК не разработана.
Для предупреждения прогрессирования необходимо возможно раннее выявление заболевания и своевременное активное лечение в стационаре, а затем в амбулаторных условиях. Больным с установленным диагнозом ССД рекомендуется регулярно обращаться к врачу (оптимально – 1 раз в 3 месяца), соблюдать рекомендованный режим, диету и лечение; не изменять дозировки рекомендованных активно действующих средств без согласования с врачом. Правильное своевременное лечение и трудоустройство улучшают прогноз заболевания в целом, позволяют сохранять работоспособность и поддерживать хорошее качество жизни больных ССД.



