Проблема нейроэндокринных дисфункций, развивающихся в процессе терапии антипсихотическими препаратами (АПП), в последние годы неоднократно освещалась в отечественной и зарубежной литературе [1–5]. Столь пристальное внимание к эндокринологическим исследованиям в психиатрии на современном этапе обусловлено изменившейся ситуацией в клинической практике, когда перед психиатрами были поставлены задачи не только купирования психопатологической симптоматики, но и обеспечения высокого уровня социальной адаптации больных, улучшения качества их жизни и соблюдения режима терапии [3, 6–8].
В настоящее время спектр АПП (нейролептиков), выпускаемых российскими и зарубежными фармацевтическими компаниями, достаточно широк. Клиническая эффективность большинства АПП подтверждена многочисленными исследованиями, и они успешно применяются с целью устранения у больных психозами продуктивной симптоматики. Несмотря на большой опыт применения АПП в детской психиатрической практике, ряд побочных эффектов этих препаратов остается недостаточно изученным. Помимо экстрапирамидных нарушений, токсико-аллергических реакций, нарушений сердечного ритма, изменений в кроветворной системе нейролептики вызывают множество эндокринных расстройств. К настоящему времени установлено, что терапия антипсихотическими препаратами приводит к развитию синдрома гиперпролактинемии (ГП), различным нарушениям, входящим в структуру метаболического синдрома, вызывает гормональный дисбаланс в гипоталамо-гипофизарно-гонадной и гипоталамо-гипофизарно-тиреоидной осях, а также влияет на секрецию ряда других гормонов [2, 9–10].
Дети и подростки в большей степени, чем взрослые, подвержены риску развития побочных эффектов нейролептиков, что было доказано в ряде работ [11–13]. Тем не менее количество проведенных исследований, посвященных изучению влияния антипсихотической терапии на эндокринный статус, в детской и подростковой группах в разы меньше, чем во взрослой популяции. В базе данных медицинских исследований “PubMed” около 90 % работ о влиянии нейролептиков на метаболический профиль у детей и подростков посвящено изучению атипичных АПП, поскольку традиционные нейролептики в настоящее время используются в зарубежной медицине редко. Напротив, в российской детской психиатрической практике на сегодняшний день бóльшая часть применяемых АПП относится к традиционным, что делает исследование актуальным.
Механизмы развития ГП при применении АПП
Общим биохимическим свойством всех нейролептиков является их способность блокировать постсинаптические дофаминергические рецепторы с компенсаторным усилением синтеза и метаболизма дофамина. В результате нейрохимических исследований к настоящему времени установлено, что нейролептики имеют смешанный профиль рецепторной активности и помимо блокады D2-рецепторов блокируют и другие подтипы дофаминовых рецепторов, а именно D1, D3, D4, а также серотониновые, гистаминовые, мускариновые, адренергические и холинергические рецепторы [7]. По данным ряда авторов [10, 14, 15], применение нейролептиков ведет к значительному увеличению уровня пролактина и снижению содержания гормона роста. Существуют препараты с высоким сродством к D2-рецепторам, вызывающие особенно сильную секрецию пролактина, АПП с низким сродством и, соответственно, меньшей секрецией пролактина. Из этого следует, что различная степень способности нейролептиков блокировать D2-рецепторы позволяет в определенной мере предсказать развитие ГП. В исследовании E. Richelson показана прямая зависимость содержания пролактина в крови от дозы некоторых АПП [16].
Вопреки распространенной среди клиницистов тенденции игнорирования значимости ГП у больных с различными психическими заболеваниями, этот побочный эффект АПП может иметь серьезные социальные и медицинские последствия. Безусловно для пациентов с острым течением психического заболевания первой задачей является купирование психопатологической симптоматики и достижение ремиссии. Коррекция антипсихотической терапии проводится в случае выявления повышенного уровня пролактина в крови и клинических сим птомов ГП.
Отчетливые симптомы ГП, как правило, развиваются при высоких плазменных концентрациях пролактина
более 1000 МЕ/л (норма – 60–540 МЕ/л) [17]. Без терапии АПП уровень пролактина у больных шизофренией не отличается от такового в общей популяции и варьируется от 40 до 525 МЕ/л [5, 18]. Повышение уровня пролактина наблюдается в течение нескольких часов от начала антипсихотической терапии [19, 20]. В ходе продолжительного лечения концентрация пролактина в крови имеет тенденцию повышаться и достигать пиковой концентрации в течение первых 1–2 месяцев (4–7-я неделя) и затем постепенно снижаться до нормальных или близких к нормальным значений к 3–5-му месяцу (до 11–12 месяцев). Уровень пролактина, как правило, снижается до нормального в течение 2–4 дней (в отдельных случаях до 3 недель) после прекращения приема препарата [21].
В клинической структуре синдрома ГП у девочек наблюдаются нарушения менструального цикла в виде олиго- или аменореи, галакторея различной степени выраженности, сопровождающаяся в ряде случаев нагрубанием и болезненностью молочных желез, а также прибавка массы тела. У мальчиков синдром ГП может протекать бессимптомно, а у юношей – приводить к развитию избыточной массы тела и гипогонадизма.
Таблица 1. АПП, применявшиеся пациентами
Материал и методы
В работе представлены данные обследования 148 пациентов детского и подросткового возраста с психиче- скими заболеваниями, получающих антипсихотическую терапию в психиатрических отделениях на базе ГУЗ “Детская психиатрическая больница № 6” Департамента здравоохранения г. Москвы. Из числа обследованных пациентов ГП выявлена у 52 детей и подростков.
Гендерное распределение пациентов с ГП было следующим: 34 мальчика и 18 девочек − 23 мальчика в возрасте до 14 лет (медиана – 11,2 года, интерквартильный размах [8,8 ÷ 13,4]), 8 девочек в возрасте до 13 лет (медиана – 9,7 года [7,8 ÷ 11,6]), 11 мальчиков старше 14 лет (медиана – 15,2 года [14,5 ÷ 15,7]) и 10 девочек в возрасте старше 13 лет (медиана – 14,9 года [14,6 ÷ 15,9]). Соотношение мальчиков и девочек было приблизительно 1 : 2; мальчиков – 65 %, девочек – 35 %. Психическая патология у обследованных нами пациентов была представлена следующими состояниями или их сочетанием: шизофрения, аутизм, эпилепсия, умственная отсталость, психопатоподобный синдром, неврозоподобный синдром, депрессивный синдром, генерализованный тик, гипердинамический синдром, шизотипическое расстройство личности, психотическое расстройство личности, задержка речи, нервная анорексия, деменция и т. д. Нами проводилось сравнение АПП по степени развития ГП в зависимости от дозы препарата и длительности лечения. В качестве терапии основного заболевания все пациенты получали различные АПП, некоторые из больных находились на сочетанной терапии нейролептиками. АПП, применявшиеся больными, представлены в табл. 1. Подробно изучались анамнез заболевания, длительность лечения, смена нейролептика за период наблюдения, уточнялись кратность и дозировка приема АПП, соблюдение предписанного врачомрежима лечения, сопутствующая терапия. Выбор антипсихотической терапии проводился лечащим врачом-психиатром. Для получения полной информации о лечении
изучались текущие истории болезни (форма 3-у) и выписки из других стационаров.
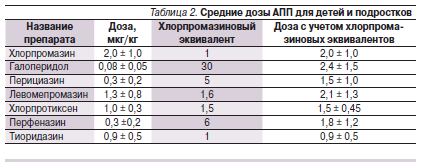
С целью стандартизации исследования побочных эффектов нейролептиков использовался хлорпромазиновый эквивалент − показатель, во сколько раз конкретный нейролептик активнее по основному действию (антипсихотическому, экстрапирамидному), соответственно, хлорпромазина или галоперидола. Согласно американской концепции “хлорпромазиновых эквивалентов”, эффективность всех нейролептиков практически одинакова при применении адекватных доз, уровень которых определяется индивидуальной мощностью антипсихотического действия препарата. В связи с этим все нейролептики могут считаться взаимозаменяемыми. Хлорпромазиновые эквиваленты АПП представлены в табл. 2.
Больные, принимавшие одновременно с нейролептиками антидепрессанты или другие лекарственные препараты, приводящие к повышению уровня пролактина в крови, в исследование не включались. Критерии включения пациентов в исследование: длительность регулярной антипсихотической терапии одним из препаратов более 3 недель, отсутствие острой психической симптоматики и двигательно-эмоционального возбуждения в момент взятия образца крови для исследования, а также исключение сопутствующей эндокринной патологии и других патологических состояний, сопровождающихся повышением уровня пролактина (первичный гипотиреоз, синдром пубертатной гиперандрогении, опухоли головного мозга, ревматоидный артрит, системная красная волчанка и т. д.).
Для анализа уровня пролактина у пациентов проводился забор крови путем венепункции локтевой вены утром натощак после не менее 8 часов голодания и до приема утренней дозы нейролептика. Исследование содержания пролактина в крови проводилось методом усиленной хемилюминесценции с использованием технологии MicroWell на автоматическом иммунохимическом анализаторе Vitros 3600 в лаборатории гормонального анализа ФГБУ “Эндокринологический научный центр” Минздравсоцразвития РФ.
Рис.1 Сравнительная оценка некоторых АПП по способности вызвать ГП
Всем пациентам с повышением уровня пролактина более 600 МЕ/л (норма 90,0–540,0 МЕ/л) проводилась оценка клинических проявлений ГП. Пациенты были осмотрены на наличие галактореи и гинекомастии, у девочек- подростков оценивалась менструальная функция. Оценка полового развития проводилась согласно классификации Tanner (1968), в которой 1-я стадия соответствует препубертату, а 4–5-е – половозрелому статусу. Объем тестикул у мальчиков оценивался с помощью орхидометра Prader.
Результаты исследования
Из 148 обследованных пациентов, получавших антипсихотическую терапию, у 52 (35 %) больных была выявлена ГП, в т. ч. на монотерапии – у 46 больных, на политерапии – у 6 (табл. 1).
При сравнительной оценке среднего уровня пролактина в зависимости от пола пациентов статистически значимых различий между мальчиками и девочками по содержанию гормона в крови выявлено не было (p = 0,65 по U-критерию Манна–Уитни).
Для выявления зависимости степени повышения уровня пролактина в крови и возраста больных пациенты были подразделены на 2 подгруппы: 1-я – дети до 14 лет, 2-я – подростки старше 14 лет. Анализ результатов исследования показал, что средний уровень пролактина у подростков на фоне антипсихотической терапии статистически значимо не отличался от такового у детей (p = 0,31 по U-критерию Манна–Уитни).
Сравнение АПП по способности вызывать ГП показал, что такие препараты, как перфеназин (Этаперазин), галоперидол (Галдол), тиоридазин (Сонапакс), левопромазин (Тизерцин), статистически значимо повышают уровень пролактина в крови на фоне 3–4 недель регулярного приема (p < 0,001 по U-критерию Манна–Уитни).
Уровень пролактина при приеме перфеназина составил: медиана – 694,9 МЕ/л [442,5 ÷ 887,1], галоперидола – 571,3 [366,0 ÷ 887,95], тиоридазина – 494,3 [272,1 ÷ 831,5], хлорпротиксена – 380,0 [229,9 ÷ 471,0], левопромазина – 355,6 [247,3 ÷ 730,5], хлорпромазина – 327,5 [250,2 ÷ 441,95], перициазина – 312,4 МЕ/л [225,1 ÷ 370,3]. Пациентов, получавших в качестве терапии алимемазин, трифлуоперазин и промазин, мы исключили из статистического анализа ввиду малого объема выборки.
Сравнительная характеристика некоторых антипсихотических препаратов по способности вызывать ГП представлена на рисунке.
Из 26 детей и подростков, получавших в качестве монотерапии тиоридазин, у 13 больных отмечено повышение уровня пролактина в крови: медиана − 836,1 МЕ/л, [761,7 ÷ 1066,8]. Средний возраст пациентов с диагностированной ГП составил 11,9 ± 2,9 года, а у больных с нормальным содержанием пролактина в крови 249,3 МЕ/л [221,1 ÷ 301,6] – 6,8 ± 3,6 года. В группе детей с нормальным уровнем пролактина доза тиоридазина составила min-max 0,005–0,02 мг/сут, а у детей с ГП – min-max 0,03–0,075 мг/сут. При проведении корреляционного анализа выявлена статистически значимая прямая умеренной степени зависимость между показателем уровня пролактина в крови и дозой тиоридазина (r = 0,6; p =
0,001). У пациентов с повышенным уровнем пролактина в крови клинические проявления ГП (галакторея, аменорея) не отмечались. Таким образом, у детей на монотерапии тиоридазином в 50 % случаев отмечается повышение уровня пролактина в крови, что требует более дифференцированного назначения препарата в подростковом возрасте и тщательной коррекции дозы.
Корреляционный анализ взаимосвязи содержания пролактина в крови и дозы АПП показал наличие статистически значимой прямой умеренной степени зависимости между показателем уровня пролактина в крови и дозой этаперазина (r = 0,74; p = 0,02), дозой галоперидола (r = 0,7; p = 0,015) и дозой хлорпротиксена (r = 0,69; p = 0,006).
С целью сравнения АПП по степени ГП их дозы были пересчитаны с учетом хлорпромазиновых эквивалентов. Средние дозы АПП, рассчитанные на килограмм массы тела ребенка, представлены в табл. 2.
Средний уровень пролактина относительно дозы нейролептика на килограмм массы тела у пациентов, при- нимавших тиоридазин, был статистически значимо выше, чем у принимавших галоперидол (p = 0,04) и левомепромазин (p = 0,042). Статистически значимых различий между средними уровнями пролактина в группах детей, в качестве терапии принимавших хлорпротиксен, перициазин, хлорпромазин и левомепромазин, выявлено не было (p > 0,05). Таким образом, по среднему уровню пролактина в крови у пациентов на фоне антипсихотической терапии препараты располагаются следующим образом:
тиоридазин > перфеназин = галоперидол > левомепромазин > хлорпромазин > перициазин = хлорпротиксен, что позволяет предположить, что по способности вызывать ГП данные препараты располагаются в аналогичном порядке.
В литературе имеется ограниченное количество точных сведений о степени влияния на уровень пролактина традиционных АПП у детей и подростков. Предполагается, что хлорпромазин, левомепромазин, перициазин, тиоридазин и галоперидол характеризуются одинаково высоким риском развития ГП [22]. Результаты другого исследования [23] свидетельствуют о том, что галоперидол повышает уровень пролактина в большей степени, чем хлорпромазин. Данных о влиянии на содержание пролактина в крови хлорпротиксена по сравнению с другими традиционными нейролептиками у детей и подростков крайне мало.
Для правильной оценки степени развития вторичных половых признаков в зависимости от возраста пациенты были разделены по группам: 1-я – пациенты 11–13 лет, 2-я – 14–15 лет, 3-я – 16–18 лет. В 1-й возрастной группе половое развитие соответствовало возрасту у 5 из 6 обследованных, во
2-й − у 5 из 7 и в 3-й группе − у 3 из 5. Таким образом, отставание полового развития чаще отмечалось среди пациентов старших возрастных группах.
При оценке клинической симптоматики ГП у обследованных пациенток было выявлено, что у 3 девочек из 10 обследованных старше 13 лет имелись нарушения менструальной функции в виде олигоменореи, галакторея обнаруживалась лишь при осмотре 2 пациенток и была минимально выражена. Около 50 % девочек имели SDS (Standard Deviation Score – коэффициент стандартного отклонения) ИМТ * (индекс массы тела) более 1,5: избыточная масса тела диагностирована у 5 пациенток, ожирение – у 3 девочек. При осмотре мальчиков у 8 пациентов из 34 (24 %) была выявлена гинекомастия (ложная, истинная), избы- точная масса тела диагностирована у 4, ожирение – у 2.
У пациентов с психическими заболеваниями и значимой ГП (свыше 1000 МЕ/л), вызванной приемом АПП, вопрос о дальнейшей тактике лечения решался индивидуально совместно с лечащим врачом-психиатром. В зависимости от тяжести основной патологии проводилась коррекция дозы или замена препарата, вызвавшего развитие ГП, на другой.
Выводы
Алгоритм назначения и проведения антипсихотической терапии в современных условиях требует учета не только особенностей психопатологического процесса и риска развития нейроэндокринных дисфункций, но и профиля нейроэндокринных побочных эффектов, характерных для каждого из нейролептических средств. Причем следует учитывать и тот факт, что реализация специфического для каждого АПП эндокринотропного эффекта у больных зависит от длительности заболевания, диагноза, наличия или отсутствия сопутствующей патологии, а также от морфоконституциональных особенностей больного.
Своевременное выявление нейроэндокринных дисфункций, проведение диагностических и при необходимости коррекционных мероприятий, а также выбор оптимальной терапевтической тактики (снижение дозы препарата, замена одного АПП на другой или назначение агонистов дофамина) позволяют улучшать качество жизни пациента, обеспечивать соблюдение режима приема нейролептика и повышать приверженность больного лечению.



