Эффективное лечение туберкулеза – одна из актуальных задач фтизиатрии, поскольку заболеваемость туберкулезом в Российской Федерации, несмотря на тенденцию к некоторому снижению, продолжает сохраняться на высоком уровне [42]. Приоритетная роль в лечении туберкулеза принадлежит химиотерапии. При этом противотуберкулезные препараты (ПТП) могут вызывать ряд побочных эффектов, что ограничивает их применение и ухудшает результаты лечения [12, 19, 24, 38].
Гепатотоксичность – одна из наиболее частых побочных реакций ПТП [12, 41, 43, 55]. Среди причин относительно нечастых летальных исходов, обусловленных применением ПТП [12], доминируют лекарственные поражения печени (ЛПП). Более частое поражение печени связано с тем, что в ней осуществляется метаболизм большинства ПТП. В исследовании [60] показано, что, если лекарственное средство (ЛС) метаболизируется в печени более чем на 50 %, достоверно чаще происходит повышение уровня аспартатаминотрансферазы (АСТ) более чем в 3 раза по сравнению с верхней границей нормы, развитие печеночной недостаточности, возникает необходимость трансплантации печени. Чаще наступают и летальные исходы по сравнению с ЛС, обладающими менее интенсивным метаболизмом в печени. Таким образом, печень при взаимодействии с ЛС выполняет роль основного органа-мишени.
Классификация ПТП представлена двумя группами: препараты I ряда (основные) и препараты II ряда (резервные) [40]. К препаратам I ряда относятся изониазид, рифампицин, пиразинамид, этамбутол, стрептомицин. Эти препараты наиболее эффективны, т. к. оказывают бактерицидный эффект на возбудителя туберкулеза. Они используются впервые выявленными больными, у которых микобактерии туберкулеза чувствительны к данным ЛС. ПТП II ряда представлены аминосалициловой кислотой (ПАСК), протионамидом, этионамидом, аминогликозидами (канамицин, амикацин, капреомицин), циклосерином, рифабутином и фторхинолонами (офлоксацин, ципрофлоксацин, левофлоксацин, моксифлоксацин). Их используют в случае лекарственной устойчивости к ПТП I ряда либо в случае плохой переносимости последних.
Среди ПТП гепатотоксичностью обладают рифампицин, изониазид, пиразинамид, протионамид, этионамид, аминосалициловая кислота [1, 8, 11, 15, 31, 41]. Особенности метаболизма этих препаратов и их влияние на печень представлены в табл. 1.
С патогенетической точки зрения ПТП могут вызывать следующие варианты лекарственных поражений печени: токсические и идиосинкразические [4, 6, 47].
Токсические реакции развиваются вследствие прямого повреждающего действия ЛС на клетки печени либо его реактивных метаболитов. Последний вариант возникает значительно чаще при применении ПТП [9, 24]. Токсические реакции зависят от дозы, времени приема, а также от пути выделения ЛС из организма и носят предсказуемый характер. Указывается, что подобные реакции обычно развиваются в пределах нескольких дней от начала терапии [50]. Однако при использовании ПТП это происходит чаще всего в течение первых 1–2 месяцев лечения [11, 24, 44].
Реакции идиосинкразии формируются у “восприимчивых” пациентов, практически не зависят от дозы и времени введения лекарственного средства. Их развитие предсказать невозможно, а возникать они могут в различные сроки лечения [37]. Чаще имеется указание на сроки от 2 до 4 недель [49]. Реакции идиосинкразии обусловлены врожденными генетическими дефектами ферментов, участвующих в метаболизме, что приводит к особой биотрансформации ЛС [6, 28, 50]. В этом процессе большая роль принадлежит ферментам цитохрома Р450 [29]. На мембране гепатоцитов имеется несколько изоферментов Р450, индукция которых может приводить к образованию специфических антител. В основе развития реакций идиосинкразии лежат иммунологические механизмы. Данные реакции могут протекать по иммуноаллергическому либо метаболическому типу. В частности, сами ПТП либо образующиеся в процессе их биотрансформации метаболиты могут обладать свойствами гаптенов, т. е. неполных антигенов. Полноценными антигенами они становятся после ковалентного связывания с белковыми молекулами паренхимы печени. Это в свою очередь влечет за собой изменение структуры белков и выработку антител с последующим повреждением гепатоцитов. Повторное применение препарата приводит к усилению иммунной реакции. Повреждение печени подобного типа могут вызывать изониазид и рифампицин. Так, при лечении рифампицином возможно развитие острой печеночно-почечной недостаточности как проявление иммуноаллергического осложнения, которое связывают с наличием в сыворотке крови антирифампициновых антител [44]. Изониазид может вызывать иммуноаллергическое повреждение печени в виде острого гепатоцеллюлярного некроза [2, 61]. Реакции идиосинкразии могут развиваться в разные сроки лечения, но при применении ПТП – чаще в первые 1–2 месяца от начала терапии.
По мнению некоторых авторов, предрасполагающим фактором в формировании повышенной чувствительности к ПТП имеет и сам характер туберкулезного воспаления, особенно его инфильтративная фаза, которая сопровождается сенсибилизацией организма и рассматривается как стадия аллергической настроенности организма [44].
Нередко на фоне проведения многокомпонентной противотуберкулезной терапии механизмы ЛПП могут сочетаться [8, 15, 21, 23, 61]. Эти случаи в соответствии с принятой в отечественной фтизиатрии классификацией побочных реакций ПТП характеризуются как токсико-аллергические реакции [24]. Так, у ряда больных повышение активности печеночных ферментов коррелирует с развитием кожно-аллергических реакций в виде розеолезной сыпи, зуда кожи, эозинофилии [15]. Вместе с тем далеко не всегда иммуноаллергические поражения печени сопровождаются общими реакциями гиперсенсибилизации, что отражает сложность диагностики аллергических вариантов ЛПП [41]. Ввиду данного обстоятельства полагают, что к токсико-аллергическим побочным реакциям нередко относят поражения чисто аллергического генеза [12]. Другие исследователи указывают на некорректность термина “токсико-аллергические реакции”, объединяющего разнородные по патогенезу процессы [1]. В то же время при любом характере побочного действия ПТП присутствуют как токсический, так и аллергический компоненты [24].
Метаболизм ЛС определяется характером и течением реакций биотрансформации, представленных последовательными фазами [2]:
• Первая фаза включает совокупность процессов гидроксилирования и окисления лекарств, приводящих к образованию промежуточных метаболитов, часть из которых может обладать гепатотоксическими свойствами. Значительная роль здесь принадлежит системе цитохромов Р450, расположенной в микросомальной фракции гепатоцитов (гладкой эндоплазматической сети) и являющейся одной из основных систем, метаболизирующих лекарства, в т. ч. и ПТП [5, 10]. Эта система представлена многочисленными изоферментами, среди которых известно более 50. Изменение количества и содержания ферментов системы цитохрома Р450 может быть обусловлено как экзогенными факторами, так и индивидуальными генетическими особенностями организма.
• В течение второй фазы реакций биотрансформации происходит конъюгация метаболитов ЛС с глутатионом, сульфатом или глюкуронидом с формированием нетоксичных гидрофильных соединений. Истощение запасов глутатиона может приводить к нарушению процессов конъюгации и накоплению токсических продуктов метаболизма ЛС.
• Третья фаза реакций биотрансформации – выведение нетоксичных метаболитов ЛС в кровь или желчь.
Патогенетические механизмы ЛПП, в т. ч. вызванные использованием ПТП, достаточно изучены [21, 44, 53, 56, 60, 68]. В качестве значимых нарушений, вызванных избытком ПТП или его метаболитов, рассматриваются истощение ферментных систем, нарушение процессов окислительного фосфорилирования, гомеостаза кальция. Большая роль в развитии печеночной токсичности отводится поражению клеточных мембран, что наступает вследствие активации перекисного окисления липидов и повышения активности лизосомальных ферментов. Развиваются нарушения цитоскелета клеток, их гибель. Весьма важным событием в цепи патологических реакций является индукция апоптоза, особенно лимфоцитов [24, 32]. Происходит также истощение запасов АТФ, резко снижается активность НАДФН-ДГ (никотинамидадениндинуклеотид фосфат дегидрогеназы), наиболее важного компонента микросомальной монооксидантной системы, играющего значительную роль в нейтрализации ксенобиотиков [24]. Одним из ключевых моментов ЛПП является поражение митохондриального аппарата клеток [4, 24, 65]. В части случаев развивается блокада транспортеров желчных кислот. Под действием ПТП истощаются запасы глутатиона – одного из наиболее важных антитоксических агентов печени [67]. Подобные изменения вызывают, в частности, изониазид и рифампицин [36].
Риск развития ЛПП может быть обусловлен рядом факторов:
• Возраст. Риск поражения печени выше у пожилых лиц в связи со снижением объема печеночной паренхимы и снижения в ней интенсивности кровотока, что замедляет выведение и сказывается на метаболизме ЛС [9, 41, 37].
• Пол. К группе риска относятся женщины, у которых ЛПП развиваются достоверно чаще [6, 25, 37].
• Путь и способ введения ЛС. Парентеральный способ введения ПТП увеличивает риск гепатотоксичности. Внутривенное введение изониазида способствует повышению доли ацетилирования в инактивации этого препарата и тем самым увеличивает его токсическое влияние на печень [1, 21]. Интермиттирующий режим введения рифампицина способствует гиперсенсибилизации и повышению в крови антител к препарату, инициируя и утяжеляя течение побочных реакций иммуноаллергического типа.
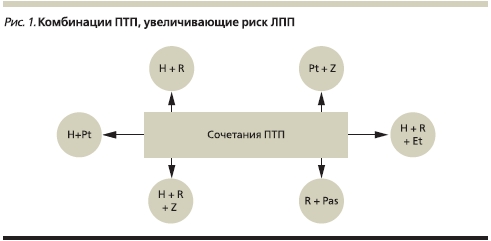
• Сочетанное применение ПТП. Одновременное применение различных ПТП, обладающих гепатотоксичностью, приводит к увеличению частоты ЛПП [27, 29, 48, 65, 66] (рис. 1). Чаще всего отмечается развитие ЛПП при сочетанном применении изониазида и рифампицина, что, по-видимому, обусловлено масштабом применения этих ПТП в химиотерапии [1, 15, 36, 43, 48]. Сочетание изониазида, рифампицина и ПАСКа может вызывать развитие молниеносного гепатита [1]. При сочетании рифампицина и ПАСКа увеличивается фракция несвязанного с белками сыворотки крови рифампицина. У быстрых инактиваторов изониазида ПАСК замедляет процессы ацетилирования препаратов данной группы на 20 %. Изониазид уменьшает связывание рифампицина с белками крови, что в свою очередь приводит к увеличению концентрации последнего и вероятности токсического поражения печени.
• Гипоальбуминемия. В условиях гипоальбуминемии использование рифампицина увеличивает долю несвязанного препарата и способствует возрастанию его концентрации в сыворотке крови [24, 64].
• Длительность приема ЛП. Длительный прием изониазида может приводить к формированию цирроза печени [12, 48].
• Индукция ферментов системы цитохрома Р450 в результате различных воздействий. Увеличение количества ферментов системы цитохрома Р450 сопровождается выработкой токсичных метаболитов. В частности, при одновременном приеме рифампицина и изониазида увеличивается риск возникновения гепатита, т. к. рифампицин является мощным индуктором системы цитохрома Р450, что приводит к ускорению метаболизма изониазида и накоплению его токсичных метаболитов. В этом случае гепатиты развиваются у 5–8 % больных, в то время как при монотерапии рифампицином – у 0,3 %, при монотерапии изониазидом – у 1,2 % [29]. Этот феномен объясняется тем, что в условиях конкурентного взаимодействия двух лекарственных средств за один участок связывания с ферментом замедляется метаболизм препарата, обладающего меньшим сродством к данному ферменту, что приводит к его кумуляции и увеличению продолжительности действия. Индукция ферментов системы Р450 может наступать также у лиц, злоупотребляющих алкоголем, при курении, разнообразных лекарственных взаимодействиях. Так, при назначении изониазида лицам, употребляющим алкоголь, повышается риск ЛПП, т. к. алкоголь, являясь микросомальным индуктором, способствует повышению количества токсичных метаболитов изониазида [17].
• Метаболизм лекарственных средств в печени может различаться из-за генетических различий в активности ферментов биотрансформации лекарств [45]. Так, например, существуют генетически детерминированные различия в скорости ацетилирования изониазида, обусловленные полиморфизмом NAТ2 (ариламин-N-ацетилтрансферазы). На этом основании выделяют быстрые и медленные ацетиляторы [40]. У медленных ацетиляторов снижается скорость инактивации изониазида, что повышает риск развития гепатотоксичности препарата [20].
• Сопутствующие заболевания печени как инфекционной, так и иной природы в значительной степени в результате изменение фармакокинетики ЛС способствуют повышению вероятности ЛПП при применении ПТП [9, 19, 48, 58, 59]. К другим факторам риска, повышающим вероятность развития ЛПП, относятся также нарушения нутритивного статуса, сахарный диабет, ВИЧ-инфекции [23, 46]. В последнем случае развитие гепатотоксических реакций в значительной степени обусловлено сочетанным применением ПТП и антиретровирусной терапии.
Данные о частоте ЛПП, вызванных приемом ПТП, весьма противоречивы (табл. 2).
Это обусловлено рядом факторов. Во-первых, значительные трудности в распознавании гепатитов лекарственной этиологии связаны с тем, что ЛПП могут иметь признаки сходства с другими заболеваниями печени [33, 62, 65]. Так, изониазид может вызывать повреждение печени, клинически, биохимически и морфологически не отличимое от хронического гепатита [49, 61]. С другой стороны, неоднозначные показатели частоты ЛПП могут быть обусловлены отсутствием утвержденных стандартов диагностики ЛПП и их единой классификации [2, 13, 29]. Кроме того, проводимые исследования отражают довольно разнообразный клинический материал. При этом отмечается неоднородность групп пациентов, имеющих различную сопутствующую патологию, генетические особенности, характер и режимы химиотерапии, а также иные факторы, которые могут оказывать влияние на варианты ЛПП при лечении туберкулеза.
Варианты ЛПП при применении ПТП характеризуются большим разнообразием: может иметь место как бессимптомный подъем уровня печеночных ферментов, увеличение уровня билирубина и его фракций, так и развитие острого и хронического гепатитов без желтухи, тяжелых холестатических гепатитов, цирроза печени, а также формирование острой печеночной недостаточности [8, 32, 48]. Острые лекарственные гепатиты носят смешанный характер, т. е. сопровождаются признаками как цитолиза, так и холестаза [30]. Хронические гепатиты, развивающиеся на фоне применения ПТП, могут быть представлены хроническим активным лекарственным гепатитом либо хроническим персистирующим лекарственным гепатитом. В клинических наблюдениях нередко указывается на развитие изолированного повышения уровня ферментов аланинаминотрансферазы/аспартатаминотрансферазы – АЛТ/АСТ [6, 8, 28, 48, 54]. Наряду с этим на фоне проведения терапии ПТП может развиваться сочетанное повышение активности АСТ/АЛТ и уровня билирубина [32]. Следует отметить, что факту повышения уровня индикаторных ферментов у больных туберкулезом, получающих ПТП, не всегда придается должное значение. Почти в половине случаев развивающиеся токсические гепатиты характеризуются малосимптомным или бессимптомным течением, поэтому лечебные мероприятия проводятся несвоевременно и возникает риск тяжелых поражений печени с развитием угрожающих жизни состояний в виде острой печеночной энцефалопатии [17]. Поэтому больным туберкулезом следует проводить систематическую оценку биохимических показателей, отражающих состояние печени, изменение которых может оказаться практически первой манифестацией развивающегося ЛПП [37].
Различные варианты ЛПП, вызванные ПТП, характеризуются и разнообразными морфологическими изменениями [12]. Наиболее характерны наличие эозинофилов в лимфомакрофагальных воспалительных инфильтратах, гиперплазия гладкой эндоплазматической сети и гигантские митохондрии с паракристаллическими включениями в гепатоцитах, жировая дистрофия печеночных клеток, наличие звездчатых ретикулоэндотелиоцитов с большим количеством гетерогенных включений в цитоплазме. Изменения незернистой эндоплазматической сети печеночных клеток отражают нарушение функционирования ферментных систем, которая принимает важное участие в метаболизме ЛС, в частности в их обезвреживании и выведении и из организма. Длительное применение ПТП приводит к функциональному истощению этой системы, развитию деструктивных изменений гепатоцитов вплоть до парциальных некрозов. Кроме того, у ряда больных отмечено развитие внутриклеточного холестаза.
Как указывалось выше, единая классификация ЛПП отсутствует. В гепатологии используется масса различных классификаций, основанных на клинико-морфологических вариантах поражения печени, что не всегда удобно применять в повседневной клинической практике [30, 51, 52]. С целью определения типа ЛПП и выбора оптимальной терапии чаще всего используют классификацию, основанную на биохимических показателях [56]. Выделяют три основных биохимических варианта ЛПП: цитолитический, холестатический и смешанный. Их диагностика основана на определении содержания в сыворотке крови АЛТ и щелочной фосфатазы – ЩФ (табл. 3) [57].
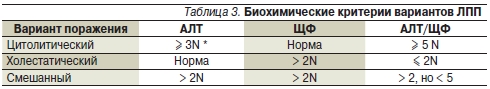
* N – верхняя граница нормы.
Клиническими проявлениями ЛПП могут быть гепатомегалия, болевой синдром, диспепсия, астеновегетативный синдром, желтуха, лихорадка, иктеричность склер. Отмечено, что на фоне применения ПТП увеличение печени отмечается нечасто, что можно рассматривать как один из признаков, отличающих данную патологию от поражений печени другой этиологии [9]. Тяжесть течения ЛПП на фоне применения ПТП в значительной мере зависит от сопутствующих заболеваний печени, особенно аутоиммунного характера – хронических гепатитов, циррозов (особенно развившихся в результате вирусных гепатитов). Также указывается на неблагоприятную роль стеатогепатитов или выраженного стеатоза печени [3].
Диагностика и дифференциальная диагностика медикаментозных гепатитов представляют сложную проблему [17]. В частности, предлагается использовать несколько критериев: хронология возникновения осложнений, регресс клинических симптомов после отмены лечения, отсутствие другой возможной патологии, результаты лабораторно-инструментальных исследований [52]. В то же время в условиях многокомпонентной противотуберкулезной терапии довольно сложно оценить хронологический фактор [43]. К исследованиям, проводимым с целью дифференциальной диагностики ЛПП с патологией печени иной этиологии, относятся исследование печеночных ферментов, иммуноферментный анализ (маркеры вирусных гепатитов, опухолей), инструментальные методы (ультразвуковое исследование, компьютерная томография – КТ, лапароскопия с биопсией печени, эндоскопическая ретроградная холангиопанкреатография) [29, 46]. С целью уточнения аллергического характера поражения печени рекомендуется использование проб Шелли, Уанье, выявление уровня антител к ПТП, определение уровня ЦИК (циркулирующих иммунных комплексов), гаммаглобулинов [1, 24]. Несмотря на предлагаемые разными авторами алгоритмы диагностики ЛПП, широкого применения в клинической практике при проведении противотуберкулезной терапии они не нашли.
Таким образом, ЛПП, индуцированные применением ПТП, представляют значительную проблему для фтизиатрии и требуют поиска средств медикаментозной коррекции, включая применение оптимальных гепатопротекторов. С точки зрения доказательной медицины одним из наиболее эффективных и безопасных средств этой группы ЛС может считаться адеметионин (S-аденозил-L-метионин, Гептрал). Это соединение относится к аминокислотам и их производным, играет важнейшую роль в реакциях трансметилирования, транссульфирования и аминопропилирования. Адеметионин участвует в биосинтезе фосфолипидов, глутатиона, таурина и других биологически активных соединений. Этот препарат играет ключевую роль в метаболизме ксенобиотиков, что определяет его эффективность как средства сопровождения при применении потенциально гепатотоксичных препаратов. Адеметионин усиливает элиминацию свободных радикалов и других токсических метаболитов из гепатоцитов, стимулирует процессы регенерации. Несомненным достоинством данного препарата является наличие отчетливого гепатопротекторного действия при патологии печени различного генеза. Он весьма эффективен при высоких показателях цитолиза и синдроме холестаза [14, 18, 22, 39]. Большинство этиологических факторов внутрипеченочного холестаза приводит к угнетению активности S-аденозилметил-синтетазы и снижению продукции S-адеметионина, что сопровождается нарушением биохимических процессов в гепатоцитах – трансметилирования, трансаминирования и транссульфирования. Высокая эффективность адеметионина как гепатопротектора продемонстрирована при изучении его действия при проведении химиотерапии онкологическим больным [16, 18]. Следует отметить, что принципы химиотерапии больных туберкулезом во многом аналогичны таковым при терапии опухолевых заболеваний – лечение требует длительных сроков, непрерывности, одновременного использования нескольких ЛС, не всегда имеется возможность свободного манипулирования ЛС и их комбинациями, что позволяет предполагать сопоставимую эффективность использования адеметионина и больными ЛПП, вызванными ПТП.
Адеметионин обладает и другими важными лечебными эффектами. Так, препарат наряду с гепатопротективным свойством оказывает и антидепрессивное влияние [7, 35]. Это весьма актуально для больных туберкулезом, характеризующихся, с одной стороны, склонностью к соматогенным депрессиям, с другой – к алкоголизму. Чрезвычайно важны также антиоксидантные свойства препарата, поскольку хорошо известно, что в патогенезе туберкулезного воспаления огромную роль играет нарушение системы перекисного окисления липидов, требующее в свою очередь медикаментозной коррекции [26]. Важным обстоятельством является то, что адеметионин хорошо переносится пациентами в процессе лечения и практически не вызывает побочных эффектов. Несмотря на использование адеметионина в числе гепатопротекторных препаратов больными туберкулезом, в литературе отсутствуют основательные клинические исследования, посвященные изучению его действия на эту группу больных.
Далее приводим клинические наблюдения.
Клиническое наблюдение 1
Больная П. 35 лет. Туберкулез легких выявлен при обследовании по контакту с сыном (у ребенка отмечено нарастание чувствительности к туберкулину). После рентгенологического исследования органов грудной клетки пациентка поступила для лечения в клинику фтизиопульмонологии.
При поступлении: масса тела – 41,5 кг. Рост – 158 см. Кожа смуглая, чистая. Грудная клетка правильной формы, перкуторно – притупление звука в межлопаточной области справа. Аускультативно – дыхание везикулярное, хрипов нет. Тоны сердца ясные, частота сердечных сокращений (ЧСС) – 86 в минуту, артериальное давление (АД) – 115/70 мм рт. ст. Живот мягкий, безболезненный при пальпации. Печень не выступает из-под края реберной дуги.
В общем анализе крови: лейкоциты – 10,1 × 103 в мм3, СОЭ – 32 мм/ч. Биохимические показатели крови при поступлении (глюкоза, билирубин, трансаминазы, диастаза крови и мочи, мочевина, креатинин) в норме. На фоне лечения отмечено повышение уровней трансаминаз, прямого билирубина сыворотки крови.
Анализ мокроты: микобактерии туберкулеза (МБТ) в мокроте выявляли с помощью люминесцентной микроскопии (1+). При посеве – рост МБТ, устойчивых к стрептомицину, изониазиду, рифампицину, чувствительных к этамбутолу, пиразинамиду, канамицину, офлоксацину, циклосерину, капреомицину, этионамиду, ПАСК.
По рентгенологическим и КТ-данным органов грудной клетки: в верхней доле правого легкого и в С6 затемнение 19 × 21 мм с полостью распада 11 × 12 мм, очаговые и инфильтративные изменения. Утолщение костальной плевры справа. В С3 левого легкого тонкостенная киста 15 × 17 мм (рис. 2).
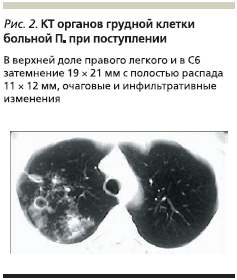
Диагноз при поступлении: инфильтративный туберкулез верхней доли правого легкого в фазе распада и обсеменения, МБТ “+”. Множественная лекарственная устойчивость (МЛУ) МБТ. Киста С3 правого легкого. Первичный гипотиреоз. Миопия слабой степени.
Назначена противотуберкулезная терапия: изониазид 10 мг/кг/сут внутримышечно (в/м) и перорально, рифампицин 0,3 мг/кг/сут, пиразинамид 1,0 мг/кг/сут, этамбутол 1,0 мг/кг/сут, канамицин 0,7 мг/кг/сут в/м. Через 2 недели химиотерапии появились жалобы на тошноту, в биохимических анализах крови отмечено повышение уровней АЛТ и АСТ в 8–10 раз, прямого билирубина – в 4 раза. Был отменен рифампицин, назначен Гептрал по 400 мг внутривенно капельно в течение 10 дней, далее перорально – по 400 мг 2 раза в сутки.
После получения результатов лекарственной устойчивости МБТ химиотерапия продолжена пиразинамидом 1,0 через день (ч/д), этамбутолом 1,0 ч/д, канамицином 0,7 в/м, натрия парааминосалицилатом 300 мл в/в или ПАСК 6,0 перорально в сутки, протионамидом 0,5, ломефлоксацином 0,6. Отмечены гепатотоксические реакции в виде сохранения повышенного уровня трансаминаз в 4–5, прямого билирубина – в 3–4 раза, потребовавшие отмены пиразинамида и ломефлоксацина. Гептрал применяли практически в течение всего периода лечения.
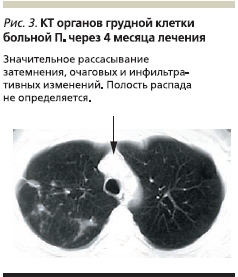
На фоне проводимого лечения отмечена положительная динамика в виде ликвидации проявлений интоксикационного синдрома, нормализации гемограммы через 2 месяца лечения, бактериовыделение прекратилось через 2 месяца лечения. МБТ-методами люминесцентной микроскопии и посева определяться перестали. По данным КТ органов грудной клетки, через 4 месяца наблюдалось значительное уменьшение затемнения, очаговых и инфильтративных изменений. Полость распада не определялась (рис. 3). Уровень прямого билирубина нормализовался, уровни АСТ, АЛТ увеличены незначительно.
Представленное клиническое наблюдение иллюстрирует возможности нормализации гомеостаза и “преодоление” гепатотоксических реакций с помощью препарата Гептрал, что обеспечило хорошую переносимость противотуберкулезной химиотерапии резервными препаратами.
Клиническое наблюдение 2
Больной Г. 22 лет. В течение 4 месяцев пациент наблюдался в различных клиниках Москвы. Лечился с диагнозом затяжной пневмонии нижней доли правого легкого антибиотиками широкого спектра действия, иммуностимулирующими препаратами. Состояние не улучшалось, при контрольной КТ органов грудной клетки была отмечена отрицательная динамика процесса. Поступил для обследования и лечения в клинику фтизиопульмонологии.
При поступлении масса тела – 65 кг. Рост – 185 см. Кожа чистая. Грудная клетка правильной формы, перкуторно – притупление звука по подмышечной линии справа на уровне 5–7-го ребра. Аускультативно – жесткое дыхание в подмышечной области справа. Тоны сердца ясные, ритм правильный, ЧСС – 72 в минуту, АД – 110/60 мм рт. ст. Живот мягкий, безболезненный при пальпации. Печень не выступает из-под края реберной дуги.
Биохимические показатели крови (глюкоза, трансаминазы, амилаза, мочевина, креатинин) при поступлении – в норме, прямой билирубин – 5,27.
Анализ мокроты: в мокроте определялись МБТ методом люминесцентной микроскопии и при посеве на жидкие питательные среды.
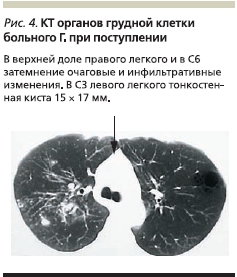
По данным КТ органов грудной клетки при поступлении: инфильтрация легочной ткани в С8, перисциссурально, структура неоднородная, на фоне инфильтратов видны мелкие, диаметром до 5 мм участки распада, утолщение междолевой плевры. Очаги обсеменения на протяжении нижней доли средней плотности диаметром 1–3 мм (рис. 4).
По данным трахеобронхоскопии при поступлении диагностирован туберкулез правого нижнедолевого бронха (ПНДБ), инфильтративная форма, что было подтверждено морфологически.
Диагноз при поступлении: инфильтративный туберкулез нижней доли правого легкого в фазе распада, МБТ+. Туберкулез ПНДБ, инфильтративная форма.
Противотуберкулезная терапия проводилась изониазидом 10 мг/кг/сут в/м, перорально, в ингаляциях; рифампицином 0,6, пиразинамидом 1,5 через день в чередовании с этамбутолом 1,2 в сутки; канамицином 1,0 в/м, витамином В6. Через 2 недели химиотерапии отмечено повышение уровней АЛТ и АСТ в 4–6, прямого билирубина – в 3–4 раза. Противотуберкулезная терапия была продолжена в прежнем объеме, дополнительно внутривенно капельно назначили Гептрал по 400 мг в течение 10 дней, далее перорально – по 400 мг 2 раза в сутки. В течение 6 месяцев больному проводили лечение противотуберкулезными препаратами в сочетании с Гептралом.
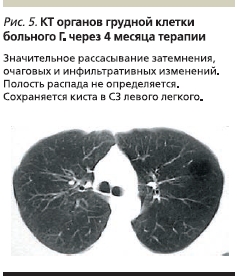
Через 2 месяца лечения было достигнуто значительное улучшение в виде ликвидации интоксикационного, бронхолегочно-плеврального синдромов, за 6 месяцев масса тела пациента увеличилась на 9 кг. Бактериовыделение перестало выявляться методом люминесцентной микроскопии через месяц лечения, а через 2 месяца – методом посева. При КТ грудной клетки через 4 месяца лечения наблюдалось значительное рассасывание затемнения, очагов и фокусов, закрытие полостей распада в нижней доле правого легкого (рис. 5). Нормализовались показатели АСТ, АЛТ, прямого билирубина.
По данным трахеобронхоскопии через 2,5 месяца патологии выявлено не было, наступило клиническое излечение туберкулеза ПНДБ.
Несмотря на несвоевременное выявление туберкулеза и развитие ЛПП, вызванного применением ПТП, проведение адекватной химиотерапии в сочетании с гепатопротекторами оказало патогенетическое воздействие (включая антиоксидантный эффект Гептрала), что позволило излечить больного практически без остаточных изменений в легочной ткани и бронхах.
В лечении больного не использовались традиционные для фтизиатрии антиоксиданты (тиосульфат натрия и витамин Е).
Таким образом, участие адеметиони-на практически во всех звеньях пато-генеза ЛПП, протекающих с синдромом внутрипеченочного холестаза, в т. ч. вызванных применением ПТП, а также объективно существующая на сегодняшний день доказательная база эффективности данного препарата при различных патологических процессах открывают широкие перспективы для его дальнейшего изучения и использования больными туберкулезом.



