Вступление
Четверть века лорноксикам, представитель группы нестероидных противовоспалительных средств (НВПС), применяется в медицинской практике. Являясь представителем класса оксикамов, за этот относительно небольшой период времени лорноксикам зарекомендовал себя не только как эффективное противовоспалительное и анальгетическое лекарственное средство, но и как относительно безопасный препарат, в т. ч. среди пациентов «групп риска». В России прошло 15 лет с момента одной из первых публикаций, в которой были представлены результаты клинического применения препарата пациентами с острой послеоперационной болью [5]. За прошедший период накоплены данные международных и национальных исследований, свидетельствующие о высокой эффективности и безопасности лорноксикама [45, 46, 57]. По анальгетическому и противовоспалительному действиям лорноксикам не уступает, а в отдельных случаях превышает таковые при сравнении с другими представителями НВПС, которые десятилетиями рутинно применяются в неврологии, ревматологии, онкологии, хирургии и других областях медицины. Едва ли следует относиться к этому препарату как к «очередному представителю» обширной группы НВПС. Лорноксикам обладает рядом свойств, позволяющих выделить его не только как представителя оксикамов с коротким периодом полувыведения, но и как препарат с сильным анальгетическим эффектом, что обусловливает его широкое применение пациентами с острой болью.
Механизм действия
Ингибирование циклооксигеназы-1 и -2 (ЦОГ) обусловливает анальгетический и противовоспалительный эффекты [14]. НВПС ингибируют ЦОГ – фермент, который принимает участие в метаболизме простагландинов (ПГ) и тромбоксана A2. ПГ обеспечивают некоторые физиологические функции, такие как регуляция сосудистого тонуса и микроциркуляции слизистой оболочки желудочно-кишечного тракта (ЖКТ), почечного кровотока, сенсибилизация нейронов на стимуляцию и др. Кроме того, они играют важную роль в воспалительных и ноцицептивных реакциях.
Действие лорноксикама обусловлено ингибированием активности ферментов, участвующих в метаболизме арахидоновой кислоты и образовании ПГ. Лорноксикам ингибирует ЦОГ-1 и -2 в сравнимых концентрациях, таким образом, индекс воздействия на ЦОГ-1/-2 составляет 1, что свидетельствует о сбалансированном характере угнетения активности изоформ ЦОГ. Изучаются другие механизмы действия лорноксикама. Его анальгетическое и противовоспалительное свойства могут характеризоваться влиянием на периферические эффекты [17], например вызванные воздействием на механизм NO-цГМФ, открытием К+-каналов [13, 14]. Введение лорноксикама сопровождается повышением в плазме уровня динорфина и β-эндорфина, демонстрируя таким образом у него наличие центрального механизма действия [36]. Лорноксикам значимо угнетает активность эндотоксина, индуцированную введением интерлейкина-6 (ИЛ-6) THP-1 моноцитов, в меньшей степени – активность фактора некроза опухоли α (ФНО-α) и ИЛ-1а [54].
Фармакокинетика
Максимальные концентрации в плазме крови достигаются через 90 минут для стандартной таблетированной формы и около 30 минут для лекарственной формы лорноксикама рапид и его внутримышечной инъекции. Биодоступность таблетированной формы лорноксикама составляет более 90 %, выявлена линейная зависимость всасывания от дозы препарата после энтерального и внутримышечного введений. После многократного введения накопления препарата и его метаболитов не отмечается. Основным метаболитом лорноксикама является физиологически неактивный 5-гидрокси-лорноксикам. Лорноксикам метаболизируется при участии цитохрома Р450 2С9 и имеет период полувыведения в плазме от 3 до 4 часов, что гораздо меньше аналогичного периода других НВПС группы оксикамов [20]. Лорноксикам на 99 % связывается с белками плазмы, не демонстрирует влияния на активность печеночных микросомальных ферментов. Препарат выводится из организма исключительно в виде метаболитов, примерно треть обнаруживается в моче, а две трети в кале. У пожилых и больных с нарушениями функции печени и почек не обнаружено значимых изменений фармакокинетики лорноксикама, применяемого в рекомендуемых дозировках.
Клиническое применение лорноксикама НВПС относятся к группе препаратов, наиболее часто применяемых в терапии пациентов с острой или хронической болью. В клинической практике НВПС широко назначают в качестве монотерапии при слабой и умеренной боли или в комбинации с другими болеутоляющими средствами, включая опиоиды, при болях умеренной и сильной интенсивности. Эффективность лечения лорноксикамом показана в систематических обзорах и данных мета-анализа лечения пациентов с острой и хронической болью [38].
Показания к назначению лорноксикама: терапия острых болей – от легких до умеренно сильных, симптоматическая терапия ревматических заболеваний.
Лекарственные формы и дозировки
Лекарственные формы лорноксикама включают стандартные таблетки 4 и 8 мг и таблетки с быстрым всасыванием препарата (Рапид) 8 мг для приема внутрь, инъекционную форму в виде лиофилизата для приготовления раствора для внутривенного и внутримышечного введений (8 мг/фл.).
Клинические исследования
Эффективность. Послеоперационная боль. Воздействие на механизмы формирования воспалительной реакции определяет целесообразность применения НВПС больными после операций. НВПС занимают важное место в алгоритме стартовой терапии острой послеоперационной боли. Одним из подходов к терапии пациентов с острой болью (травма, ожоги, хирургическое вмешательство и др.) является назначение неопиоидных анальгетиков в качестве обезболивающих лекарственных средств «первой линии». По данным исследования PATHOS (2005), в зависимости от вида хирургических вмешательств частота применения неопиоидных анальгетиков в качестве препаратов «первой линии» составляет 64–75 % [12]. При сильном болевом синдроме НВПС назначают наряду с опиоидами в качестве «неопиоидного компонента» многомодального обезболивания. За последние 20–25 лет отмечается обоснованная тенденция к более широкому применению в анестезиологии, реаниматологии и интенсивной терапии неопиоидных анальгетиков.
Одним из представителей НВПС, эффективность и безопасность которого подтверждается данными рандомизированных, контролируемых, сравнительных исследований, является лорноксикам. В отношении пациентов с острой болью различного происхождения лорноксикам не уступает, а в отдельных исследованиях обладает преимуществами по сравнению со стандартными анальгетиками [27–29]. Доказана эффективность и безопасность применения лорноксикама в виде парентеральной формы (внутривенного введения) и лекарственных форм для приема внутрь, включая лорноксикам рапид [16].
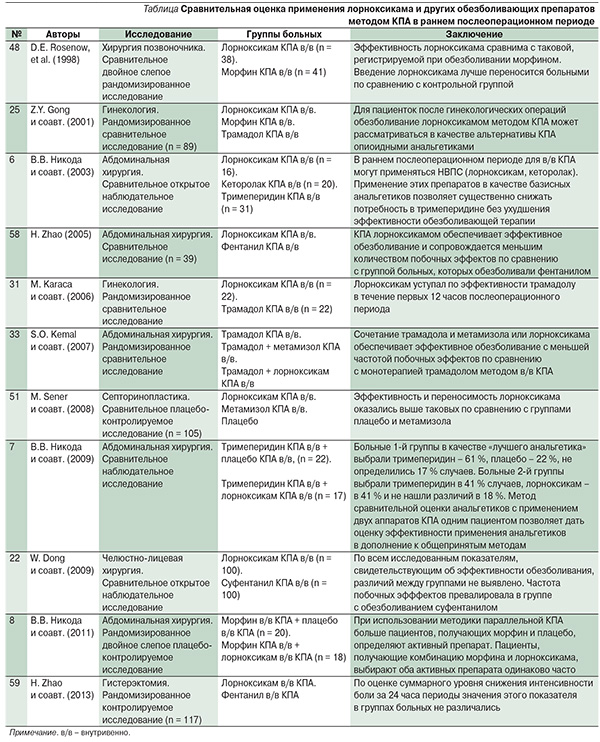
В этом разделе представлены также исследования по внутривенному применению лорноксикама методом контролируемой пациентом аналгезии (КПА). В исследованиях демонстрируется (см. таблицу), что методика КПА позволяет применять лорноксикам в отличие от многих других неопиоидных анальгетиков, включая инъекционные НВПС. В подавляющем большинстве заключений авторы указывают на эффективность и безопасность внутривенного введения лорноксикама методом КПА после различных хирургических вмешательств (гинекология, абдоминальная хирургия, челюстно-лицевая и др.). Среди всех опубликованных работ, посвященных применению лорноксикама в качестве анальгетического и противовоспалительного средства при терапии болевых синдромов, в значительной части сравнивается эффективность и безопасность применения этого препарата в послеоперационном периоде. По мнению C. Hillstrom и J.G. Jakobsson (2013), отмечается рост числа исследований, подтверждающих эффективность применения лорноксикама в терапии пациентов с острой послеоперационной болью.
В систематическим обзоре P.E. Hall и соавт. (Cochrane Database Syst Rev., 2009) представлены данные трех рандомизированных двойных слепых плацебо-контролируемых исследований эффективности применения лорноксикама при острой послеоперационной умеренной или сильной интенсивности боли после однократного приема внутрь в дозировках от 2 до 32 мг. Авторы обзора приходят к заключению, что лорноксикам обеспечивает эффективное обезболивание пациентам с острой болью умеренной и сильной интенсивности, а частота побочных эффектов не различается с группой плацебо. Лорноксикам обладает дозозависимым анальгетическим эффектом — введение 16 и 32 мг вызывали более выраженный болеутоляющий эффект по сравнению с дозировкой 4 мг.
Абдоминальная хирургия
Рандомизированные контролируемые сравнительные исследования обезболивания лорноксикамом больных после грыжесечения, лапароскопической холецистэктомии отражены в работах Kocaayan и соавт. (2007), Papadima и соавт. (2007), H.H. Mowafi и соавт. (2012) и др.
По данным H.H. Mowafi и соавт. (2012), внутривенное обезболивание на основе лорноксикама проявлялось более значимым опиоидсберегающим действием по сравнению с таковым, наблюдаемым после применения парацетамола пациентами после абдоминальных операций. У больных, которых обезболивали лорноксикамом (16 мг начальная доза, далее по 8 мг каждые 12 часов в течение двух суток), введенная в течение 24 часов доза морфина методом КПА составила 23,1 ± 6,5 мг, в группах парацетамола (1 г каждые 6 часов) и контрольной (монотерапия КПА морфином) – 28,6 ± 6,6 и 38,1 ± 6,6 мг соответственно. Изучение эффективности лорноксикама, который назначают в качестве компонента обезболивающей терапии в послеоперационном периоде, демонстрирует, что препарат обладает более выраженным анальгетическим действием по сравнению с парацетамолом и эквивалентен парекоксибу [44], трамадолу [40]. В наших исследованиях использование лорноксикама внутривенно методом КПА приводило к снижению потребления промедола в раннем послеоперационном периоде, обеспечивало хорошую эффективность обезболивания [6] (см. таблицу).
Гинекологические операции
Эффективность лорноксикама изучена в исследованиях O. Sapolya и соавт. (2007), I. Erdogan и соавт. (2007) и др.
O. Sapolya и соавт. (2007) оценивали эффективность и безопасность лорноксикама для больных после абдоминальной гистерэктомии. Препарат назначали в предоперационном периоде в дозировке 8 мг, его эффективность превышала таковую, наблюдаемую в группе плацебо.
I. Erdogan и соавт. (2007) у пациенток после миомэктомии регистрировали уровень боли по визуальной аналоговой шкале и потребление морфина. Исследуемые показатели оказались ниже в группе лорноксикама по сравнению с плацебо.
В рандомизированном проспективном исследовании H. Zhao и соавт. (2013), сравнивая эффективность обезболивания и безопасность лорноксикама и фентанила для пациенток после гистерэктомии методом КПА, демонстрируют, что в эквианальгетических дозах показатель суммарного (в течение 24 часов) снижения интенсивности боли не различался в обеих группах и составил для группы лорноксикама и фентанила 12 ± 6,1 и 10 ± 5,4 (p > 0,05) соответственно (см. таблицу).
Онкология
Лорноксикам применяется как в качестве моноаналгезии, так и в составе многомодального обезболивания. В исследованиях Осиповой и соавт. (2010) больным после торакоабдоминальных операций по поводу онкологических заболеваний авторы предложили схему на основе использования трансдермальной терапевтической системы фентанила и системного введения лорноксикама и парацетамола.
Нейрохирургия
Применению лорноксикама для обезболивания после нейрохирургических операций посвящены единичные публикации. Данные лабораторных и экспериментальных исследований свидетельствуют о наличии у препарата центрального механизма действия. После введения лорноксикама в желудочки мозга мышей отмечено снижение судорожных проявлений, вызванных фенилбензохимоном [52]. В работе I. Topcu и соавт. (2013) в экспериментальной модели на крысах введение лорноксикама уменьшало проявления отека головного мозга, вызванного его травматическим повреждением, и не оказывало влияния на проницаемость гематоэнцефалического барьера. В этом разделе уместно сообщить, что в сравнительном исследовании S. Tuncer и соавт. (2008) демонстрируется эффективность применения лорноксикама в дозе 16 мг для превентивной терапии гипералгезии, обусловленной введением ремифентанила, применявшегося при общей анестезии.
В клинической практике препарат применялся 126 больными после краниотомии. Изучалась эффективность обезболивания двух схем применения лорноксикама — «при болях по показаниям» и в виде плановых инъекций. Авторы приходят к заключению, что плановое введение с интервалом каждые 8 часов по 8 мг в течение 48 часов является более эффективной схемой терапии послеоперационной боли по сравнению с введением препарата «по требованию» [21].
Челюстно-лицевая хирургия, стоматология
После стоматологических операций A.M. Tuzuner-Oncul и соавт. (2011), F.D. Lustenberger и соавт. (2011) изучали эффективность лорноксикама, которая, по данным авторов, оказалась эквивалентной таковой, определяемой у других НВПС (диклофенака, ибупрофена).
В плацебо-контролируемом слепом исследовании N. Bölükbasi и совт. (2012) хирургической стоматологии для больных, которым устанавливали до трех имплантов в один квадрант, приходят к заключению, что лорноксикам в виде быстродействующей таблетированной формы позволяет адекватно контролировать интенсивность боли и демонстрирует высокий профиль безопасности в послеоперационном периоде.
Хирургические вмешательства в отоларингологии
В четырех исследованиях лорноксикам применяли для обезболивания после тонзилэктомии (H.A. Mowafi и соавт., 2011), септоринопластики (M. Sener и соавт., 2008) и др.
Лорноксикам 8 мг внутримышечно по обезболивающей эффективности соответствовал диклофенаку 75 мг, кетопрофену 100 мг и метамизолу 1 г, но превосходил при использовании методом КПА в дозировке 24 мг/24 ч по сравнению с метамизолом 5 г/24 ч. Лорноксикам 8 мг перорально оказался эффективнее трамадола 50 мг (см. таблицу).
Mowafi и соавт. (2011) оценивали болеутоляющий эффект 16 мг внутривенно лорноксикама по сравнению с плацебо для больных (ASA – American Society of Anaesthesiologists I–II), перенесших тонзилэктомию. Выявлено, что эффективность анальгетика в послеоперационном периоде превосходит таковую в контрольной группе (отсутствовали также различия между группами по общей кровопотере) [41].
Ортопедическая хирургия
Применение лорноксикама отражено в нескольких исследованиях Ersan и соавт. (2012), K. Koltka (2011) после операций на коленном суставе (артроскопическая менискэктомия).
В другом исследовании N. Inan и соавт. (2007) оценивали болеутоляющий эффект лорноксикама по сравнению с плацебо после тотального эндопротезирования коленного сустава. Авторы выявили, что включение лорноксикама в схему послеоперационного обезболивания сопровождалось снижением потребности в морфине.
Хирургия позвоночника
Rosenow и соавт. (1998) продемонстрировали, что внутривенная КПА лорноксикамом пациентов после ламинэктомии по эффективности не уступает морфину (см. таблицу). Профиль безопасности лорноксикама превосходил таковой, регистрируемый у больных группы морфина. Частота побочных эффектов была меньше в группе лорноксикама (22 против 38 %). O. Korkmaz Dilmen и соавт. (2010) выявили, что комбинация парацетамола 1 г и метамизола 1 г по эффективности превышает таковую лорноксикама в дозе 8 мг в отношении больных, оперированных на позвоночнике.
Обезболивание после урологических операций
Эффективность лорноксикама представлена для больных после операций по поводу варикоцеле [39] и в исследованиях, в которых препарат применяли для обезболивания при волновой литотрипсии [43]. Авторы двух исследований выявили, что лорноксикам оказался эффективнее при сравнении с плацебо и парацетамолом.
Другие хирургические вмешательства
В исследовании (M. Arslan и соавт. [2011]) больных после тиреоидэктомии при сравнении действия лорноксикама и парацетамола авторы демонстрируют, что в каждой группе половине из них обезболивания опиоидом (трамадолом) не потребовалось, а их опиоидсберегающий эффект был сравним.
Острая боль, обусловленная почечной коликой
E. Cevik и соавт. (2012), изучающие эффективность и безопасность лорноксикама, теноксикама и декскетопрофена для пациентов с острой болью, обусловленной почечной коликой, приходят к следующему заключению: внутривенные формы указанных препаратов позволили достигнуть хорошей аналгезии, тем не менее отмечено более быстрое начало действия после введения лорноксикама по сравнению с другими сравниваемыми препаратами.
Ревматология
Результаты международных и отечественных исследований по применению лорноксикама пациентами с острой и хронической болью, обусловленной воспалительными заболеваниями суставов, дегенеративно-дистрофическими заболеваниями позвоночника и при посттравматическом болевом синдроме, представлены в обзорах [3].
Сравнение лорноксикама и рофекоксиба было проведено на 2520 пациентах с обострением остеоартрита (COLOR исследование) с длительностью курса терапии в среднем 25 суток. Хотя боль при движении (-45,3 %), в покое (-42,0 %) и в ночное время (-42,5 %) снизилась в группе больных, получавших рофекоксиб, в группе пациентов, принимавших лорноксикам, уменьшение выраженности боли оказалось более значимым (-55,8, -55,8 и 59,9 % соответственно). Укорочение продолжительности утренней скованности было более выраженным (р < 0,001) при терапии лорноксикамом (-66,6 %) , чем в группе рофекоксиба (-50,2 %). Нежелательные явления были зарегистрированы у 5,4 % больных в группе лорноксикама, в то время как в группе рофекоксиба – у 12,0 % (р < 0,001). Отмечена тенденция к снижению нежелательных явлений со стороны ЖКТ при обезболивании рофекоксибом. Все показатели, характеризующие эффективность терапии, имели положительную динамику в каждой группе больных, но при обезболивании лорноксикамом эти изменения носили более выраженный характер (р < 0,001). Результаты данного исследования показывают, что лорноксикам и рофекоксиб эффективны при лечении больных остеоартритом. Анальгетический и противовоспалительный эффекты лорноксикама превышают таковые, наблюдаемые при использовании рофекоксиба при сравнимой переносимости препаратов [47].
В другом рандомизированном двойном слепом клиническом исследовании проведено сравнение лорноксикама и напроксена в терапии ревматоидного артрита (РА) по следующей схеме: лорноксикам (4 мг 3 раза в сутки и 8 мг 2 раза в сутки) и напроксен (500 мг 2 раза в сутки). В исследование были включены 225 больных, курс терапии составил 2 недели. Показатели эффективности терапии (сила сжатия кистей рук, суставной индекс Ричи) улучшились во всех группах исследования [15]. В многоцентровом двойном слепом исследовании эффективность и переносимость лорноксикама, и диклофенака также не различались [18].
Изучение целесообразности введения в воспаленный сустав НВПС и создание значительной его концентрации непосредственно в очаге поражения представляют потенциальную возможность повышения эффективности и безопасности обезболивающей многомодальной терапии. Результаты исследований демонстрируют эффективность и безопасность внутрисуставного введения лорноксикама в терапии синовитов, уменьшения болевого синдрома у больных после артроскопии коленного сустава, а также у пациентов, имеющих противопоказания к локальной терапии глюкокортикостероидами [3, 24].
Неврология
Результаты экспериментальных и клинических исследований продемонстрировали эффективность лорноксикама при ноцицептивной и невропатической боли и подробно представлены в следующих обзорах: В.В. Алексеев (2012); А.В. Авксентюк (2005); А.В. Данилов, С.Е. Гак (2011); С. Hillstrom, J.G. Jakobsson (2013).
В рандомизированном сравнительном плацебо-контролируемом исследовании W.A. Herrmann, M.S. Geertsen (2009) оценивают эффективность лорноксикама (8–24 мг/сут), диклофенака (100–150 мг/сут) при их использовании в качестве стартовой терапии больных острым пояснично-крестцовым радикулитом. Длительность курса терапии составила 5 суток. Первичной конечной точкой стал показатель различия интенсивности боли (pain intensive difference, PID) в течение 6 часов после первого применения анальгетика. Вторичные конечные точки – суммарная интенсивность боли, обезболивающий эффект после первого приема и в 1-е, 2–4-е сутки. Значительные различия в интенсивности боли зарегистрированы при сравнении лорноксикама и плацебо в интервале 3–8 часов после первого приема (0–6 часов; р = 0,015). По вторичным конечным точкам эффективность лорноксикама превышала таковую в группе плацебо. Авторы исследования приходят к такому заключению: лорноксикам и диклофенак обладают одинаковым обезболивающим действием. Частота и тяжесть побочных эффектов были сопоставимыми для всех трех групп больных (лорноксикам, диклофенак, плацебо). Переносимость оценивалась в 93 % случаев как хорошая или очень хорошая. N. Yakhno и соавт. (2006) сравнивали эффективность и безопасность применения лорноксикама рапид и диклофенака калия в терапии острой боли в поясничной области [56]. В исследование были включены 220 больных, которые в зависимости от рандомизации получали лорноксикам 24 мг в первые сутки или диклофенак 150 мг/сут. Далее терапия продолжалась в течение 5 дней: лорноксикам 8 мг 2 раза в сутки или диклофенак 50 мг 2 раза в сутки. Исследователи установили, что лорноксикам по выраженности эффекта и времени начала действия не уступает диклофенаку. Анальгетики не различались по частоте развития нежелательных явлений.
Оценка безопасности и переносимости
Частота нежелательных явлений представлена в мета-анализе J. Pleiner и соавт. (2009), в многоцентровом международном исследовании N. Rawal и соавт. [46].
В мета-анализ J. Pleiner и соавт. (2009) включено 50 клинических исследований, объединивших результаты применения лорноксикама 10 520 больными [45]. Применение лорноксикама сопровождалось более низким относительным риском развития нежелательных явлений, в т. ч. со стороны ЖКТ, чем в группах больных, которым назначали другие анальгетики. Риск возникновения любых нежелательных явлений во время терапии лорноксикамом не различался по сравнению с пациентами, принимавшими плацебо: 1,122 (0,959–1,313; p = 0,1510).
Частота нежелательных явлений, их спектр у больных различных групп, принимавших лорноксикам, стандартную терапию НВПС, или у тех больных, которым вообще не потребовались анальгетики в хирургическом стационаре «одного дня» и в последующие трое послеоперационных суток, представлена в постмаркетинговом международном наблюдательном исследовании [46]. В результате рандомизации в исследование были включены 4152 больных, в т. ч. лорноксикам применяли 1838 пациентов и 17 % больных в домашних условиях не потребовались анальгетики, остальным проведена стандартная терапия. Частота нежелательных явлений, наблюдаемых в раннем послеоперационном периоде в группе лорноксикама и в группе стандартной обезболивающей терапии, составила 27,1 и 29,4 % соответственно, а интенсивность реакций носила слабый или умеренный характер. К наиболее частым нежелательным явлениям относились нарушения со стороны ЖКТ, которые регистрировались у 19,5 и 21,3 % больных в группах лорноксикама и стандартной терапии соответственно.
Несколько ранее в двойном слепом плацебо-контролируемом исследовании 18 добровольцев получали 8 мг лорноксикама или 500 мг напроксена 2 раза в сутки в течение 7 дней. После курса терапии первым препаратом и трехнедельного перерыва назначали второй исследуемый препарат. После проведения эндоскопии оценивали вид слизистой оболочки желудка и кишечника в баллах. Лорноксикам вызывал меньше (р < 0,001) эрозий, кровотечений и раздражений слизистой оболочки желудка и луковицы двенадцатиперстной кишки по сравнению с напроксеном [10].
В ходе клинических исследований переносимость лорноксикама изучалась у 4349 пациентов [26]. Примерно у 800 из них продолжительность лечения составила 4–6 месяцев и примерно у 600 пациентов – более года. В целом побочное действие лорноксикама наблюдалось в 24,9 % случаев. В структуре побочных эффектов первое место занимают эффекты, связанные с ЖКТ (16,4 %): диспепсия, боли в животе, тошнота, рвота, диарея. На втором месте (5,1 %) – побочные эффекты со стороны центральной нервной системы: головная боль, головокружение. Нарушения функции почек и печени отмечены у 0,5 и 0,3 % пациентов соответственно. Побочные эффекты в группе больных, принимавших лорноксикам от 3 месяцев до года и более, наблюдались у 29,2 % пациентов. Частота развития реакций со стороны ЖКТ зависела от суточной дозы препарата: при приеме 8, 12 и 24 мг частота побочных эффектов составила соответственно 15,6, 19,7 и 24,4 %.
Заключение
Четверть века лорноксикам применяют в клинической практике при остром и хроническом болевом синдроме в качестве обезболивающего и противовоспалительного лекарственного средства. Согласно опубликованным данным, практика клинического применения лорноксикама расширяется, что подтверждается результатами проведенных систематических обзоров и мета-анализов. Обращает на себя внимание рост публикаций по применению лорноксикама пациентами с острой послеоперационной болью. Эффективность и переносимость лорноксикама отражены в научных исследованиях международного и национального уровней. Наряду с экспериментально-лабораторными данными в условиях клиники демонстрируется эффективность применения препарата в послеоперационном периоде, после различных по объему хирургических вмешательств, в качестве единственного анальгетика или в составе многомодального обезболивания. В исследованиях показано, что даже однократное применение препарата сопровождается положительной динамикой показателей, характеризующих эффективность изучаемого анальгетика. Анальгетическое действие лорноксикама подтверждено и в сравнительных исследованиях. Доказана более высокая эффективность лорноксикама по сравнению с плацебо и парацетамолом, а также сопоставимое обезболивающее действие регистрируется во многих исследованиях при сравнении лорноксикама и некоторых НВПС, опиоидных анальгетиков. В публикациях даны положительные результаты эффективности и переносимости лорноксикама рапид, применяемого перорально, а также путем внутрисуставного введения и методом контролируемой пациентом аналгезии.



