Согласно современной патофизиологической классификации болевых синдромов, основанной на выделении основного механизма формирования боли, невропатическая боль (НБ) по определению Международной ассоциации изучения боли (IASP – International Assosiation of Study Pain), “вызывается первичным повреждением или дисфункцией структур периферической или центральной нервных систем” [1]. Недавно Европейской ассоциацией по изучению боли предложено изменить дефиницию НБ, определив ее как “боль, вызванную повреждением структур соматосенсорной системы”. Это определение подчеркивает, что только поражение путей проведения чувствительности может приводить к формированию боли. На мировом уровне это определение пока не принято.
В основе НБ лежит патологическая активация путей проведения боли, что может быть связано с повреждением или дисфункцией нервной системы на уровне периферических нервов и задних корешков (периферическая НБ) или спинного и головного мозга (центральная НБ). Типичными примерами периферической НБ являются болевая диабетическая невропатия и боли при невромах, при поражении нервных корешков – дискогенная радикулопатия и постгерпетическая невралгия. Центральная НБ развивается при поражении спинного мозга в результате травмы или сирингомиелии, при поражении головного мозга – у больных рассеянным склерозом и после инсульта.
Распространенность НБ в странах Европы – 6–8 % в популяции. НБ ассоциирована с хроническими болевыми синдромами, женским полом, пожилым возрастом больных и невысоким социальным статусом, которые могут рассматриваться как факторы риска. При невропатическом характере болевой синдром имеет обычно высокую интенсивность, что обусловливает частое обращение больных за медицинской помощью.
Клинически НБ независимо от уровня поражения и этиологического фактора являются спонтанными или стимулозависимыми, вызываются различными стимулами в процессе повседневной жизни пациента или при его осмотре врачом. При клиническом осмотре больных, как правило, наблюдается нарушение чувствительности различной модальности в зоне болевых ощущений. Поражение соматосенсорной системы можно подтвердить с помощью различных методов электрофизиологии (электромиография, вызванные соматосенсорные потенциалы головного мозга) и психофизиологии (количественное сенсорное тестирование).
Основным механизмом развития периферической НБ являются образование новых вольтаж-зависимых натриевых каналов на мембранах аксонов, которые являются источником эктопической активности периферических нервов с развитием болевых ощущений, и возможность передачи возбуждения с одного волокна на другое (феномен эфапса).
Задние рога спинного мозга являются центром модуляции нормального болевого сигнала. В связи с этимизменения, происходящие в заднем роге в условиях патологии, во многом являются определяющими для развития НБ. Избыточная афферентация по Aδи С-волокнам приводит к повышенной возбудимости ноцицептивных нейронов заднего рога (центральная сенситизация). Одной из основных причин повышенной возбудимости ноцицептивных нейронов заднего рога является активация кальциевых вольтаж-зависимых ионных каналов. Открытие кальциевых каналов связано с повышенным синтезом и накоплением особого альфа-2-дельта (α2-δ) белка, который увеличивает их проницаемость. Этот белок является мишенью для современных препаратов лечения НБ (габапентина и прегабалина – габапентиноидов) [2].
Ощущение боли всегда субъективно, его нельзя точно измерить, и не существует абсолютных критериев, позволяющих выделить НБ. Судить о патофизиологических механизмах, лежащих в основе болевого синдрома, можно только ориентировочно, основываясь на характеристиках болевых ощущений, данных неврологического осмотра и результатах нейрофизиологического исследования. Выявление клинических признаков и изменений электрофизиологических показателей, характеризующих патологическое изменение состояния ноцицептивной системы, достоверно не доказывает наличия НБ. Она может возникать сразу после повреждения ноцицептивной системы, например при острой невропатии тонких волокон при сахарном диабете, а может развиваться через годы и даже десятилетия после повреждения, например при постинсультной боли.
Лечение НБ базируется на современных представлениях о патофизиологических механизмах ее развития. Используются фармакологические воздействия, направленные на уменьшение периферической афферентации, поддерживающей изменение возбудимости ноцицептивных структур спинного и головного мозга; препараты, уменьшающие возбудимость ноцицептивных нейронов; препараты, усиливающие супраспинальные нисходящие тормозные антиноцицептивные влияния. Возможно применение электростимуляции периферических нервов, в первую очередь проприоцептивных волокон, для усиления тормозных влияний на возбудимость ноцицептивных нейронов спинного мозга, иглорефлексотерапии. Хирургическое лечение в случаях, резистентных к фармакотерапии, включает использование вживляемых электродов в головной или спинной мозг, освобождение нерва из спаек или его декомпрессию, химическое разрушение или перерезку нерва.
Проблема лечения НБ продолжает оставаться актуальной. К 2010 г. в 66 рандомизированных двойных слепых плацебо-контролируемых работах проведено исследование эффективности лечения современными препаратами полиневропатий (в основном диабетической), в 23 контролируемых исследованиях – постгерпетической невралгии и в нескольких работах – травматического повреждения периферических нервов, центральной боли, тригеминальной невралгии, ВИЧ-невропатий и других форм НБ (всего 174 исследования). Несмотря на использование современных методов лечения, у большого процента больных не удалось добиться значительного уменьшения или прекращения болей [3].
В настоящее время ориентиром применения фармакологической терапии при НБ являются европейские рекомендации по лечению НБ, основанные на анализе базы данных контролируемых исследований начиная с 1966 по 2006 г. (табл. 1) [4].
Таблица 1. Европейские рекомендации по лечению НБ.
Введение локальных анестетиков приводит к уменьшению НБ, особенно в тех случаях, когда ее развитие обусловлено в первую очередь патологическими изменениями периферических нервов. Наиболее широко из местных анестетиков применяется лидокаин, обладающий ингибирующим действием на натриевые каналы. При накожном применении 5 %-ного лидокаина с использованием пластыря его всасывание минимально, действие на другие структуры не проявляется и, соответственно, практически нет возможных системных побочных эффектов. Оправданным является такое его использование при НБ, сопровождающейся аллодинией. Клинический эффект при внутривенном введении лидокаина в виде 5 %-ного раствора подтвержден при многих вариантах НБ. Обращает на себя внимание тот факт, что длительность периода уменьшения или исчезновения боли составляет в этом случае от одной до нескольких недель, что значительно превышает время выведения препарата. К значительным неудобствам использования внутривенного введения лидокаина для лечения НБ относится необходимость проведения лечения в условиях реанимационного отделения под постоянным мониторингом электрокардиограммы из-за возможных кардиальных побочных эффектов.
Нестероидные противовоспалительные средства, воздействующие на периферические воспалительные процессы, не используются для лечения НБ в связи с их неэффективностью. Вместе с тем их применение оправданно при комбинации ноцицептивных болей и НБ, при болях в спине, когда периферическое воспаление играет большую роль в развитии болевого синдрома.
В настоящее время при лечении НБ различной этиологии широко используются антидепрессанты. Трициклические антидепрессанты (ТЦА), в первую очередь амитриптилин, высокоэффективны при НБ. При диабетической болевой полиневропатии ТЦА более чем в 80 % случаев уменьшают боль или приводят к ее исчезновению. Основным механизмом действия ТЦА является блокирование обратного захвата норадреналина и серотонина в нервное окончание, что приводит к повышению активности центральных антиноцицептивных структур, зависящих от норадренергической и серотонинергической нейромедиации. Селективные блокаторы обратного захвата серотонина слабо уменьшают НБ и существенно уступают ТЦА. Стандартная доза амитриптилина, с которой начинают лечение, составляет 25 мг, затем дозировка может быть увеличена до 75–150 мг.
Использование ТЦА при НБ ограничено из-за многочисленных и тяжелых побочных эффектов. Ортостатическая гипотония, задержка мочи, запоры, тахикардия, “сухой синдром” могут возникать не только у пожилых людей. Наличие глаукомы и аденомы предстательной железы является противопоказанием к назначению ТЦА. Кроме того, длительное применение ТЦА увеличивает в 2,2 раза риск развития инфаркта миокарда [5].
В последнее время для лечения НБ активно применяют т. н. сбалансированные ингибиторы обратного захвата норадреналина и серотонина, имеющие меньше побочных эффектов. Препараты этой группы дулоксетин и венлафаксин применяют для лечения НБ в виде монотерапии. Вместе с тем надо отметить, что эти препараты уступают амитриптилину в снижении интенсивности НБ.
В середине 1940-х гг. появились отдельные сообщения об эффективности применения при болевых синдромах антиконвульсантов (фенитоина) – сначала при тригеминальной невралгии, а затем болевой диабетической полиневропатии. В 1962 г. для лечения невралгии тройничного нерва впервые был использован антиконвульсант карбамазепин – препарат, по своей структуре близкий к ТЦА. В дальнейшем карбамазепин был с успехом использован и при других вариантах НБ. Считается, что наиболее хорошо фенитоин и карбамазепин уменьшают интенсивность пароксизмальных и стреляющих болей. Основным механизмом действия фенитоина и карбамазепина является блокирование вольтаж-зависимых натриевых каналов. Серьезным недостатком этих препаратов являются побочные эффекты, к которым относятся гепато- и панкреотоксичность, а также действие на систему кроветворения – развитие анемии [6].
В 1990-е гг. изучали механизмы действия и оценивали клиническую эффективность нового поколения антиконвульсантов (габапентиноиды – габапентин и прегабалин) при лечении НБ. Наиболее большой клинический опыт был накоплен для препаратов габапентина – вещества, по своей структуре близкого к γ-аминомас-ляной кислоте (ГАМК). Было показано, что препарат не взаимодействует с рецепторами к ГАМК, а уменьшает сенситизацию центральных ноцицепторов в основном за счет связывания с α2-δ-субъединицей потенциал-зависимых кальциевых каналов мембраны ноцицептивных нейронов. Это приводит к блокированию проведения через каналы ионов кальция, уменьшению возбудимости нейронов и уменьшению боли [7]. Кроме того, габапентин обладает блокирующим действием на натриевые каналы и дополнительно имеет стимулирующее влияние на синтез и выделение ГАМК [8].
Результаты экспериментальных исследований также свидетельствуют об ингибирующем эффекте габапентина на выделение специфического альгогена – субстанции Р из тонковолоконных первичных афферентов [9]. Побочных эффектов у габапентина немного, и, как было показано в исследовании с участием 2216 пациентов, к основным относятся сонливость (15,2 %), головокружение (10,9 %), атаксия (6,0 %). Однако тяжесть побочных эффектов была незначительной, а их длительность не превышала 2–3 недель даже при продолжении приема препарата [10]. Препарат не метаболизируется в печени и выводится в виде целой молекулы через почки, поэтому он не взаимодействует с другими препаратами, но должен с осторожностью использоваться больными с нарушением функции почек.
В клинике Мейо было проведено детальное исследование, включившее 729 пациентов с поражением почек, которые получали габапентин. Результаты исследования показали, что токсичность габапентина (избыточное накопление вещества в крови) обнаружена только у 5,6 % пациентов с выраженным нарушением фильтрационной способности почек и у 77,8 % пациентов, находившихся на диализе, причем клинически повышение концентрации препарата проявлялось редко [11]. Таким образом, габапентин можно назначать больным с поражением почек, но при этом необходимо использовать меньшие дозы и по возможности контролировать его содержание в крови.
Для уменьшения частоты и выраженности побочных эффектов используют систему титрования дозы препарата. Прием габапентина начинают с дозы 300 мг/сут (на ночь), затем дозу увеличивают до 600 мг (дважды в сутки днем и вечером по 300 мг), и наконец дозу увеличивают до 300 мг 3 раза в сутки. На фоне приема 900 мг/сут анализируют динамику болевого синдрома и в отсутствие эффекта дозу повышают до 1800 мг/сут (увеличивая по 300 мг/сут). Максимальные дозы габапентина в некоторых исследованиях, при которых достигали эффекта при лечении НБ, составляли 2700 или 3600 мг. При этом большинство исследователей отмечали уменьшение болевого синдрома при различных вариантах НБ уже на первой неделе лечения габапентином. Препарат имеет высокую биодоступность (более 60 %), его концентрация в плазме достигает максимума через 2–3 часа после приема и прием пищи не влияет на фармакодинамику габапентина.
В последние годы наиболее широко применяют препарат Габагамма (“Верваг Фарма”, Германия). Антиконвульсанты последнего поколения обладают широким спектром действия, что обеспе чивает их эффективность при НБ. Эффективность габапентина показана в двойных слепых плацебо-контролируемых исследованиях при лечении НБ у больных диабетической полиневропатией [12], постгерпетической невралгией [13], тригеминальной невралгией [14], рассеянным склерозом [15]. В этих исследованиях габапентин назначали мужчинам и женщинам в возрасте от 20 до 90 лет при широком спектре синдромов НБ, об условленных заболеваниями периферической и центральной нервных систем. Препарат показал свою эффективность и хорошую переносимость при минимальном числе побочных эффектов.
В рандомизированном двойном слепом плацебо-контролируемом исследовании анализировали эффективность лечения НБ при диабетической полиневропатии габапентином (84 пациента) по сравнению с плацебо (81 пациент) [16]. В исследование были включены амбулаторные больные из 20 медицинских центров. Препарат или плацебо применяли в течение 8 недель. Титрование препарата осуществлялось в течение 4 недель (1-я неделя – 900 мг/сут, 2-я – 1800, 3-я – 2400 и 4-я – 3600 мг/сут), причем ограничение дозы зависело только от побочных эффектов, но не от исчезновения боли. Интенсивность боли оценивали по визуально-аналоговой шкале (ВАШ). Уже через 2 недели отмечено достоверное различие в интенсивности боли между группами, а через 8 дней в группе габапентина боль уменьшалась с 6,4 до 3,9 см по ВАШ, в то время как в группе плацебо – с 6,5 до 5,1см (p < 0,001, см. рисунок).
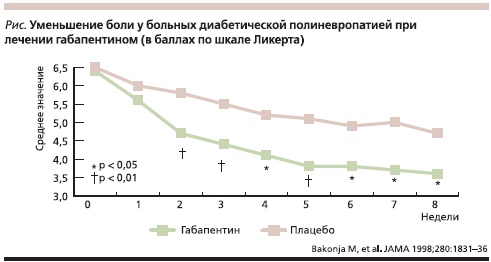
В другом двойном слепом плацебо-контролируемом исследовании по изучению эффективности габапентина при болевой диабетической полиневропатии были использованы меньшие дозы препарата – 1200 мг, но на протяжении 3 месяцев [17]. Из 17 пациентов с болевой формой диабетической полиневропатии боль по интенсивности значительно уменьшилась у 14 (82,4%) человек, а при использовании плацебо – только у 2 (13,3 %) из 15 пациентов (p < 0,001).
В рандомизированном двойном слепом плацебо-контролируемом исследовании в 16 центрах США изучали эффективность габапентина при постгерпетической невралгии у 225 пациентов: 109 больных получали габапентин и 116 – плацебо в течение 8 недель. Максимальная доза габапентина составила 3600 мг [18]. Показана достоверно более высокая эффективность габапентина по сравнению с плацебо (p < 0,01). В 2002 г. изучалась эффективность габапентина при постампутационной фантомной боли у 19 больных в рамках контролируемого исследования. Было показано, что 6-недельный прием препарата в дозе 2400 мг статистически достоверно уменьшал выраженность болевого синдрома по сравнению с плацебо [19].
Препарат Габагамма имеет ряд особенностей, которые позволяют выделить его среди других препаратов габапенина в России. Это наличие дозировки 400 мг, которая позволяет более гибко дозировать препарат, особенно в первые дни применения. Например, используя стандартную схему титрования, но применяя таблетированную форму 400 мг, можно более эффективно купировать болевой синдром у пациентов с избыточной массой тела, которым дозировки 300 мг порой бывает недостаточно (табл. 2).
Таблица 2. Стандартная схема титрования препарата Габагамма для пациентов с избыточной массой тела.
Также, комбинируя дозировки 300 и 400 мг в первые дни лечения, возможно полностью избежать возникновение такого побочного эффекта, как повышенная сонливость. Для этого необходимо назначать 400 мг на ночь (вместо 600 мг), а впоследствии – 800 мг. Дозировка 600 мг на ночь в первые дни приема препарата может вызывать сонливость в утренние часы, а 300 мг – недостаточно для купирования болевого синдрома (табл. 3).
Таблица 3. Схема титрования препарата Габагамма для пациентов с избыточной сонливостью.
Появление препарата Габагамма позволило значительно повысить возможности врачей при лечении синдрома НБ, что связано с быстрым купированием болей у большинства больных, отсутствием значительных побочных явлений, а также возможностью при необходимости принимать габапентин длительное время. Интересно, что в последние годы исследуется эффективность лечения препаратом Габагамма (габапентин) самых различных неврологических заболеваний помимо эпилепсии и классических вариантов НБ. Есть сообщения об эффективном применении габапентина (Габагамма) при послеоперационных болях [20], что уменьшает потребность в опиатах [21], при радикулярных болях у лиц с патологией межпозвонковых дисков и стенозом позвоночного канала [22]. Габагамма (габапентин) как лекарственное средство переживает пору расцвета, и его потенциал в лечении различных вариантов НБ раскрыт не до конца.
Информация об авторах:
Строков Игорь Алексеевич – доцент кафедры нервных болезней ГОУ ВПО “Первый МГМУ им. И.М. Сеченова”
Минздравсоцразвития РФ, отделение боли и заболеваний периферической нервной системы.
E-mail: strigoral@mail.ru;
Проноза Вадим Викторович – аспирант кафедры нервных болезней ГОУ ВПО “Первый МГМУ
им. И.М. Сеченова” Минздравсоцразвития РФ.



