Введение
Грыжа межпозвонкового диска (ГМПД) – распространенное заболевание, являющееся причиной боли в спине и корешкового синдрома, приводящее к значимому ограничению физической активности, выработке болевого стереотипа поведения, что в свою очередь способствует развитию депрессивного синдрома и снижению качества жизни; по оценкам, ежегодно от данного заболевания страдают до 5% взрослого населения [1]. Впервые корешковый синдром бы описан W.E. Dandy в 1929 г. как клинический синдром, связанный с экстрадуральным образованием [2]; к основным факторам, способствующим развитию радикулопатии, относят воспаление нервного корешка и ткани МПД. Mixter и Barr впервые разработали хирургический подход к лечению ГМПД на уровне поясничного отдела в 1934 г.; с тех пор различные хирургические вмешательства по удалению ГМПД для лечения стойкого болевого синдрома были выполнены массе пациентов. Однако в большинстве случаев устранение болевого синдрома при ГМПД возможно с помощью консервативного лечения. Чаще всего назначают традиционные нестероидные противовоспалительные препараты (НПВП), иногда в сочетании с миорелаксантами и/или слабыми опиоидами [3, 4]. Сообщается об эффективности габапентина в отношении нейропатической боли [5, 6], включая удовлетворительные результаты клинических исследований эффективности этого препарата для пациентов со стенозом позвоночного канала и/или ГМПД [7, 8]. В некоторых случаях описывается спонтанный регресс ГМПД.
Предполагается, что спонтанный регресс ГМПД поясничного отдела позвоночника связан с воспалительной реакцией с участием макрофагов и молекулярных механизмов фагоцитоза [9]. В научной литературе описано значительное количество случаев регресса больших ГМПД без хирургического вмешательства [10].
В данной статье мы представляем клиническое наблюдение трех пациентов, у которых наблюдался спонтанный регресс ГМПД поясничного отдела позвоночника на фоне физио- и медикаментозной терапии габапентином.
Клинический пример № 1
Пациентка Щ. 41 года обратилась c жалобами на выраженный болевой синдром в поясничной области (5–6 баллов по визуальной аналоговой шкале – ВАШ) с иррадиацией в правую ногу, онемение большого пальца правой ноги. Из анамнеза известно, что боль в пояснице беспокоит в течение 3 лет. Лечилась амбулаторно 2 раза (НПВП, витамины группы В) с положительным эффектом. Настоящее обострение возникло после длительного нахождения за рулем автомобиля. Боль в пояснице усилилась и стала постоянной. Покой и обезболивающие средства (анальгин, баралгин) облегчения не приносили.
Неврологический статус: положение тела вынужденное с наклоном влево и вперед, движения в поясничном отделе резко ограничены во все стороны. Определяется болезненность при пальпации остистых отростков и паравертебральных точек L5–S1. Сухожильные рефлексы с рук равны, с ног S >D. Гипестезия по дерматому L5–S1, гипотония и гипотрофия икроножных мышц справа. Симптомы Ласега, Дежерина, Нери резко положительные.
При проведении магнитно-резонансной томографии (МРТ) пояснично-крестцового отдела позвоночника (21.06.2016) выявлена дорзальная правосторонняя медиально-парамедиальная грыжа диска L5/S1 сагиттальным размером до 1,3 см на уровне МПД, дефект фиброзного кольца, через который распространяется секвестрированный фрагмент МПД (размером до 1,1×0,9 см в аксиальной плоскости), сужение позвоночного канала до 8,0 мм (рис. 1).
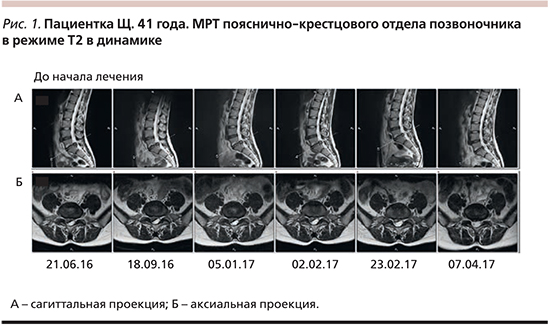
Пациентка прошла 10 физиотерапевтических процедур (иглорефлексо- и лазеротерапия в проекции ГМПД). В качестве обезболивающей терапии получала габапентин в дозе 900 мг (300 мг 3 раза в сутки; 20 дней), комплекс витаминов группы В (таблетированная форма).
После проведенного лечения болевой синдром полностью регрессировал, что позволило в течение 5 дней постепенно снизить, а затем и отменить габапентин. Онемение большого пальца сохранялось.
При повторных МРТ (18.09.2016, 05.01.2017) не было выявлено существенной динамики в отношении размеров и сигнальных характеристик грыжи и мигрировавшего компонента. В неврологическом статусе сохранялись снижение сухожильных рефлексов справа, гиперстезия по дерматому L4–L5, гипотония и гипотрофия икроножных мышц справа. Симптомы натяжения и болезненность при пальпации остистых отростков менее выражены.
В последующем пациентке выполнен аналогичный комплекс физиотерапевтических процедур: 1 раз в неделю в течение 5 недель. В этот период у нее не было обострений и потери трудоспособности.
При МРТ от 02.02.2017 обнаружено значительное уменьшение секвестрированного компонента. К этому периоду онемение большого пальца полностью отсутствовало.
Последующие МРТ (23.02 и 07.04.2017) показали значительное уменьшение размеров ГМПД. Неврологический статус в норме.
Клинический пример № 2
Пациент А. 39 лет обратился с жалобами на выраженную боль (8–9 баллов по ВАШ) в пояснично-крестцовом отделе позвоночника, боль и онемение левой ноги. Боль усиливалась в ночное время, при ходьбе (мог пройти не более 100 метров). Из анамнеза известно, что неделю назад после физической нагрузки возник приступ интенсивных болей с иррадиацией по боковой поверхности левой нижней конечности по типу «лампасных болей». Неврологический статус: анталгическая поза (наклон вперед и вправо), резкое ограничение движений поясничного отдела позвоночника, напряжение паравертебральных мышц спины, правосторонний ишиалгический сколиоз, сглажен поясничный лордоз. Болезненность при пальпации остистых отростков и паравертебральных точек на уровне L4–L5. Отсутствие ахиллова рефлекса слева. Симптом Лассега положительный, угол – 15 градусов, положительный симптом «посадки», симптом Сообразе, симптом Ларрея. Чувствительных расстройств и парезов нет, тазовые функции не нарушены.
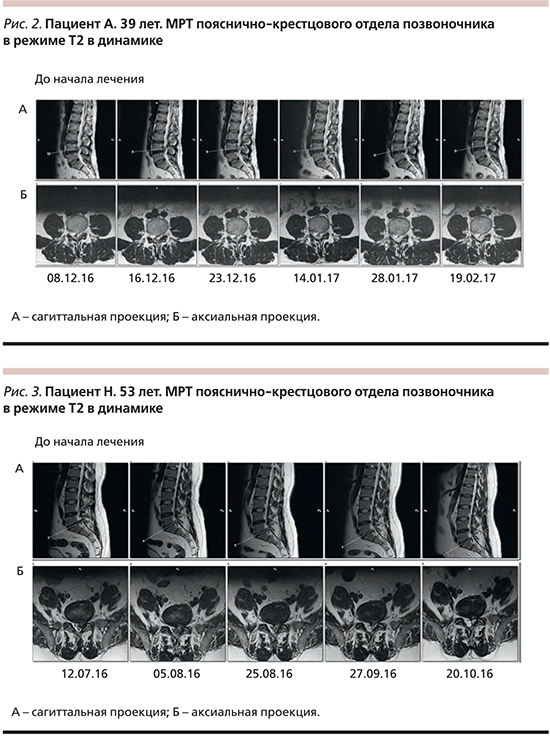
По данным МРТ (08.12.2016), у пациента выявлена дорзальная медиальная грыжа диска L4/L5 сагиттальным размером до 0,8 см на уровне МПД. По верхнему контуру грыжи определяется дефект фиброзного кольца, через который распространяется вещество МПД (размером до 3,0×1,1 см в аксиальной плоскости). Позвоночный канал на этом уровне сужен до 6 мм в передне-заднем направлении (рис. 2).
Пациент прошел 10 физиотерапевтических процедур (иглорефлексо- и лазеротерапия в проекции ГМПД). В качестве обезболивающей терапии получал габапентин 1200 мг (300 мг 4 раза в сутки; 30 дней), комплекс витаминов группы В (таблетированная форма), а также амитриптилин 25 мг (1 раз в сутки перед сном, 10 дней).
В процессе лечения и наблюдения (16 и 23.12.2016, 14.01.2017) выполнены исследования МРТ, на которых обнаружили усиление МР-сигнала на Т2 ВИ от МПД и секвестрирующегося фрагмента, что могло быть признаком усиления воспалительного процесса. В то же время с 12.01.2017 пациент не получал обезболивающей терапии ввиду отсутствия болевого синдрома. Сохранялись жалобы на скованность в пояснично-крестцовом отделе позвоночника при ходьбе. В неврологическом статусе отмечена положительная динамика в виде незначительного восстановления ахиллового рефлекса слева. Симптомы натяжения и болезненность при пальпации остистых отростков были менее выражены. Обострений и потери трудоспособности пациента в тот период не наблюдалось.
Повторный курс физиотерапии был назначен с 13.01.2017: 1 раз в неделю в течение 5 недель. По данным МРТ (28.01.2017), уменьшение мигрировавшего компонента. На момент снимка жалобы отсутствовали, а через месяц (19.02.2017) – полный регресс грыжи и секвестрированного фрагмента.
Клинический пример № 3
Пациент Н. 53 лет обратился с жалобами на боль в пояснично-крестцовом отделе позвоночника (7–8 баллов по ВАШ) с иррадиацией в левую ногу, чувство онемения по ходу корешка S1. Из анамнеза известно, что периодические боли отмечались в течение последних 5 лет, купировались медикаментозно. Настоящее обострение возникло после интенсивной физической нагрузки, прием НПВП облегчения не приносил. В неврологическом статусе: походка щадящая, движения в поясничном отделе резко ограничены во все стороны. Определялась болезненность при пальпации остистых отростков и паравертебральных точек L5–S1 с обеих сторон. Сухожильные рефлексы с рук и ног S=D. Симптомы Ларрея, Фолькманна–Эриксена резко положительные.
При проведении МРТ (12.07.2016) выявлена дорзальная левосторонняя медиально-парамедиальная грыжа диска L5/S1 сагиттальным размером до 1,4 см с тенденцией к секвестрации, распространяющаяся в левое межпозвонковое отверстие. По заднему контуру грыжевого выпячивания визуализируется дефект фиброзного кольца. Грыжа частично компримирует дуральный мешок и левый нервный корешок (рис. 3).
Пациент прошел 10-дневный курс физиотерапии (акупунктура, лазеротерапия), а также медикаментозной терапии: габапентин 900 мг (300 мг 3 раза в сутки, 17 дней), комплекс витаминов группы В (таблетированная форма). После проведенного курса лечения жалобы на болевой синдром и онемение отсутствовали. В неврологическом статусе отмечена положительная динамика в виде купирования анталгической позы, увеличения объема движений в поясничном отделе, купирования симптома Ларрея. Симптом Фолькманна–Эриксена сохранялся, наблюдалась незначительная болезненная пальпация остистых отростков на уровне L4–L5.
При проведении повторной МРТ (05.08.2016) отмечено увеличение вертикального размера грыжевого выпячивания до 1,55 см (ранее 0,84 см) и изменение его сигнальных характеристик за счет приобретения более гиперинтенсивного МР-сигнала на Т2 ВИ (косвенные признаки усиления воспалительного процесса).
Следующим этапом лечения было повторное прохождение физиотерапевтических процедур 1 раз в неделю (5 раз).
Последующие МРТ (25.08, 27.09 и 20.10.2016) показали последовательное уменьшение грыжевого выпячивания и секвестрирующегося фрагмента до 0,75 см в сагиттальном размере и до 0,6 см в вертикальном направлении.
Обсуждение
В научной литературе описаны случаи спонтанного регресса ГМПД без хирургического вмешательства, однако точный механизм этого феномена неизвестен. Впервые возможность спонтанного регресса грыжи была предположена F.C. Jr Guintaet и соавт. в 1980 г. [11]. В большинстве случаев он наблюдается в течение первого года заболевания, по некоторым данным, может происходить в первые 2–3 месяца [10, 12].
Возможные механизмы спонтанного регресса грыжи диска
Существует несколько гипотез, позволяющих объяснить механизм спонтанного регресса ГМПД. Первая из них предполагает, что дегидратация студенистого ядра приводит к механической ретракции экструдированных тканей в пределы фиброзного кольца, что приводит к спонтанному регрессу грыжи. Вторая гипотеза подразумевает, что МПД с грыжей может подвергаться ретракции обратно в занимаемое им в норме пространство, однако теоретически это может происходить при протрузии диска через фиброзное кольцо без отделения от него [1]. Третий механизм предполагает ферментативное разрушение и фагоцитоз хрящевой ткани в результате воспалительной реакции и неоваскуляризации грыжи диска [9]. Как только студенистое ядро разрушается и вступает в контакт с эпидуральным сосудистым пространством, его ткани распознаются как инородное тело и становятся мишенью аутоиммунной воспалительной реакции, что приводит к неоваскуляризации, ферментативному разрушению и фагоцитозу макрофагами. С другой стороны, образование матриксных протеиназ и повышенный уровень цитокинов также играют роль в процессе спонтанного регресса [13].
Механизм действия габапентина
Габапентин – противосудорожный и обезболивающий препарат, аналог нейротрансмиттера гамма-аминомасляной кислоты, все шире применяется для лечения нейропатической боли. Однако характер его действия остается малоизученным [8]. В качестве одного из механизмов действия предполагают связывание с α2δ-субъединицей потенциалзависимого кальциевого канала, которая активно экспрессируется в ганглиях дорсальных корешков [7]. Другой механизм, объясняющий эффект габапентина в отношении снижения стойкого тока натрия, также включает нейроны ганглиев дорсальных корешков [8]. Габапентин продемонстрировал эффективность в отношении уменьшения болевого синдрома, вызванного стенозом позвоночного канала и интраспинальными ГМПД. Препарат также оказывает положительный эффект при остром корешковом синдроме [7].
Также некоторые исследователи отмечали незначительные противовоспалительные свойства габапентина. B.S. Lee и соавт. (2013) продемонстрировали, что габапентин снижает уровень провоспалительных медиаторов (например, фактора некроза опухоли-α, интелейкина-1b и -6), а также повышает уровень противовоспалительного интерлейкина-10 в модели нейропатической боли крыс [14]. В дальнейшем J.M. Dias и соавт. (2014) показали, что габапентин вызывает уменьшение воспалительных реакций в известных моделях воспалительных процессов у мышей [15]. Пока не ясно, связан ли противовоспалительный эффект габапентина с регуляцией кальциевого тока или с другими механизмами (стимуляция эндогенных антиоксидантных систем, подавление NF-κB, блокада NMDA-рецепторов, активация аденозинового А1-рецептора [14–16].
В настоящее время иммуновоспалительная теория резорбции грыжи находит все большее подтверждение в исследованиях, и в этом свете габапентин может стать хорошей лечебной альтернативой, с одной стороны, с точки зрения купирования болевого синдрома, с другой – из-за отсутствия у него прямого противовоспалительного действия, которое теоретически может снижать скорость резорбции грыжи. Таким образом, предполагается, что медикаментозное лечение ГМПД поясничного отдела позвоночника с использованием габапентина в сочетании с физиотерапией может обеспечивать как клиническое улучшение, так и их спонтанный регресс.



