Введение
Микро-РНК являются посттранскрипционным регулятором, ингибирующим продукцию конкретных белков. Микро-РНК регулируют экспрессию примерно 1/3 генома и вызывают изменения в основных сигнальных путях и в метаболизме [1].
В настоящее время определено более 2500 микро-РНК, участвующих в регуляции около трети генома человека. Это обусловлено, с одной стороны, дисрегуляцией клеточной экспрессии микро-РНК, наблюдаемой при многих патологических состояниях, характеризующихся увеличением или уменьшением экспрессии, с другой – способностью клетки секретировать или высвобождать некоторые из микро-РНК во внеклеточную среду. Это объясняет их присутствие в биологических жидкостях и позволяет предположить, что циркулирующие микро-РНК могут представлять интерес как неинвазивные биомаркеры [2]. С точки зрения практического клинического использования важно, что циркулирующие микро-РНК очень стабильны и устойчивы к различным повреждающим факторам, что делает их перспективным маркером [3].
В нефрологии активно проводятся исследования паттернов экспрессии микро-РНК у пациентов с острым повреждением почек, хронической болезнью почек (ХБП), гломерулонефритом, острым отторжением трансплантата почки [4]. Гораздо реже исследуются профили эскпрессии микро-РНК в популяции диализных пациентов [5].
Роль микро-РНК в развитии минерально-костных нарушений остается малоизученной темой, особенно в популяции пациентов на программном диализе. В настоящее время нет сведений о сравнительных исследованиях профиля микро-РНК с такими важными параметрами минерально-костных нарушений при хронической болезни почек (ХБП-МКН), как фактор роста фибробластов-23 (FGF-23 – fibroblast growth factor-23), паратиреоидный гормон (ПТГ), у пациентов на диализе. Изучение параметров экспрессии микро-РНК позволит определить их потенциальную роль как биомаркеров ХБП-МКН.
Цель исследования: оценить ассоциации между уровнями микро-РНК-21, -126 и -210 в сыворотке крови с показателями костно-минерального обмена у пациентов на заместительной почечной терапии гемо- и перитонеальным диализом.
Материал и методы
Были обследованы 55 пациентов, из которых 33 получали терапию программным гемодиализом (ГД) – 1-я группа, 22 – перитонеальным диализом (ПД) – 2-я группа. Группу контроля (3-я группа) составили 28 здоровых добровольцев. Всем пациентам определяли уровень экспрессии микро-РНК-21, -126 и -210 методом полимеразной цепной реакции в реальном времени (ПЦР-РВ). Критериями невключения в исследование были возраст младше 18 или старше 70 лет, сосудистый доступ для ГД посредством перманентного катетера, сосудистого протеза, а также пациенты с тяжелыми сопутствовавшими заболеваниями (злокачественные новообразования, болезни системы крови), предшествовавшая трансплантация почки, наличие активного инфекционного процесса, низкая приверженность лечению.
Были изучены стандартные клинико-анамнестические сведения обо всех пациентах: возраст, стаж на диализе, систолическое и диастолическое давление, рост, масса тела до процедуры диализа, параметры адекватности диализа.
Забор крови был осуществлен перед началом процедуры диализа – до подключения к диализному контуру.
Все биохимические параметры определяли на автоматическом биохимическом анализаторе.
Молекулярно-генетические исследования проводили в клинической лаборатории на базе кафедры клинической лабораторной диагностики с курсом молекулярной медицины ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова. Для выделения микро-РНК использовали сыворотку крови. Микро-РНК выделяли с использованием набора miRNeasy Mini Kit (QIAGEN, США). Концентрацию водного раствора микро-РНК определяли на спектрофотометре Nanodrop 1000 (Thermo Scientific, США). Обратная транскрипция проводилась с использованием набора реагентов для обратной транскрипции микро-РНК TaqMan. ПЦР-РВ проводили с использованием набора для определения экспрессии микро-РНК-21, -126 и -210 производства Applied Biosystems (США) TaqMan® GeneExpressionAssays.
Статистический анализ результатов выполняли с использованием пакета прикладных статистических программ «Statisticav 12.0 («StatSoftInc», США). Результаты представлены как медиана [нижний – верхний квартиль]. Для попарного сравнения использовали критерий Манна–Уитни для связанных групп, для оценки силы связи между изучаемыми переменными – коэффициент ранговой корреляции Спирмена. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при p<0,05.
Результаты
В табл. 1 представлена общая характеристика обследуемых пациентов.
Уровень экспрессии микро-РНК-21 и -210 достоверно различался в группах пациентов на ГД и контроля. Также было выявлено достоверное различие микро-РНК-210 по сравнению с пациентами на ГД и в группе контроля (-) (табл. 2). Каких-либо межгрупповых различий между ГД и ПД по уровням экспрессии всех изученных микро-РНК установлено не было. В связи с этим для дальнейшей статистической обработки использовали объединенную группу, включившую пациентов как на ГД, так и на ПД.
У пациентов на ГД концентрация FGF-23 в сыворотке крови превышала таковую у лиц, находившихся на ПД (табл. 3).
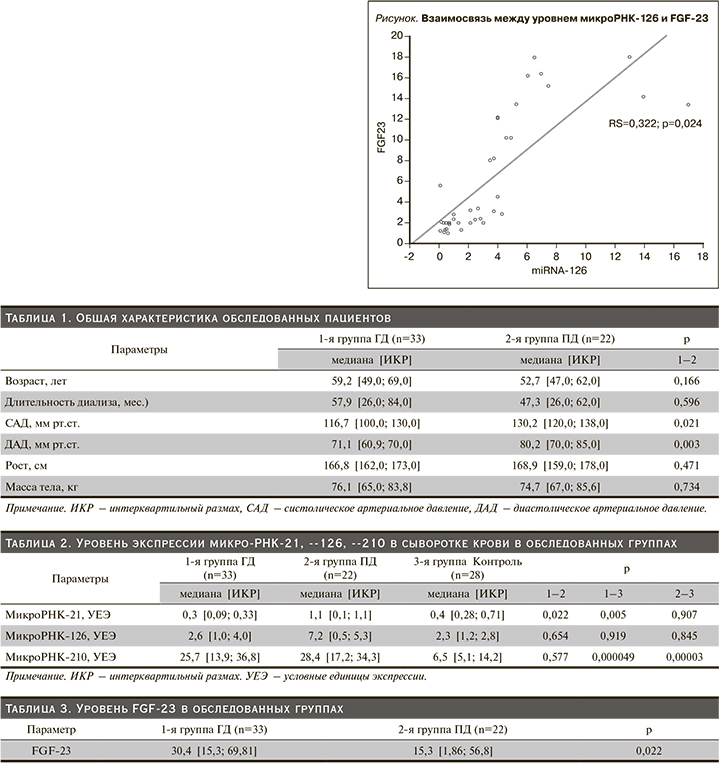
У находившихся на ГД пациентов увеличение концентрации FGF-23 в сыворотке крови коррелировало с продолжительностью пребывания на диализе (rs=0,587; p=0,002). Выявлена прямая корреляция между концентрациями в сыворотке крови FGF-23 и неорганического фосфора (rs=0,4; p=0,01). Выявлена прямая корреляция между концентрациями в сыворотке крови микро-РНК-126 и неорганического фосфора (rs=0,324; p=0,003). Выявлена прямая связь между концентрациями в сыворотке крови микро-РНК-126 и уровнем FGF-23 (см. рисунок).
Уровень FGF-23 в сыворотке крови прямо коррелировал с содержанием ПТГ (rs=0,5; p=0,01). Выявлена прямая связь между концентрациями в сыворотке крови микро-РНК-126 и -210 и уровнем FGF-23. В группе больных, получавших севеламера карбонат, отмечены более низкие уровни FGF-23 (12,4±5,9) в отличие от группы, не получавшей данный препарат (23±7,3; p=0,003) и ПТГ (110±27 нг/мл), и в группе, не получавшей севеламер (340±15; p=0,01). У пациентов, получавших севеламер, отмечены более низкие уровни микро-РНК-126 (p=0,002).
Обсуждение
ХБП-МКН способствует развитию вторичного гиперпаратиреоза, заболеваний кости и ведет к повышению кардиоваскулярной заболеваемости и летальности [6].
Недавние исследования показали дисрегуляцию ряда микро-РНК у пациентов при МКН [7–12]. V.M.-L. Meuth et al. показали, что уровни экспрессии микро-РНК-126 коррелировали с циркулировавшими уремическими токсинами при ХБП, с уровнем неорганического фосфора, игравшего важную роль в процессе сосудистой кальцификации [13]. Мы обнаружили, что уровень неорганического фосфора прямо коррелировал с уровнем микро-РНК-126 и -210. Гиперфосфатемия – один из основных факторов развития ХБП-МКН и высокого риска кардиоваскулярных заболеваний. Не содержащие кальция фосфат-связывающие препараты, в частности такие как комплекс оксигидроксида железа и севеламера карбонат, известны своим действием относительно снижения риска развития неблагоприятных, в т.ч. фатальных, кардиоваскулярных исходов, снижения уровня FGF-23 [14].
Микро-РНК-126 участвует в фенотипическом переключении, которое направляет эндотелиальную клетку и, следовательно, всю интиму сосудов в дисрегулируемое состояние, называемое эндотелиальной дисфункцией [15].
В экспериментальной модели ХБП на мышах in vivo выявлено, что экспрессия микро-РНК-126 увеличивается в аортах мышей с ХБП и/или атеросклерозом. Фосфат-связывающий препарат севеламер в данном эксперименте частично корректировал эти изменения в экспрессии микро-РНК, указывая на прямую связь между наблюдаемыми изменениями микро-РНК и уремической сосудистой токсичностью. В данной модели также изучали экспрессию эндотелиально-специфических микро-РНК в церебральных микрососудах. Обнаружено, что микро-РНК-126 является одной из микро-РНК с наиболее серьезно нарушенной регуляцией, что позволяет предположить, что это потенциальный новый биомаркер церебральных нарушений у пациентов с ХБП [16].
В исследовании T. Celic [17] в экспериментальной модели было также показано влияние севеламера на экспрессию микро-РНК. Известно, что фосфат-связывающий препарат, севеламера карбонат, обладает плейотропными эффектами на параметры, связанные с сердечно-сосудистым риском: улучшение эндотелиальной и/или сосудистой функции, замедление сосудистой кальцификации, снижение уровня FGF-23, уменьшение числа провоспалительных и окислительных молекул [18–20].
Выявлено, что севеламера карбонат способен корректировать экспрессию некоторых микро-РНК. В частности, исследовались паттерны экспрессии микро-РНК-126 и -223, которые значимо уменьшались при лечении севеламером в течение 8 недель в экспериментальной мышиной модели по ХБП [17].
Данные литературы согласуются с нашими результатами.
У пациентов, получавших севеламера карбонат, отмечены более низкие уровни микро-РНК-126. Также нами выявлено, что в группе больных, получавших севеламера карбонат, отмечены более низкие уровни FGF-23 и ПТГ.
При ХБП уровень FGF-23 прямо коррелирует с таковым ПТГ в отличие от нормы, когда имеется обратная зависимость, т.к. FGF-23 супрессирует синтез и экскрецию ПТГ, что и было продемонстрировано в нашем исследовании [21].
В исследовании C.-T. Lee, где определяли экспрессию микро-РНК-29,- 223, -9 и -21, не было выявлено корреляции между уровнем вышеназванных микро-РНК и FGF-23. Однако была сильная корреляция между уровнем FGF-23 и выраженностью сосудистой кальцификации [22].
В нашем исследовании была выявлена значимая прямая корреляция между микро-РНК-126 и FGF-23. Уровень FGF-23 был достоверно выше у пациентов, находившихся на заместительной почечной терапии ГД, чем в группе пациентов на ПД. Данный факт может быть объяснен большим стажем пациентов на терапии диализом, т.к. сравнивая продолжительность заместительной почечной терапии и уровень FGF-23, была также получена прямая зависимость. Нельзя исключать и сохранение остаточной функции почек у пациентов на ПД.
Заключение
Таким образом, на основании полученных данных можно констатировать, что более высокий уровень экспрессии микро-РНК-126 ассоциируется с более высокими значениями уровня неорганического фосфата, а также FGF-23.
У находившихся на программном ГД пациентов увеличение концентрации FGF-23 в сыворотке крови коррелировало с продолжительностью пребывания на диализе.
Выявлена прямая корреляция между концентрациями в сыворотке крови FGF-23, ПТГ и неорганического фосфора.
В группе больных, получавших севеламера карбонат, отмечены более низкие уровни FGF-23 и ПТГ, а также микро-РНК-126.



