Введение
Акромегалия является тяжелым нейроэндокринным заболеванием, приводящим (в отсутствие адекватного лечения) к ранней инвалидизации и преждевременной смерти. Несмотря на постоянное совершенствование методов лечения, смертность больных акромегалией в 2–4 раза превышает данный показатель в популяции [1, 2]. Для систематизации и постоянного мониторинга эпидемиологических, демографических и клинических данных с целью определения наиболее эффективных способов выявления и лечения гормональноактивных аденом гипофиза создаются региональные и национальные регистры больных акромегалией. В течение последних 13 лет в Москве благодаря коллективному участию сотрудников Эндокринологического научного центра МЗ РФ, Эндокринологического диспансера Департамента здравоохранения города Москвы и кафедры эндокринологии Первого МГМУ им. И.М. Сеченова успешно функционирует регистр больных акромегалией.
По данным на июль 2016 г., в Московском регистре насчитывалось 506 пациентов с акромегалией, из них 138 (27%) мужчин и 368 (73%) женщин (рис. 1). За три года, прошедших со времени последней публикации [3], были зарегистрированы 185 новых пациентов с диагнозом «акромегалия», в т.ч. 139 женщин и 46 мужчин. Средний возраст больных составил 46 лет. Пик дебюта заболевания приходится на 3–4-ю декады жизни – самые продуктивные для работоспособного населения. У 144 (26%) пациентов дебют заболевания отмечен в возрасте 50–69 лет, у 103 (20%) – в 40–49 и у 99 (19%) – в 60–69 лет. Соотношение микро-/макроаденом составило 1,0:1,4. Медикаментозное лечение аналогами соматостатина (АС) получали 263 пациента (52% от общего количества больных): из них ланреотидом (Соматулин® Аутожель®) – 65% и октреотидом – 35%.
Ведение Московского регистра позволяет осуществлять динамическое наблюдение и мониторинг лечения, а также оценивать эффективность различных терапевтических подходов к ведению пациентов с акромегалией в долгосрочном периоде.
В зависимости от клинической ситуации больным рекомендуется хирургическое, медикаментозное или лучевое лечение. Пациентам, находившимся на лекарственной терапии, проведены контроль уровней инсулиноподобного ростового фактора (ИРФ-1) и соматотропного гормона (СТГ) 1 раз в 3–6 месяцев, а также магнитно-резонансная томография 1 раз в 6–12 месяцев. Данный подход позволяется оценивать динамику проводимой терапии и при необходимости корректировать ее.
Лечение акромегалии направлено на нормализацию уровней СТГ и ИРФ-1, снижение компрессии за счет уменьшения объема опухоли, уменьшение клинических проявлений, а также снижение смертности в долгосрочной перспективе [4, 5].

Транссфеноидальная аденомэктомия является терапией первой линии при микроаденомах и интреселлярных макроаденомах [6–8]. Хирургический подход также показан при появлении масс-эффекта растущей опухоли, в частности сужения полей зрения. Однако хирургическое вмешательство эффективно лишь в 60% случаев и малоэффективно в случае макроаденом [9]. В ряде случаев операция не может быть проведена из-за тяжелого соматического состояния пациента либо его отказа.
Лучевую терапию обычно назначают в качестве терапии третьей линии (после хирургии и фармакотерапии) или при резидуальной несекретирующей опухоли в послеоперационном периоде [10].
Более половины больных СТГ-секретирующими аденомами гипофиза нуждаются в длительном применении АС (ланреотид, октреотид) пролонгированного действия. Противоопухолевый эффект АС реализуется прямыми и непрямыми механизмами через активацию SSTR1-5 соматостатиновых рецепторов на поверхности опухолевых клеток, а также клеток микроокружения и зависит от экспрессии SSTR и их подтипов. Доказаны антипролиферативный и проапоптотический эффекты АС, реализуемые за счет активации рецепторов SSTR, прежде всего подтипа 2а [11–13].
 Согласно последнему консенсусу Европейского общества эндокринологов (ноябрь 2014 г.), АС являются препаратом выбора при невозможности проведения оперативного лечения (неоперабельная опухоль или наличие противопоказаний к хирургическому вмешательству), отклонении биохимических показателей и наличии симптомов заболевания без масс-эффекта опухоли. В настоящее время группа АС представлена двумя препаратами: ланреотидом и октреотидом [14]. Согласно данным последних исследований, ланреотид можно применять с кратностью 1 раз в 8 недель [15, 16], что повышает приверженность пациентов лечению и снижает его стоимость. Удобная форма выпуска – предварительно заполненный шприц – позволяет пациентам или их близким выполнять инъекции самостоятельно в домашних условиях [17, 18]. Однако даже при наличии таких возможностей терапии важной проблемой остается разработка лекарственных схем, позволяющих обеспечивать контроль акромегалии у больных с частичной или полной резистентностью к АС. Среди предлагаемых решений обсуждаются следующие: эскалация дозы, сокращение межинъекционного интервала, замена препаратов группы АС, добавление к АС агонистов дофамина [19].
Согласно последнему консенсусу Европейского общества эндокринологов (ноябрь 2014 г.), АС являются препаратом выбора при невозможности проведения оперативного лечения (неоперабельная опухоль или наличие противопоказаний к хирургическому вмешательству), отклонении биохимических показателей и наличии симптомов заболевания без масс-эффекта опухоли. В настоящее время группа АС представлена двумя препаратами: ланреотидом и октреотидом [14]. Согласно данным последних исследований, ланреотид можно применять с кратностью 1 раз в 8 недель [15, 16], что повышает приверженность пациентов лечению и снижает его стоимость. Удобная форма выпуска – предварительно заполненный шприц – позволяет пациентам или их близким выполнять инъекции самостоятельно в домашних условиях [17, 18]. Однако даже при наличии таких возможностей терапии важной проблемой остается разработка лекарственных схем, позволяющих обеспечивать контроль акромегалии у больных с частичной или полной резистентностью к АС. Среди предлагаемых решений обсуждаются следующие: эскалация дозы, сокращение межинъекционного интервала, замена препаратов группы АС, добавление к АС агонистов дофамина [19].
В рамках ведения регистра авторы продолжили наблюдение за пациентами, которым была проведена смена АС из-за неэффективности предшествовавшей терапии или выраженных побочных эффектов использованного ранее средства. В частности, речь идет о переводе пациентов с максимальных доз октреотид-содержащих препаратов (Сандостатин ЛАР®, Октреотид-депо®, Октреотид-лонг®) на ланреотид (Соматулин® Аутожель® 120 мг) в максимальной дозировке. Анализ долгосрочной эффективности ланреотида для пациентов, прежде получавших октреотид, представляет как научный, так и практический интерес. С данной целью был проведен ретроспективный анализ карт пациентов из Московского регистра больных акромегалией.
Материал и методы
В данный ретроспективный анализ были включены 118 пациентов, переведенных с октреотида (различные дозы) на ланреотид в период с октября 2009 по июль 2016 г. Все эти больные были разделены на две группы. В 1-ю группу вошли пациенты, которых перевели на ланреотид в период с октября 2009 по июль 2013 г. (97 человек). Сведения о них были опубликованы ранее [3]. Во 2-ю группу были включены пациенты, начавшие получать ланреотид после предшествовавшей терапии октреотидом с июля 2013 по июль 2016 г. (21 человек). Таким образом, можно оценить долгосрочные результаты терапии и переносимость ланреотида пациентами, получавшими препарат в течение нескольких лет, и больными, которые начали получать его сравнительно недавно.
Причинами перевода пациентов на ланреотид стали непереносимость октреотида; недостаточный терапевтический эффект (резистентность к проводимой терапии); возможность назначения препарата с увеличенными интервалами введения; необходимость проведения инъекций в домашних условиях.
Результаты
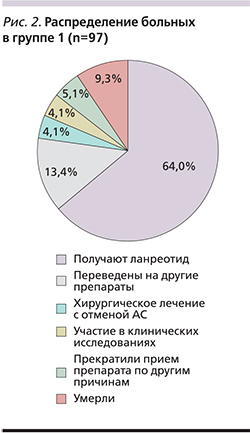
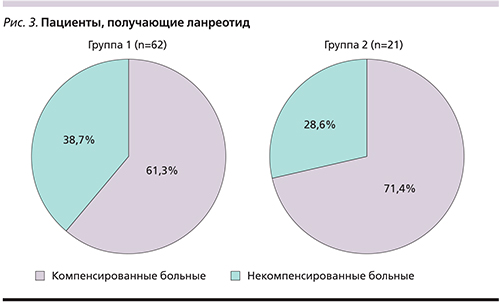
Среди пациентов первой группы, включившей 97 пациентов, Соматулин® Аутожель® по-прежнему получают 62 (64%) человека, из них 17 (27,4%) находятся на комбинированной терапии с каберголином (Достинекс). Тридцать пять (36%) пациентов прекратили прием препарата по различным причинам: 9 (9,3%) – умерли в течение срока наблюдения; 13 (13,4%) – были переведены на другие препараты в связи с непереносимостью, неэффективностью или по другой причине. Четырем (4,1%) пациентам была проведена радикальная операция, не потребовавшая дальнейшей медикаментозной терапии; 4 (4,1%) человека стали участниками клинических исследований и еще 5 (5,1%) пациентов прекратили принимать препарат по различным причинам (рис. 2). Из пациентов, продолжавших принимать Соматулин® Аутожель®, компенсация отмечена у 38 (61,3%) больных (рис. 3). У одной пациентки на фоне приема ланреотида наступила беременность. Препарат был отменен на 7-й неделе, беременность закончилась физиологическими родами в срок. Родился живой доношенный мальчик. После родов терапия ланреотидом была продолжена. Одна пациентка принимала Соматулин® Аутожель® 1 раз в 8 недель в домашних условиях в связи с невозможностью самостоятельно передвигаться после перенесенного инсульта. При этом средний уровень ИРФ-1 до назначения ланреотида составлял 214,25 нг/мл, а после перевода на указанную схему лечения – 181,2 нг/мл. У четырех пациентов после перевода с октреотида в связи с компенсацией состояния был увеличен межинъекционный интервал. Таким образом, 1 пациент получал Соматулин® Аутожель® с кратностью 1 раз в 6 недель и 3 пациента – 1 раз в 8 недель. При этом у всех пациентов наблюдалась клинико-биохимическая компенсация, в т.ч. нормализация уровня ИРФ-1, средняя концентрация которого составила 130,5 нг/мл.
Во 2-й группе пациентов (21 человек) компенсация на фоне приема ланреотида наступила у 15 человек (71,4%) (рис. 3). У двоих пациенток с непереносимостью октреотида наблюдалась хорошая переносимость ланреотида с положительным клиническим и биохимическим ответом. У 5 пациентов было отмечено значительное снижение уровня ИРФ-1 по сравнению с исходным (т.е. на момент перевода).
Обсуждение
Ведение Регистра пациентов с акромегалией позволяет контролировать результаты проводимой терапии, а также получать сведения об эффективности и переносимости АС. Отсутствие возможности оперативного вмешательства или отказ пациента от него приводит к необходимости проведения медикаментозной терапии, где основной группой препаратов являются АС.
Согласно современным рекомендациям, терапия АС показана:
- после проведенного оперативного вмешательства при сохранении симптомов заболевания;
- в качестве первичного лечения пациентов с неоперабельной опухолью, инвазией опухоли в кавернозный синус без сдавления области перекреста зрительных нервов или при невозможности проведения оперативного вмешательства (например, отказ пациента, сопутствующая соматическая патология);
- в качестве адъювантной терапии пациентов с выраженными симптомами акромегалии, повышением уровня СТГ, но без выраженных локальных симптомов, вызываемых опухолью (отсутствие масс-эффекта опухоли).
В случае неполного ответа на терапию АС возможно комбинированное лечение с каберголином или пегвисомантом (последний в России не зарегистрирован) [14].
По заключению Американской ассоциации клинических эндокринологов, октреотид и ланреотид обладают сопоставимым профилем эффективности и безопасности (класс рекомендации В, уровень доказательности 2) [6].
В то же время во многих исследованиях показано, что для пациентов с непереносимостью одного из АС возможно эффективное и безопасное применение другого препарата данного класса [20, 21].
В одном из исследований было показано, что перевод пациентов с октреотида ЛАР на ланреотид с увеличением межинъекционного интервала позволил сохранить лечебный эффект и контроль за биохимичекими показателями, а также упростить лечебный режим и повысить приверженность к терапии. К концу исследования подавляющее большинство пациентов отдавали предпочтение ланреотиду [22].
Нередки ситуации, когда больные в силу тяжести соматического статуса (или при необходимости выезда в другой регион) не в состоянии строго в определенное время посещать лечебное учреждение для проведения очередной инъекции, что чревато нежелательными перерывами в лечении. В этом случае решением является проведение инъекций в домашних условиях самими пациентами или их близкими, что не снижает эффективности терапии [23]. В Московском регистре были пациенты, желавшие проводить инъекции в домашних условиях самостоятельно или с помощью родственников. В связи с этим они были переведены на ланреотид (Соматулин® Аутожель®) с хорошим терапевтическим эффектом. Таким образом, перевод больных с октреотид-содержащих препаратов на ланреотид (Соматулин® Аутожель® 120 мг) при сохранении лечебного эффекта позволяет упростить режим инъекций и повысить степень свободы пациента. Частично резистентным к АС больным комбинация ланреотида с каберголином позволяет снижать затраты на лечение и достигать эффективного контроля заболевания у бóльшего числа пациентов, чем при изолированном увеличении дозы АС.



